HPLC法测定番茄红素胶束中番茄红素Z/E异构体含量
2022-02-21马雪红刘婷李传天朱金芳
马雪红,刘婷,李传天,朱金芳
(新疆农业大学食品科学与药学学院,乌鲁木齐 830052)
0 引言
【研究意义】番茄红素(Lycopene)广泛存在于自然界的各种植物中,成熟的红色植物(番茄、西瓜等)果实中含量较高,属于异戊二烯类化合物[1]。新疆温差大、日照长、降雨量少,生产的番茄含番茄红素量高[2]。近年来,番茄红素因具有降低多种慢性非传染性疾病的发病风险而引起广泛关注[3-10]。【前人研究进展】番茄红素分子中含有11个共轭以及两个非共轭碳碳双键。由于其分子结果高度的不饱和性,使其存在多种几何异构体,理论上存在211即2 048种立体异构体,但由于分子链上的甲基位阻效应,很大程度上限制了重排的数目,实际的异构体数量要小得多,番茄红素只存在72种异构体,而现实中能检测到的主要异构体有:全反式(all-E)和单-顺异构体即(5Z)、(9Z)、(13Z)及(15Z)番茄红素等几种[11,12]。【本研究切入点】番茄红素存在不溶于水、易发生顺反异构转化和稳定性差等问题[13-15],且人体摄入的天然番茄红素的生物利用度低(约为10%~30%)[16]。需采用HPLC法测定番茄红素胶束中番茄红素Z/E异构体含量。【拟解决的关键问题】将脂溶性的番茄红素包载于牛血清白蛋白载体中,形成水溶性的纳米胶束,以提高番茄红素的稳定性,增加其水溶性;采用手性柱简化异构体洗脱方法,使番茄红素各异构体得到良好分离。采用HPLC法测定番茄红素胶束中Z/E异构体含量,为番茄红素胶束的质量控制及稳定性评价提供依据。
1 材料与方法
1.1 材料
全反式番茄红素对照品(039M4100V,Sigma,纯度99.5%)。
番茄红素胶束、空白胶束(实验室自制);乙腈,甲醇,甲基叔丁基醚,为色谱纯,其他试剂均为分析纯。
TG16-W微量高速离心机(长沙湘仪离心仪器有限公司);LC-16高效液相色谱仪(日本岛津,PDA检测器);RE-52A型旋转蒸发器(上海亚荣);KQ5200DE型数控超声波清洗器(昆山市超声仪器有限公司);BSA-124S电子天平(赛多利斯科学仪器北京有限公司)。
1.2 方法
1.2.1 色谱条件
色谱柱:YMC Carotenoid S-5(4.6×250 mm);流动相A:乙腈B:甲基叔丁基醚;线性梯度洗脱B在15 min内由0%增加至50%,15~25 min内B由50%增加至60%,25~35 min内B由60%增加至65%,35~40 min内B由65%减少至0%;流速:1 mL/min;检测波长:472 nm;PDA检测器光谱收集范围:200~800 nm;进样量:20µL;柱温:30℃。
1.2.2 全反式番茄红素对照品溶液的配制
制备109.45µg/mL的番茄红素对照品储备液,精密量取对照品储备液1 mL,置于10 mL棕色容量瓶中加丙酮定容,即得浓度为10.945µg/mL的全反式番茄红素对照品溶液。
1.2.3 供试品溶液的配制
将番茄红素胶束溶液经0.22µm微孔滤膜过滤,精密吸取过滤后的番茄红素胶束溶液100µL,置于10 mL棕色容量瓶中,加入1 mL三氯甲烷充分振摇溶解番茄红素和胶束材料,再加入丙酮破乳定容,13 000 r/min离心15 min,取上清液即得。
空白胶束溶液配制方法同供试品溶液。
1.2.4 系统适用性试验
取上述对照品溶液、供试品溶液适量,按1.2.1项下色谱条件进样测定。图1
1.2.5 标准曲线绘制
精密吸取全反式番茄红素对照品储备液20、60、150、200、350、600µL,置于10 mL棕色容量瓶中,用丙酮为稀释剂配制成浓度分别为0.22、0.66、1.64、2.19、3.83和6.57µg/mL的全反式番茄红素对照品标准液,按1.2.1项下色谱条件依次进样,以对照品浓度(x)为横坐标,全反式番茄红素峰面积(y)为纵坐标,绘制标准曲线,得到回归方程。
1.2.6 精密度试验
精密吸取取番茄红素对照品溶液6份,按1.2.1项色谱条件连续测定并记录全反式番茄红素的峰面积,计算RSD值。
1.2.7 稳定性试验
取番茄红素胶束溶液100µL,置于10 mL棕色容量瓶中,加入1 mL三氯甲烷充分振摇,再加入丙酮定容,于0、1、2、4、6、8、12、24 h按1.2.1项色谱条件测定,计算RSD值。
1.2.8 重复性试验
取相同浓度的番茄红素胶束溶液6份,每份100µL,按1.2.3项制备供试品溶液,按1.2.1项色谱条件测定,计算RSD值。
1.2.9 加样回收率试验
取相同浓度的番茄红素胶束溶液9份,每份100µL,分别加入适量番茄红素对照品溶液,按1.2.3项制备供试品溶液,按1.2.1项色谱条件测定,计算加样回收率。
1.2.10 样品含量测定
取三批番茄红素胶束按1.2.3项配制供试品溶液,按1.2.1项色谱条件测定,每批样品测定3次,按公式(1)计算番茄红素胶束中全反式番茄红素的含量。

式中,C为全反式番茄红素浓度(µg/mL),由峰面积代入标曲计算得出;D为稀释倍数,此处番茄红素胶束的稀释倍数为100倍。
1.2.11 番茄红素异构体的鉴别及含量计算
参考文献方法[17,18],利用PDA检测器从以上供试品HPLC色谱图中提取各组分峰最高点处的全波长光谱图,鉴别番茄红素异构体并截取300~600 nm的特征区域。根据其光谱信息计算Q值,即在361~362 nm处出现的顺式特征吸收峰与最大吸收波长的主吸收峰472 nm吸光度的比值,再结合特征吸收峰位置及单峰保留时间鉴别番茄红素异构体。以保留时间定性,待测溶液峰面积与标准溶液峰面积比较定量。采用峰面积归一化法计算番茄红素异构体的含量。
顺式结构的番茄红素与全反式番茄红素相比,其紫外-可见光谱图会向短波长方向紫移,且摩尔吸收系数减小[19]。
2 结果与分析
2.1 系统适用性实验
研究表明,溶剂空白和空白胶束对照溶液对番茄红素的测定无干扰,且番茄红素胶束供试品中全反式番茄红素的保留时间与对照品溶液色谱图一致,且与相邻峰完全分离(R=1.647),理论塔板数>5 000,符合要求。图1
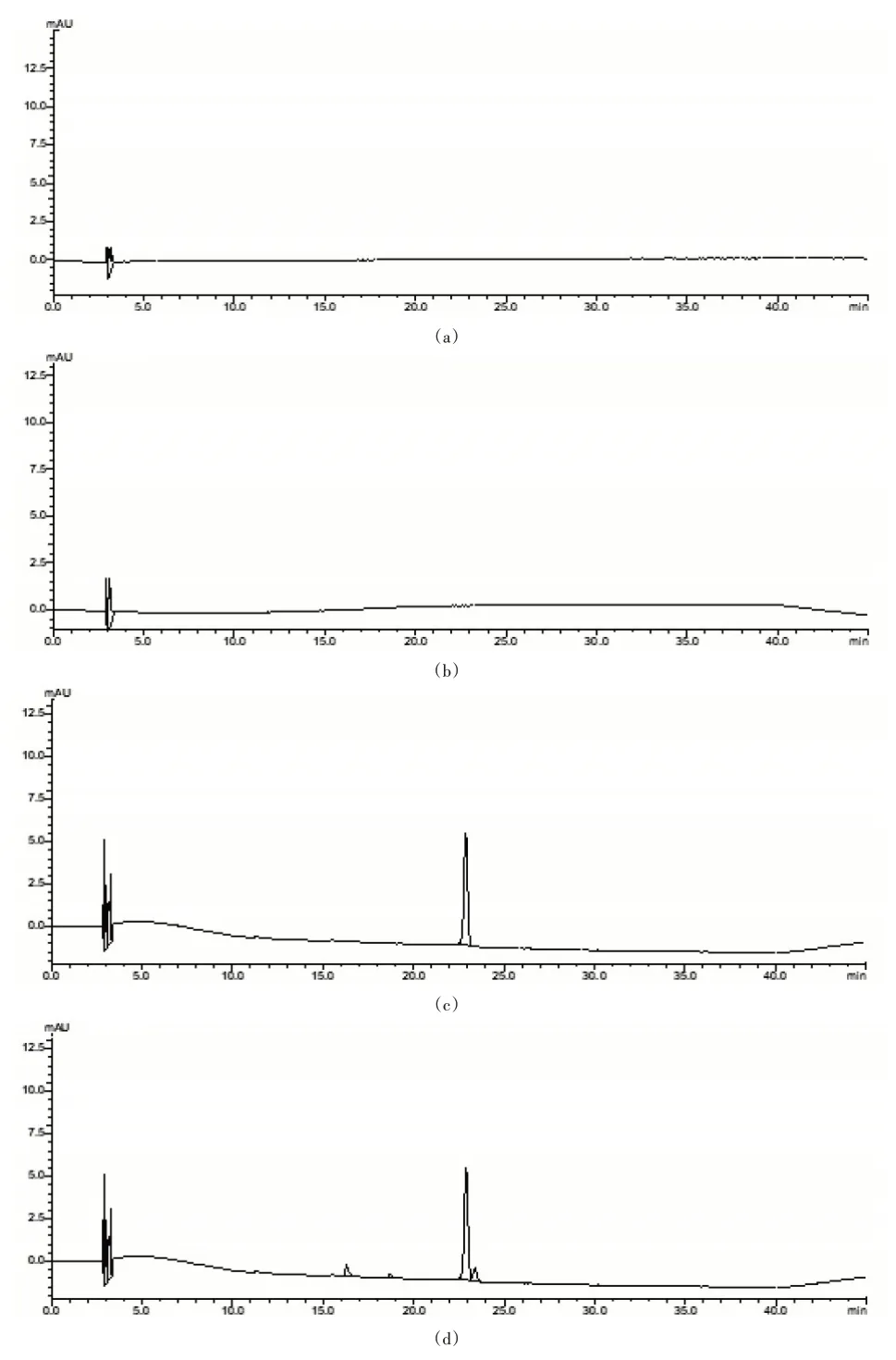
图1 系统适用性试验HPLC图谱Fig.1 System suitability test HPLC pattern
2.2 标准曲线的建立
研究表明,回归方程为y=14 629x+1 221.1,r=0.999 6。全反式番茄红素在0.22~6.57µg/mL与峰面积呈良好的线性关系。图2
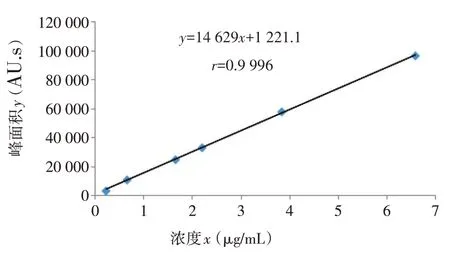
图2 全反式番茄红素对照品标准曲线Fig.2 Standard curve of all-trans lycopene reference substance
2.3 精密度、稳定性、重复性、加样回收率
研究表明,进样6次,平均峰面积33 652,全反式番茄红素峰面积的RSD为0.73%(n=6),仪器精密度良好。
番茄红素胶束含量的RSD为0.69%(n=8),供试品中番茄红素在常温放置24 h基本稳定。表1

表1 稳定性试验(n=8)Table 1 Stabilitytest results(n=8)
进样6次,平均含量370µg/mL,番茄红素胶束含量的RSD为0.73%(n=6),所用测定方法重复性好。
番茄红素胶束平均加样回收率为100.06%,RSD为1.99%(n=9),回收率良好,方法准确度较高。表2
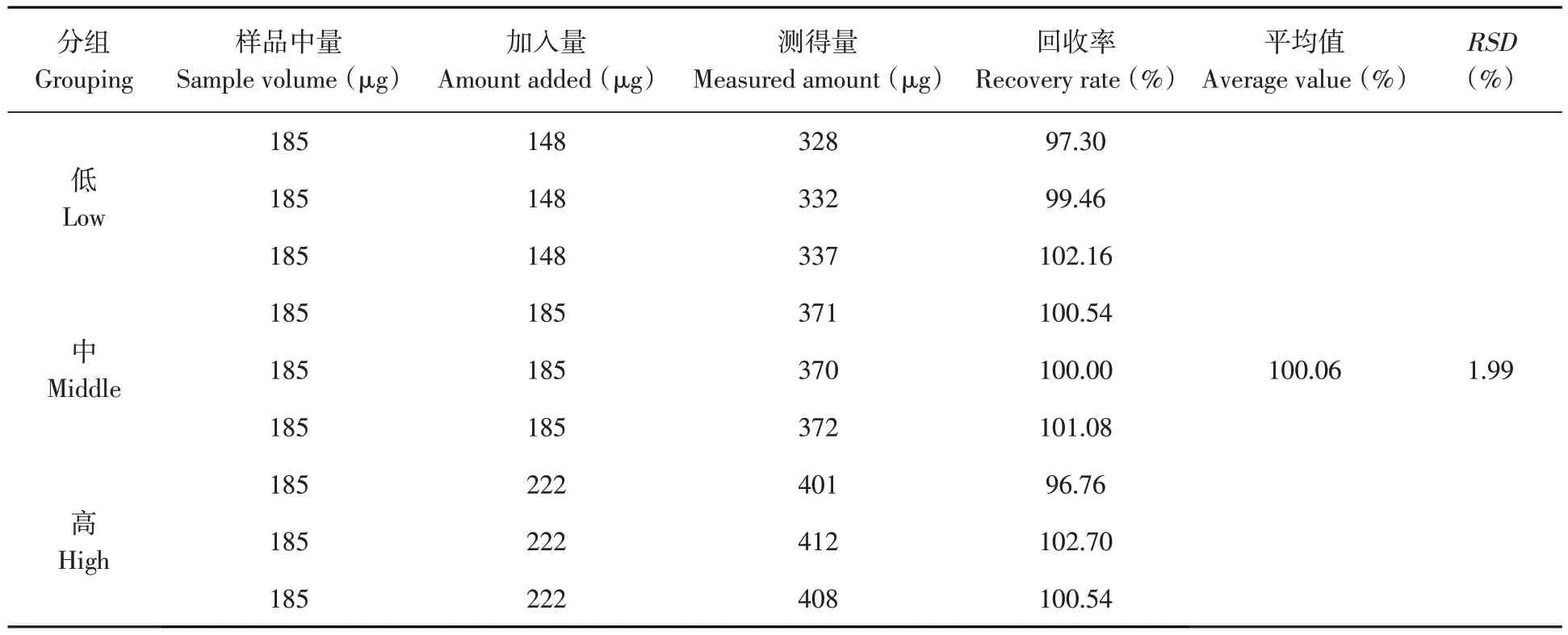
表2 加样回收率试验结果(n=9)Table 2 Sample recovery test(n=9)
2.4 三批样品含量测定
研究表明,3批样品重复测定3次批内RSD值均小于1%,该方法重复性较好;不同批次样品批间RSD值为0.54%,样品制备工艺稳定,批间含量差异较小。表3
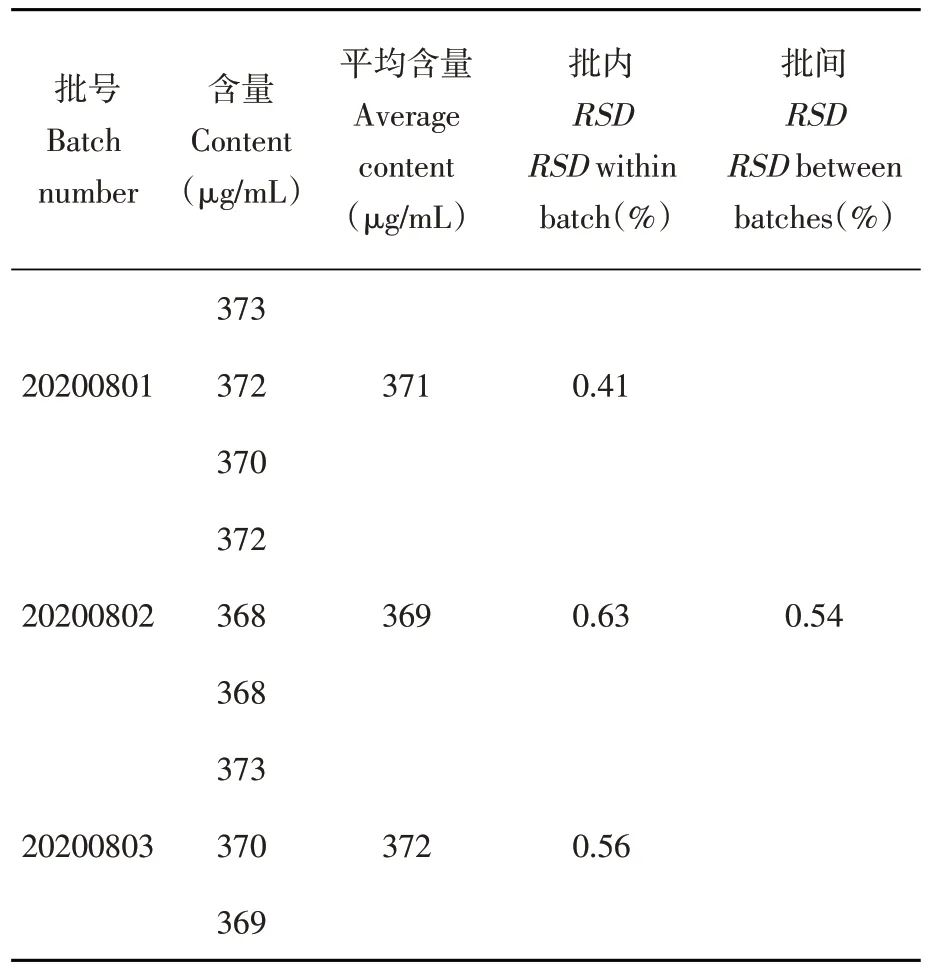
表3 番茄红素胶束含量测定(n=9)Table 3 Determination of lycopene micelles(n=9)
2.5 番茄红素异构体的鉴别
研究表明,4个峰的紫外-可见光谱在波长为400~600 nm区段的峰形与全反式番茄红素相似,峰位稍有移动,都在470 nm左右有最强吸收峰,而顺式番茄红素分子不仅在472 nm左右处出现“山字”峰形的主吸收峰,且在360~362 nm处还会有一个明显的特征吸收峰,番茄红素胶束的异构体为:1号峰13Z,2号峰9Z,3号峰All-E,4号峰5Z。表4,图3~5
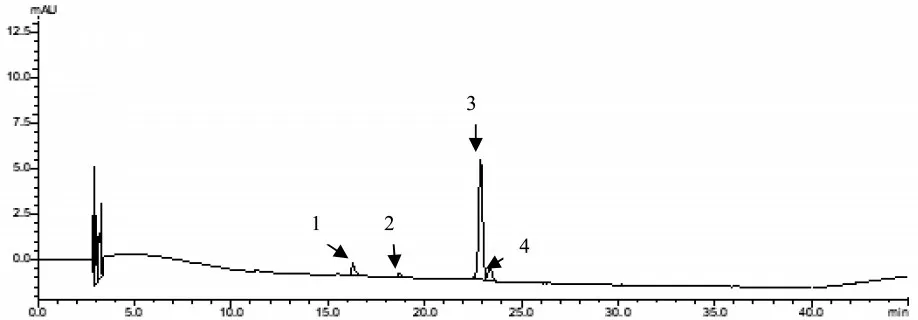
图3 番茄红素胶束的HPLC图谱Fig.3 HPLC chromatogramsof lycopene micelles
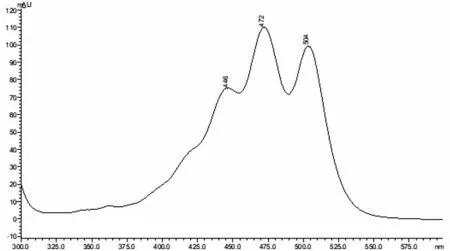
图4 全反式番茄红素对照品的UV-Vis图谱Fig.4 UV-Vis image of all-trans lycopene standard
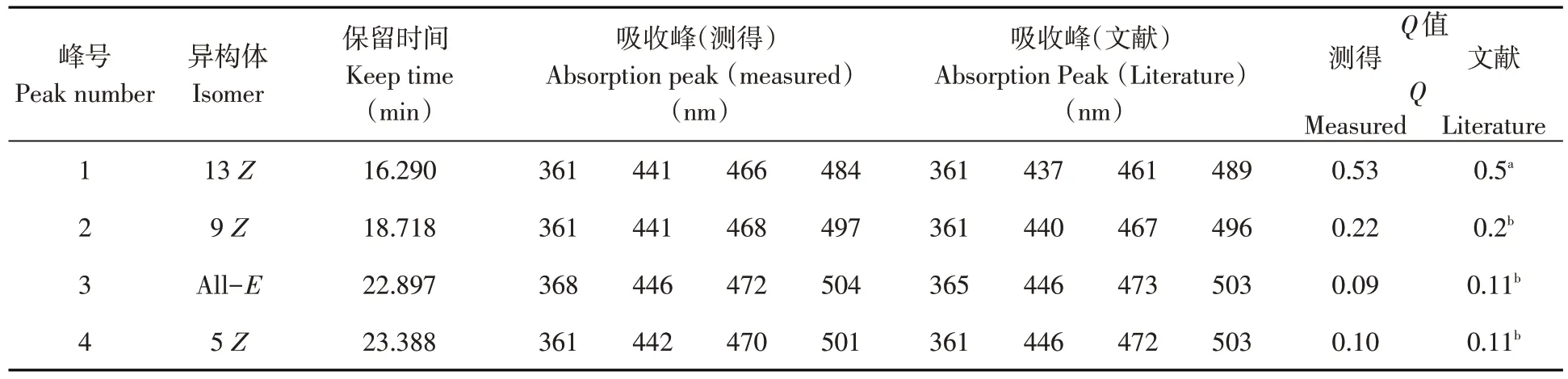
表4 番茄红素顺反异构体的鉴定Table 4 Identification of cis-trans isomers of lycopene

图5 峰1-4的UV-Vis图谱Fig.5 UV-Vis spectrum of Peak 1-4
2.6 番茄红素胶束中异构体含量计算
研究表明,制备所得的番茄红素胶束中包含全反式番茄红素和三种顺式异构体,顺式异构体中含量最多的为13Z,其次为5Z,含量最少的为9Z。表5
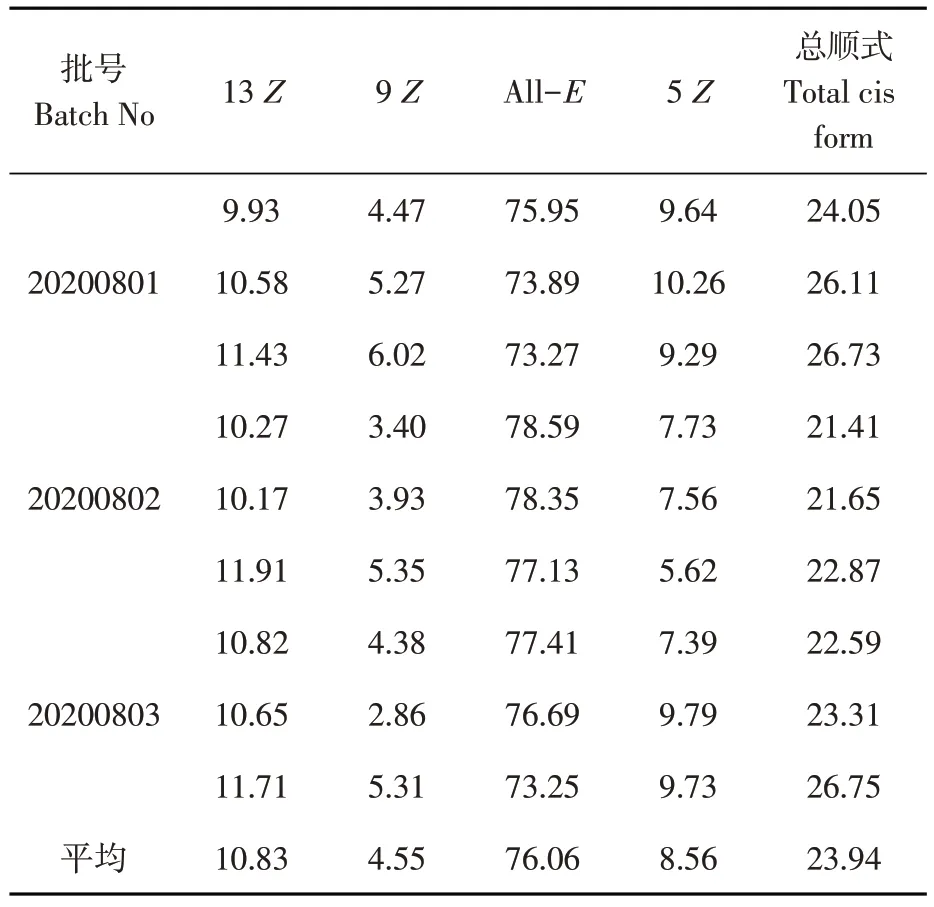
表5 番茄红素顺反异构体的鉴定Table 5 The proportion of isomers in lycopene micelles
3 讨论
3.1 异构体鉴别
研究番茄红素异构体的鉴别结果与文献报道基本一致[20,21]。采用吸收峰的UV-Vis光谱图“山字峰”的特征及Q值对其异构体进行鉴别[17-18,22]。实验的Q值(360~362 nm范围的最大吸收值与459~476 nm范围的最大吸收值的比值)通过与已发表的文献比较[21,23]。3种单顺式异构体也是人体血清和组织中番茄红素的主要存在形式[24,25]。顺式结构的番茄红素与全反式番茄红素相比,其紫外-可见光谱图会向短波长方向紫移,且摩尔吸收系数减小[21]。顺式番茄红素分子不仅在472 nm左右处出现“山字”峰形的主吸收峰,且在360~362 nm处还会有一个明显的特征吸收峰,与文献报道基本一致[21,22]。采用吸收峰的UV-Vis光谱图“山字峰”的特征及Q值对其异构体鉴别[17-18,23]。试验的Q值(360~362 nm最大吸收值与459~476 nm最大吸收值的比值)通过与文献比较[19,20],由于样品处理方法的不同及HPLC检测中流动相的差异,UV-Vis光谱图中各异构体的吸收峰及Q值与文献报道略有差异,但不影响判断。13Z,5Z,9Z这三种单顺式异构体也是人体血清和组织中番茄红素的主要存在形式[24,25]。
3.2 流动相体系的选择
参考前人研究中番茄红素异构体的HPLC测定方法[29,30],比较了乙腈∶甲基叔丁基醚=45∶55和乙腈∶甲醇∶甲基叔丁基醚=37.5∶12.5∶50两种不同的流动相体系。以乙腈∶甲基叔丁基醚=45∶55为流动相时,分离出4个异构体,且峰面积和分离度较好;而以乙腈∶甲醇∶甲基叔丁基醚=37.5∶12.5∶50为流动相时,只分离出3个异构体,峰面积较小,洗脱效果较差。实验采用乙腈和甲基叔丁基醚为流动相。
3.3 温度的选择
分别比较了柱温为30、35、40和45℃条件下各异构体的分离度,发现随着柱温的升高,保留时间逐渐提前,全反式番茄红素的峰面积逐渐减小,且分离度变差,温度的升高会加速番茄红素的降解[31,32],选择30℃作为分析柱温。
4 结论
建立了番茄红素胶束中异构体的含量测定方法,采用YMC Carotenoid S-5(4.6×250 mm)色谱柱;流动相A:乙腈B:甲基叔丁基醚;线性梯度洗脱;流速:1 mL/min;检测波长:472 nm;柱温:30℃,在45 min内完成异构体的分离检测。该方法快速、准确、简便、专属性强;分离出了包括全反式番茄红素在内的4个异构体,鉴定出了3个顺式异构体分别为13Z,9Z和5Z,测定了3批番茄红素胶束中各异构体的含量。
