物流运输振动对采后哈密瓜贮藏期软化和细胞壁降解酶的影响
2022-02-21王梓名张连文谢晓定
徐 斌,张 婷,潘 俨,王梓名,张连文,谢晓定
(1.新疆农业科学院农产品贮藏加工研究所,乌鲁木齐 830091;2.天津商业大学,天津 300134;3.新疆工程学院,乌鲁木齐 830023)
0 引言
【研究意义】新疆哈密瓜种植面积超过6.82×104hm2,年产量超过246.42×104t,其中外销型哈密瓜约180×104t,占总量的72%[1]。目前哈密瓜外销主要运输方式还是以公路运输为主,长距离的运输及振动胁迫会促进哈密瓜的呼吸作用,加速果实衰老、腐烂。【前人研究进展】曾媛媛等[2]研究了长途运输对哈密瓜贮藏品质的影响,发现运输振动能够加速哈密瓜的生理生化反应进而加快哈密瓜成熟衰老。周然等[3]研究了模拟不同等级道路运输振动对哈密瓜软化和果胶降解的影响,发现振动会加快哈密瓜贮藏期间果胶的降解,加速哈密瓜的生理软化。徐斌等[4]研究了模拟运输振动对不同堆高哈密瓜果实质地品质的影响,发现连续低频振动4 d后哈密瓜果肉硬度下降较快,振动对顶层堆高哈密瓜果实硬度影响较大。潘俨[5]等研究发现底层堆装果实运输途中温度高、发病率高,货架期8 d后商品率明显降低。【本研究切入点】有关采后物流运输振动对哈密瓜贮期果肉软化和细胞壁降解酶的影响研究文献较少。需研究采后振动对哈密瓜贮藏期软化的影响。【拟解决的关键问题】采用7 Hz低频振动24 h,比较分析经过振动胁迫和没有振动胁迫的哈密瓜,在贮藏期间整果达到破裂所需最大静压力及果肉硬度和细胞壁降解酶变化规律,分析低频振动对哈密瓜果实贮藏过程中细胞壁降解酶的影响,为研究降低振动对哈密瓜品质损伤的方法提供理论基础。
1 材料与方法
1.1 材料
试验选用哈密瓜于2020年8月25日采摘自五家渠市103团,品种为西州密17号。于开花后(55±2)d采摘,剔除病果、伤果、等外果,挑选果形大小相似,单果质量2.5~3.0 kg,可溶性固形物含量范围在15.0%~18.0%,单果套发泡网装入瓦楞纸箱内,3~4个瓜/箱,待测。
TBS-630型低频振动试验台(苏州苏试试验集团公司,规格:630×630×45 mm);CMT6000系列电子万能试验机(深圳美特斯公司);TMS-Pro多功能质构仪(美国FTC公司)。
1.2 方法
1.2.1 试验设计
果实采摘装车后当天运往新疆农业科学院加工所,将挑选出来的果实分2组:振动处理组(ZD);静置对照组(CK)。将ZD组固定在振动平台上,单层放置4箱,码放3层共12箱。将振动平台振动频率调为7 Hz,连续振动24 h后置于室温贮藏。CK组不经过振动直接在室温贮藏。每隔5 d取样测试,测试指标包括:整果破裂时承载最大压力、果肉硬度、β-半乳糖苷酶(β-galactosidase,β-GAL)活性、纤维素酶(Cellulase,CEL)活性、果胶酯酶(Pectinesterase,PE)活性、多聚半乳糖醛酸酶(Polygalacturonase,PG)活性。
1.2.2 测定指标
(1)低频振动。将振动组哈密瓜固定在振动平台上,开机将振动平台频率调至7 Hz,连续振动24 h后关机,取下哈密瓜放置室温贮藏。
(2)静态压缩。将待测瓜体水平放置压缩试验平台,手动调整下压探头高度略高于瓜体表面,设定下压速度2 mm/min,观察位移/受力曲线,待果实裂开停止试验,记录压裂时的最大承载力,每组试验3次重复。
(3)硬度。将哈密瓜去皮,用Ф20 mm打孔器在瓜体赤道部位取圆柱形瓜样。使用TMS-Pro质构仪,采用Ф75 mm的圆柱形探头P/75测试瓜样。测试参数:测前速度200 mm/min,测试速度60 mm/min,测后上行速度200 mm/min,果肉受压形变百分量40%,两次压缩停顿时间为10 s,起始力为0.1 N。每组试验做3次重复,由质地特征曲线得到评价哈密瓜果肉硬度。
(4)细胞壁降解酶活性。多聚半乳糖醛酸酶(PG)和纤维素酶(CEL)活性的测定方法参考Wei et al.[6]测540 nm吸光值,使用煮沸灭活后的粗酶液反应作为对照。PG酶活单位定义为每小时在37℃条件下催化多聚半乳糖醛酸产生1µg半乳糖醛酸所需的酶量。CEL酶活单位定义为每小时在37℃条件下催化羧甲基纤维素产生1 mg葡萄糖所需的酶量。使用考马斯亮蓝法测定样品蛋白浓度,以牛血清蛋白制作标准曲线。果胶酯酶(PE)活性的测定参考Zhang et al.[7]的方法。取3 g果肉于研钵中,加入6 mL缓冲液(12%聚乙二醇,0.2%硫酸氢钠)在冰上研磨。将匀浆倒入离心管中离心(12 000 g,15 min,4℃)。弃上清,离心管中加入6 mL0.2%的硫酸氢钠水溶液。混匀后离心(12 000 g,10 min,4℃)。弃上清,沉淀用8 mL的提取液(7.5%氯化钠,1%PVP)重悬,然后放置在4℃条件下4 h,期间不断混匀。12 000 g离心20 min收集上清液用于酶活性的测定。反应液包含10 mL果胶溶液(1%),2 mL粗酶液。反应前用NaOH溶液将pH调至7.4。在37℃水浴锅中反应1 h,期间不断加入NaOH溶液使溶液pH维持在7.4。PE酶活单位定义为每小时在37℃条件下消耗1mmol NaOH所需的酶量。β-半乳糖苷酶(β-GAL)活性的测定参考张贤聪[8]方法,将0.5 mL 50 mmol/L乙酸缓冲液(pH=5.0)与底物0.18 mL16 mmol/L对硝基苯β-D-半乳糖苷混合,加入0.12 mL酶液后37℃震荡90 min,结束后立即加入0.2 mL Na2CO3终止反应,与400 nm波长测量吸光度。制作一系列已知浓度的对硝基苯酚标准曲线,酶活单位定义为每克果肉鲜重每分钟催化反应的产物毫摩尔数。
1.3 数据处理
利用Excel 2007软件统计初始数据,以平均值±标准误表示。显著性使用SPSS20.0分析。双样本比较使用独立样本T检验,多样本比较使用LSD-T检验分析,P<0.05;用Sigmaplot12.0软件进行整理绘图。
2 结果与分析
2.1 受迫振动对哈密瓜果实最大压力的影响
研究表明,西州密17号哈密瓜果实承受的最大压力随贮藏时间的延长而降低,在整个贮期内对照组和振动处理组果实承受的最大压力均表现出先快速下降后缓慢下降的变化趋势。果实承受的最大压力无论是前期快速下降还是后期缓慢下降,振动处理组下降幅度更加明显,在25 d时,对照组承受的最大压力是振动组的1.75倍(P<0.01),振动胁迫能够显著降低果实承受的最大压力,加速果实软化程度。图1
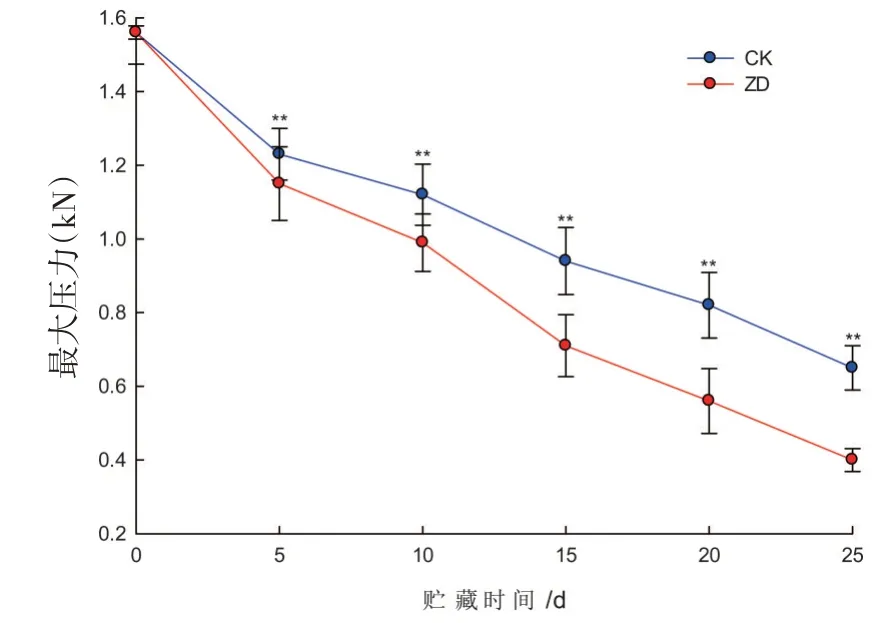
图1 哈密瓜果实最大压力变化Fig.1 The change of Hami melon maximum pressure
2.2 受迫振动对哈密瓜果肉硬度的影响
研究表明,西州密17号哈密瓜果肉硬度随贮藏时间延长呈下降趋势,与果实承受最大压力的变化趋势相同。CK组与ZD组呈现较明显的差异,CK组在贮藏前15 d果肉硬度下降缓慢,之后呈快速下降趋势。振动处理组在贮藏前10 d,果肉硬度下降较快,之后5 d变化不明显,贮藏15 d后出现快速下降的变化。在25 d时,对照组果肉硬度是振动处理组的5倍,振动处理对哈密瓜果肉硬度影响较大,加速了果肉硬度下降。图2
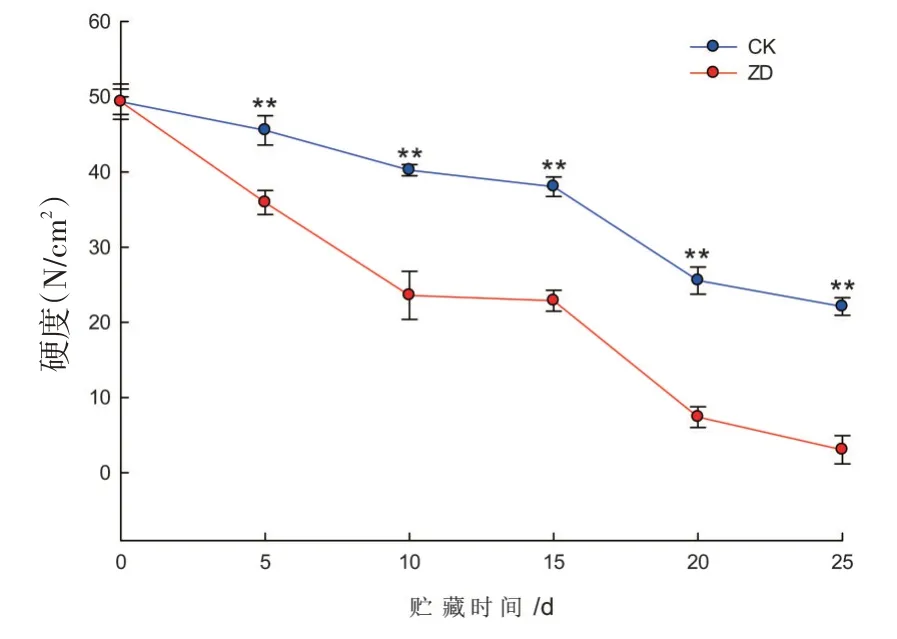
图2 哈密瓜果肉硬度变化Fig.2 The change of Hami melon pulp’s hardness
2.3 受迫振动对哈密瓜果肉PG活性的影响
研究表明,西州密17号哈密瓜在贮藏期果肉PG活性呈先升高后降低的趋势,在第15 d出现了峰值,ZD组PG活性峰值显著高于CK(P<0.05),比CK高出0.1个酶活单位。贮藏15 d后,两组果肉PG活均呈下降趋势,ZD组下降缓慢且始终高于CK,振动胁迫可显著提高果肉PG活性表达水平,加速果胶物质降解。图3

图3 哈密瓜果肉PG活性变化Fig.3 The change of Hami melon pulp’s PGactivity
2.4 受迫振动对哈密瓜果肉CEL活性的影响
研究表明,西州密17号哈密瓜果肉CEL活性在25 d贮藏期内呈先升高后降低的变化趋势,与PG变化趋势相似,ZD组果肉CEL活性在贮期内始终显著高于CK组(P<0.05)。在贮藏第15 d,两组果肉CEL活性均达到峰值,ZD组是CK的1.3倍。贮藏15 d后,2组CEL活性开始下降,在第25 d,ZD组是CK的1.1倍。振动胁迫可显著提升哈密瓜果肉CEL活性的表达。图4
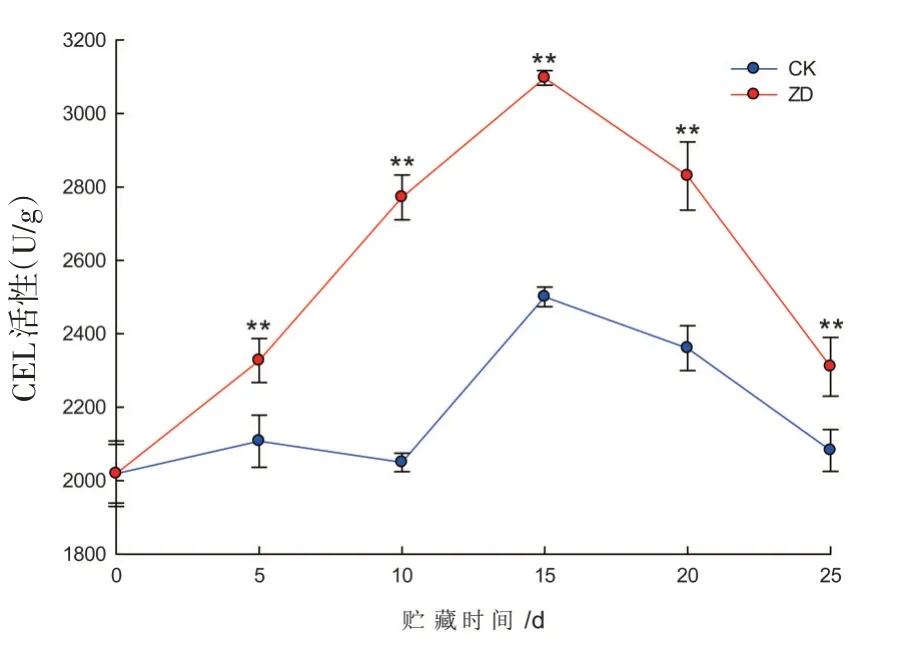
图4 哈密瓜果肉CEL活性变化Fig.4 The change of Hami melon pulp’s CEL activity
2.5 受迫振动对哈密瓜果肉PE活性的影响
研究表明,果肉PE活性在贮期内呈先升高后降低的变化趋势。贮藏前期两组果肉PE活性存在显著差异(P<0.01),在第5 d、第10 d,ZD组果肉PE活性分别是CK组的1.5倍和1.2倍,从第15 d开始至贮期结束,2组果肉PE活性接近,差异不显著。在贮藏前期,振动胁迫可显著提升哈密瓜果肉PE活性,但贮藏后期,果肉PE活性的表达水平与振动胁迫的影响不大。图5
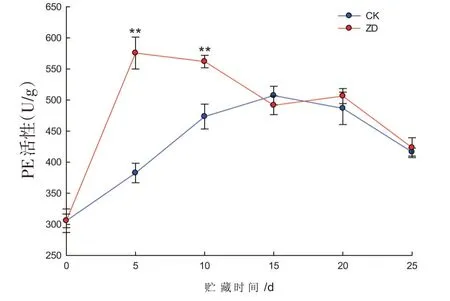
图5 哈密瓜果肉PE活性的变化Fig.5 The change of Hami melon pulp’s PE activity
2.6 受迫振动对哈密瓜果肉β-GAL活性的影响
研究表明,西州密17号哈密瓜在贮藏期内果肉β-GAL活性呈逐渐上升的变化趋势,在贮藏前期,两组果肉β-GAL活性存在差异但不显著,贮藏后期,两组果肉β-GAL活性没有明显差异。第10 d,ZD组果肉β-GAL活性是CK组的1.1倍,从第10d开始至贮期结束,2组果肉β-GAL活性表达水平相近,几乎没有差异,振动胁迫对哈密瓜贮藏期内果肉β-GAL活性影响不明显。图6
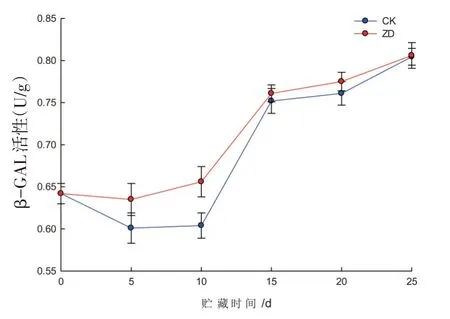
图6 哈密瓜果肉β-GAL活性的变化Fig.6 The change of Hami melon pulp’sβ-GAL activity
3 讨论
PG是一种果胶降解酶,是参与细胞壁降解的重要酶之一,可通过水解反应裂解连接两个半乳糖醛酸的糖苷键[4]。PE可以催化果胶甲酯基的水解,导致果胶去甲酯化,使果胶更容易被PG降解[5]从而参与细胞壁的降解。β-GAL是一种可以降解β-D-半乳糖残基的糖苷酶,在果实软化过程中,β-GAL的底物主要为RG-I果胶半乳糖侧链和有半乳糖残基的木葡聚糖,β-GAL可通过降解具有支链的多聚醛酸使细胞壁组分变得不稳定,从而促使细胞壁降解[6]。果实软化的主要机制是果肉细胞胞间果胶质降解,细胞相互分离。在果实成熟过程中,原果胶不断降解为可溶性果胶,细胞结构也随之受损,胞间层电子密度降低,并且随着微纤维丝间果胶和纤维素物质的溶解,微纤维丝结构变得松弛而软化,细胞壁变薄,大量细胞壁结构消失,细胞变圆且趋于分散,果肉硬度随之下降[5]。试验发现,哈密瓜在贮藏过程中,果实所能承受最大压力和果肉硬度随着时间延长逐渐下降,而振动胁迫会显著加快这种下降速率(P<0.05),尤其在贮藏15 d后,振动胁迫对果实软化的影响更加明显。研究发现,在贮藏期间,PG和CEL活性变化趋势相似,与对照组相比,振动胁迫显著提升了果肉PG和CEL活性表达水平,PG是一种果胶降解酶,CEL是纤维素酶,西州密17号哈密瓜果实软化速度与PG、CEL活性表达水平有关,PG、CEL活性水平高会加速果实细胞壁中的果胶、纤维素等多糖类物质降解,从而加快果肉软化速度。振动胁迫对哈密瓜果肉PE活性的影响表现为,贮藏前期有显著影响,贮藏后期尤其是15 d以后,无显著影响。与对照组相比振动胁迫对哈密瓜果实贮藏期内β-GAL活性表达水平没有显著影响。
果实采后软化是一种高度协同的不可逆转的现象,涉及一系列生理、生化和感官品质的变化,这在呼吸跃变型果实中更加明显,哈密瓜是典型的呼吸跃变型果实,采后后熟软化现象严重,试验设置了振动处理组和非振动处理组,测定了4种主要参与细胞壁降解的酶的活性,对比分析了振动胁迫对哈密瓜采后果实软化的影响,振动胁迫是如何调控果实软化作用机制尚需要进一步研究。
4 结论
西州密17号哈密瓜采后常温贮藏期内,果实承受最大压力和果肉硬度呈逐渐下降的变化趋势,PG活性、CEL活性、PE活性均呈先升高后降低的变化趋势,β-GAL活性呈逐渐升高的变化趋势。振动胁迫可显著降低果实的最大压力和果肉硬度。振动胁迫可显著提高果肉CEL活性表达水平,在贮藏前15 d,振动胁迫可显著提高果肉PE活性表达水平,对贮藏后期的影响不明显,振动胁迫可显著提高贮藏后期果肉PG活性表达水平,振动胁迫对贮期果肉β-GAL活性影响不明显。
