大肠杆菌fliC基因失活突变株的构建及其特征
2022-02-21赵行行程玉梅崔古贞齐晓岚
赵行行,程玉梅,陈 娴,崔古贞,齐晓岚,洪 伟
(1.贵州医科大学 地方病与少数民族疾病教育部重点实验室,贵阳 550004;2.贵州医科大学 附属医院ICU,贵阳 550004;3.青岛大学附属医院 检验科,青岛 266061;4.贵州医科大学 微生物学教研室,贵阳 550025)
在大肠杆菌中fliC基因编码的鞭毛蛋白是细菌鞭毛的主要结构亚基,其在细菌感染、免疫以及分类学鉴定等方面起重要作用[1]。鞭毛作为大部分细菌最主要的运动器官,除具有调控细菌运动的作用外,还能够介导细菌的黏附、趋化、侵袭等能力[2-3]。它能使细菌附着在宿主体内并获取营养物质,也参与一系列致病过程,如机体的炎症反应、损坏机体器官、引起氧化应激等[4]。对该基因的研究,在大肠杆菌中fliC基因的缺失对细菌的运动、黏附、侵袭、毒力因子的表达等均有影响[5-7]。除此之外,fliC基因在大肠杆菌生物被膜的形成及成熟过程中具有促进作用。生物被膜是由细菌菌群及自身分泌的胞外基质组成,同时也是细菌为维持自身生命所发生形态学上的变化,从而增强细菌对外界环境的抵抗力[8]。细菌生物被膜的存在可以抵抗人体的免疫清除及临床抗生素的作用,最终导致细菌耐药性升高、致病能力增强,引起人体严重感染,对人类的健康造成重大危害[9]。据美国国立卫生研究院统计,约有65%的微生物感染和80%的慢性感染与生物被膜相关[10]。
Thermotargetron基因编辑技术(TMT,图1)由嗜热二型内含子RNA(TeI3c/4c)和逆转录酶(Reverse transcriptase,RT)编码基因组成[11]。通过“归巢(Retrohoming)”效应实现靶基因的失活。首先,TeI3c/4c和RT共同形成的核糖核蛋白复合体(RNP),TeI3c/4c通过碱基互补配对原则识别基因组中的靶位点;然后,RT发挥DNA核酸内切酶和逆转录酶的活性[12],切割双链DNA靶位点并以内含子RNA为模板合成cDNA插入其中;最后,DNA缺口由宿主DNA修复机制以cDNA为模板合成互补DNA,最终实现内含子RNA在靶基因位点的“归巢(Retrohoming)”。

(a)RNP由TeI3c/4c及RT酶组成,RNP通过碱基互补配对的原理识别靶向DNA;(b)反向剪接将TeI3c/4c序列反转录成cDNA并插入靶位点;(c)DNA缺口由宿主DNA修复机制修补。
研究应用TMT系统构建fliC基因失活突变株,在生物被膜形成能力明显降低的情况下,通过自溶、pH敏感性、抗生素耐受性等试验探讨该基因失活后对大肠杆菌在应激状态下的影响。
1 材料和方法
1.1 材料
1.1.1 培养基与试剂
Luria-Bertani(LB)培养基:酵母提取物(Yeast extract)5 g/L、氯化钠(NaCl)10 g/L、胰蛋白胨(Tryptone)10 g/L。
琼脂粉(Agar powder)、氯霉素(Chloramphenicol,Chl)、甲砜霉素(Thiamphenicol)、甲硝唑(Metronidazole)、氨苄青霉素(Ampicillin)、D-环丝氨酸(D-cycloserine)、红霉素(Erythromycin)、链霉素(Streptomycin)、四环素(Tetracycline)、诺氟沙星(Norfloxacin)购于上海阿拉丁生化科技股份有限公司;SpeI-HF(R3553L),BsiWI-HF(R3133L)购于北京New England BioLabs;琼脂糖凝胶DNA回收试剂盒、质粒小提试剂盒购于天根生化科技(北京)有限公司;大肠杆菌HMS174(DE3)细胞购自北京诺禾致源科技股份有限公司。所有引物合成及测序均由生工生物工程(上海)股份有限公司完成。
1.1.2 菌株与培养条件
质粒构建的宿主细胞为大肠杆菌NEBExpress高效感受态。在大肠杆菌HMS174(DE3)细胞中进行fliC基因失活突变株的构建。E.coliNEBExpress,E.coliHMS174菌株在LB培养基中,37 ℃培养。质量浓度为10 μg/mL氯霉素的LB培养基(LB-Chl)以筛选转化子。
1.2 方法
1.2.1fliC基因打靶引物的设计
E.coliHMS174(DE3)菌株基因组序列从National Center for Biotechnology Information(NCBI)数据库中获取。根据TeI3c/4c识别位点规则“5′-AAnnnnnnnnnnnnnA-3′”设计HMS174fliC420s位点基因打靶载体构建引物(表1)。
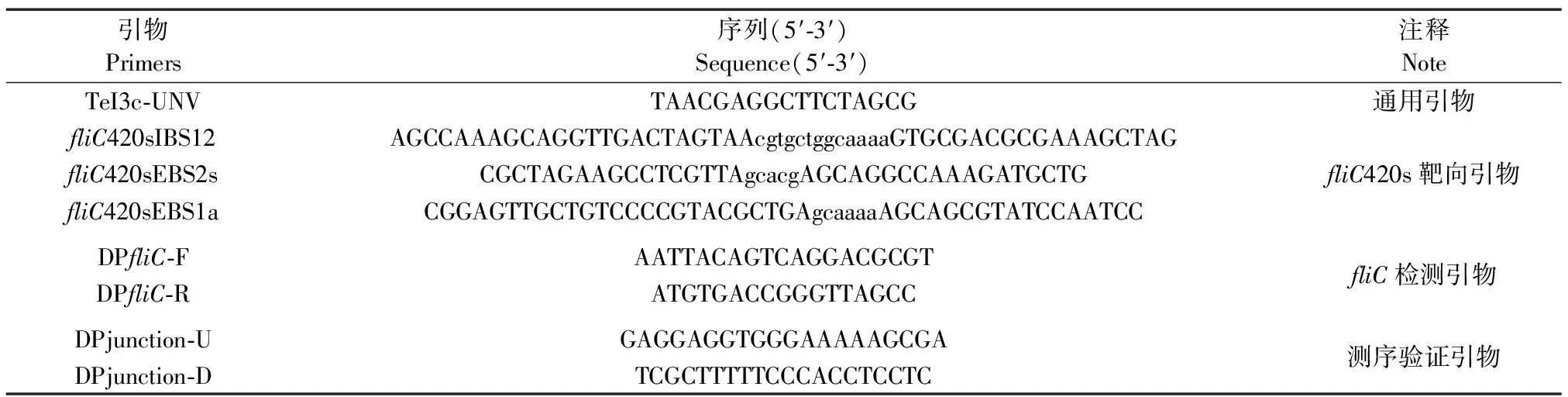
表1 引物
1.2.2 质粒构建
通过两次PCR和一次连接反应进行打靶质粒的构建。第一次PCR以IBS12与TeI3c-UNV、EBS2s与EBS1a作引物,pHK-TT1A质粒为模板(表2)分别进行扩增;第二次PCR以IBS12与EBS1a作引物,上一次PCR产物为模板将第一次PCR产物连接成为具有与目标基因互补配对的基因打靶片段。使用T5 exonuclease-dependent assembly方法(TEDA)将基因打靶片段与经BsiWI-HF、SpeI-HF线性化的pHK-TT1A载体进行重组连接[13]。重组体系转化NEBExpress感受态细胞,使用质粒提取试剂盒提取所携带质粒的转化子后,送生工生物工程(上海)股份有限公司进行测序。

表2 菌株及质粒
1.2.3 质粒转化及突变株筛选
Thermotargetron打靶质粒经测序验证构建成功后转化至HMS174感受态细胞,并涂布于LB-Chl平板。长出的单克隆挑取至LB-Chl培养基中过夜培养后转移1 mL稀释液至1.5 mL无菌离心管,37 ℃继续培养1 h,随后48 ℃ 热激1 h(激活TeI3c/4c“归巢”活性)。经稀释后涂布于LB-Chl平板上,37 ℃培养过夜。
使用fliC检测引物(表1)进行菌落PCR,检测上一步试验获得的菌落是否发生插入突变。反应条件:94 ℃预变性5 min;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸2 min 20 s,循环30次;72 ℃再延伸5 min、4 ℃ 10 min。基因失活效率=(突变株数量/总检测菌株数量)×100%。
1.2.4 质粒丢失
在无抗性培养基中连续传代以丢失基因失活突变株的质粒,具体方法:以1∶100的比例将突变株接种到无抗性LB液体培养基中,37 ℃,200 r/min培养8 h,按此方法连续转接10次,最后划线于无抗性LB平板上。长出单克隆后,使用影印平板法[15],将克隆挑取至LB-Chl和LB平板,37 ℃恒温培养24 h。质粒丢失效率=丢失氯霉素抗性克隆数/总检测克隆数×100%。
1.2.5 生长曲线的测定
取100 μL的野生型HMS174和ΔfliC420s菌液分别接种于LB液体培养基,37 ℃、250 r/min恒温培养至两者的OD600值均为0.8,各取100 μL加入新鲜的LB液体培养基中,37 ℃、250 r/min恒温培养,每间隔3 h测定OD600值,重复试验3次,取平均值,并绘制生长曲线。
1.2.6 运动能力检测
将野生型HMS174与ΔfliC420 s分别用灭菌牙签穿刺含5 g/L琼脂粉的LB半固体培养基中,设置3个重复。正置于恒温培箱,37 ℃培养过夜后,观察并测量圆环直径(细菌会依赖鞭毛以接种点为中心在培养基表面向周围泳动生长,并形成一个圆环)。
1.2.7 生物被膜定量检测
通过96孔微量板法检测大肠杆菌生物被膜表型,将野生型HMS174和ΔfliC420s分别接种于LB液体培养基中,37 ℃,230 r/min培养12 h,按1∶100的比例,用LB稀释过夜培养物。再37 ℃ 230 r/min培养细菌OD600至0.8。取菌液200 μL加于96孔板中,置于恒温培养箱,37 ℃培养24 h,M9作为空白对照。吸去培养基,用PBS洗液洗3次,用4%多聚甲醛固定15 min,结晶紫染色10 min,然后用去离子水洗净,自然干燥后,加33%冰醋酸将结晶紫溶解,酶标仪测OD600值。生物被膜判定标准:将空白对照平均D值(X)加上其3倍的标准差定义为临界值(cut-off值,Dc)。基于临界值Dc,菌株生物被膜可以分为D≤Dc为不黏附(-);Dc
1.2.8 自溶试验
将野生型HMS174与ΔfliC420s的过夜培养物在LB中稀释至OD600=0.05,再转接新鲜LB液体培养基37 ℃培养至OD600=0.8。收集菌体,洗涤两次,将其悬浮于含0.01% Triton X-100的50 mmol/L磷酸钾缓冲液(pH 7.0)中。然后每30 min检测37 ℃培养的菌悬液OD600值,观察细胞裂解情况。
1.2.9 pH敏感性试验
分别配制pH值为1、2、3、4、5、6、7、8、9、10、11和12的LB液体培养基,灭菌冷却后以1∶100比例接种已培养至OD600=0.8的野生型HMS174与ΔfliC420s,培养6 h,测量OD600值,判断是否生长。
1.2.10 抗生素耐受性检测
测定野生型HMS174与ΔfliC420s对甲砜霉素、甲硝唑、氨苄青霉素、D-环丝氨酸、红霉素、链霉素、四环素、诺氟沙星的耐受性[17]。96孔板中含150 μL LB培养基,使用倍比稀释法加入上述抗生素使其终质量浓度为256、128、64、32、16、8、4、2、1、0.5 μg/mL,菌株以5%接种率接至96孔板中,每组设置3个重复。37 ℃培养24 h后测定OD600值处的吸光值,OD600≥0.1视为菌体生长。
2 结果与分析
2.1 fliC基因打靶位点设计
fliC基因(ECHMS174_01916)在大肠杆菌HMS174中的序列全长为1 497 bp,见图2(a)。在fliC基因中选择符合TeI3c/4c识别位点规则的fliC420s(5′-AAcgtgctggcaaaaA-3′)。利用PCR突变野生型TeI3c/4c IBS1/2,EBS1/2位点,构建能特异性识别fliC420s位点的打靶质粒pHK-TT1A-fliC420s,见图2(b)。

(a)TMT的fliC420s靶向位点;(b)fliC420s靶向位点的碱基组成。
2.2 质粒构建
基于pHK-TT1A质粒构建打靶载体,此过程需要进行两次PCR和一次连接反应(图3)。首次PCR反应以pHK-TT1A为模板,使用fliC420sIBS12/TeI3c-UNV,fliC420sEBS2s/fliC420sEBS1a为引物(表1),通过PCR扩增获得含有296 bp(IBS1/2)、114 bp(EBS1/2)的突变片段,见图4(a)。第二次PCR以上一步PCR获得的IBS1/2,EBS1/2突变片段为模板,以fliC420sIBS12/fliC420sEBS1a为引物,通过重叠延伸PCR扩增获得具有特异性识别位点的片段(393 bp),见图4(b)。使用TEDA法将特异性识别位点片段与线性化的pHK-TT1A载体进行重组连接[13],以获得pHK-TT1A-fliC420s打靶质粒。

图 3 Thermotargetron载体构建

(a)含有突变的IBS1/2(296 bp)和EBS1/2(114 bp)位点的扩增子;(b)重叠延伸PCR组装IBS1/2和 EBS1/2扩增子。
2.3 突变株筛选及测序验证
使用fliC基因检测引物(DPfliC-F/DPfliC-R,表1)进行菌落PCR鉴定经“归巢(Retrohoming)”后的转化子,PCR扩增条带比野生型菌株增加839 bp,表明TeI3c/4c二型内含子成功失活fliC基因[1 558和2 397 bp,图5(a)],获得ΔfliC420s。ΔfliC420s基因失活效率为86%,见图5(b)。测序结果表明,TeI3c/4c二型内含子成功插入大肠杆菌HMS174 ΔfliC420s基因中的预期位点,见图5(c)。
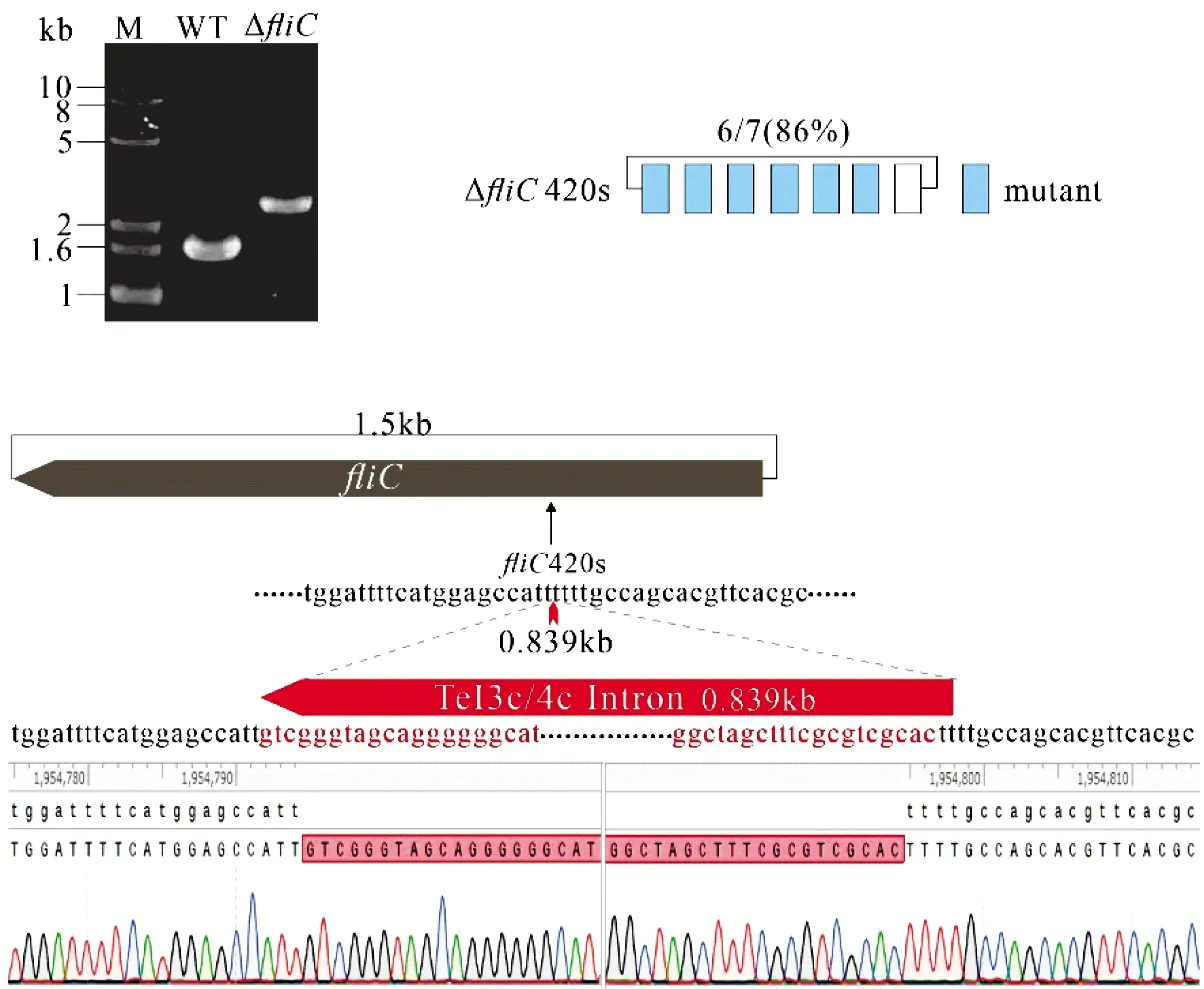
(a)PCR筛选ΔfliC420s(M:DNA marker,WT:野生型,ΔfliC:fliC420s突变株);(b)基因失活效率为86%;(c)TeI3c/4c成功插入fliC基因靶位点。测序数据处理使用SnapGene 4.1.8(GSL Biotech LLC)。
2.4 质粒丢失
初次筛选获得的ΔfliC420s仍携带其基因打靶质粒pHK-TT1A-fliC420s。将该突变株连续10次在无抗性培养传代后,使用克隆平板法筛选。质粒丢失的突变株表现为在有抗性的平板上不能生长,而在无抗性平板上能生长。如图6所示,经过10次连续在无抗性培养基中传代后,质粒丢失成功(质粒丢失效率为93%,突变株检测15个克隆)。

ΔfliC420s仅在LB平板上形成菌落,而在LB-Chl平板上不形成菌落,则表明对应突变株的质粒丢失,且质粒丢失效率为93%。
2.5 大肠杆菌ΔfliC生长曲线
野生型HMS174、ΔfliC420 s分别接种于液体LB培养基中培养至对数期,再各取100 μL加入新鲜的液体LB培养基中,37 ℃振荡培养,每隔3 h取样测定1次OD600值,记录并重复上述实验3次,绘制生长曲线(图 7)。结果显示,突变株的生长速率与野生型菌株相似。

图7 野生型HMS174与ΔfliC420s生长曲线
2.6 大肠杆菌ΔfliC运动能力检测
对比野生型HMS174菌株与ΔfliC420s在半固体平板上的运动直径范围,见图8(a),ΔfliC420s基因失活菌株的泳动能力显著下降(***P<0.001)。野生型HMS174与ΔfliC420s在半固体培养基中形成的运动圆环的直径分别为(6.6±0.57)mm 和(2.3±0.57)mm,见图8(b)。
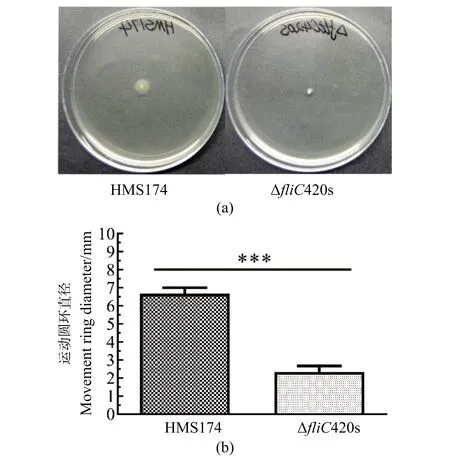
***为P<0.001。
2.7 大肠杆菌ΔfliC生物被膜表型检测
经96孔微量板筛选生物被膜结果(图9)显示,ΔfliC420s生物被膜形成能力明显弱于野生型HMS174(***P<0.001)。

***为P<0.001。
2.8 大肠杆菌ΔfliC自溶速率
自溶试验结果(图10)表明,在150 min后,野生型HMS174与ΔfliC420s相比,ΔfliC420s自溶速率快于野生型HMS174(**P<0.01,***P<0.001)。
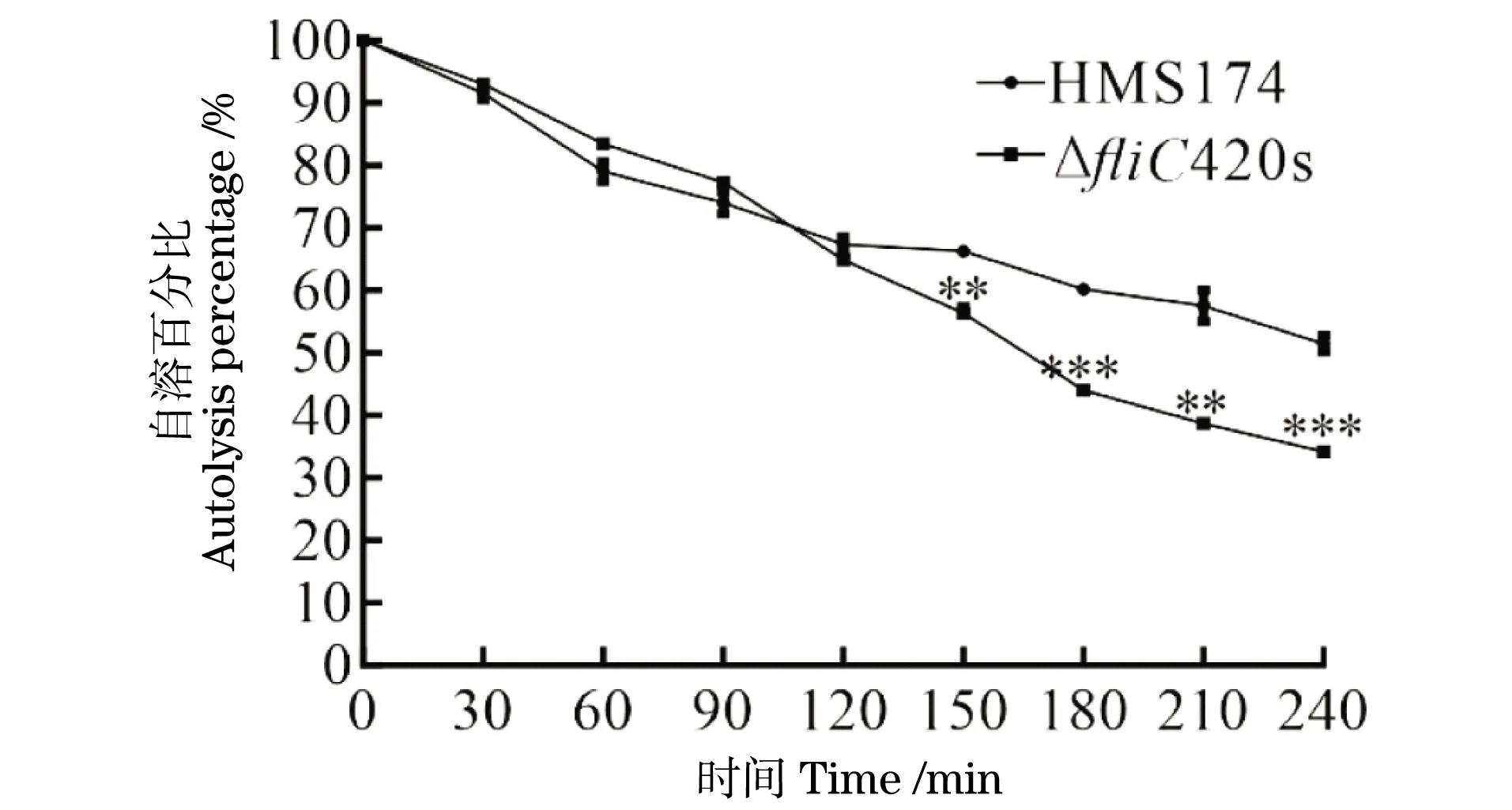
**为P<0.01;***为P<0.001。
2.9 大肠杆菌ΔfliC pH敏感性
野生型HMS174与ΔfliC420s对pH的敏感性结果(图11)表明,在pH值在4~8时,野生型和突变株均能生长,ΔfliC420s在pH 6时长势劣于野生型HMS174菌株(*P<0.05)。

*为P<0.05。
2.10 大肠杆菌ΔfliC抗生素耐受性
抗生素耐受性试验(图12)表明,野生型HMS174与ΔfliC420s对甲砜霉素、甲硝唑均耐受[图12(a)和(b)];野生型HMS174与ΔfliC420s在氨苄青霉素、链霉素和四环素的各个质量浓度生长无差异[图12(c)~(e)];在D-环丝氨酸质量浓度为32 μg/mL时[图12(f)],ΔfliC420s的生长量明显低于野生型HMS174(***P<0.001);在红霉素质量浓度为16 μg/mL时[图12(g)],ΔfliC420s的生长量明显低于野生型HMS174(**P<0.01);在诺氟沙星浓度为0.5 μg/mL时[图12(h)],ΔfliC420s的生长量明显低于野生型HMS174(**P<0.01)且ΔfliC420s在此抗生素中均表现不耐受。
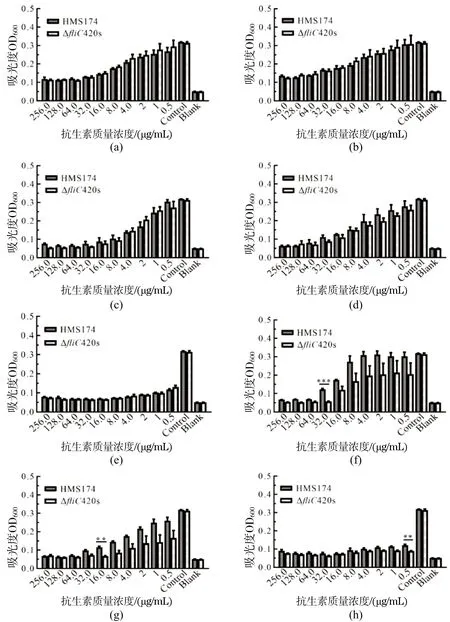
(a)甲砜霉素耐受性试验;(b)甲硝唑耐受性试验;(c)氨苄青霉素耐受性试验;(d)链霉素耐受性试验;(e)四环素耐受性试验;(f)D-环丝氨酸耐受性试验;(g)红霉素耐受性试验;(h)诺氟沙星耐受性试验。
3 讨论
利用Thermotargetron系统成功构建大肠杆菌fliC基因失活突变株,比较突变株与野生型菌株的生长速率、运动能力、生物被膜形成能力、自溶速率及对pH敏感性等生物学特征,并进一步比较两者对抗生素的耐受性,结果表明:大肠杆菌鞭毛素编码基因fliC失活后,ΔfliC420s相比野生型菌株,生长曲线结果显示两者生长速率相当;运动能力检测ΔfliC420s在半固体平板中泳动能力显著下降;生物被膜表型检测表明ΔfliC420s生物被膜形成能力明显下降。这充分证明fliC基因在大肠杆菌运动能力方面及生物被膜形成过程中发挥的重要作用。在大肠杆菌中研究发现的fliC基因以上功能[18-20],与本研究结果一致。此外,进一步探究fliC基因失活突变株在应激状态下的生物学特征,自溶试验结果显示:ΔfliC420s在细菌自溶试验的后期溶解速率加快;两者对pH敏感性范围一致,但ΔfliC420s在pH 6时长势较弱。以上结果表明了fliC基因在细菌抵抗外界压力时的重要作用。不仅如此,在抗生素耐受性试验中,ΔfliC420s对D-环丝氨酸、红霉素、诺氟沙星等3类抗生素的耐受性显著降低,即低质量浓度的抗生素即可抑制大肠杆菌的生长,而对甲砜霉素、甲硝唑、氨苄青霉素、链霉素、四环素的耐受性与野生型菌株无差异。这一发现对细菌耐药研究具有一定意义,其具体作用机制有待进一步研究。
Thermotargetron技术是不同于目前大肠杆菌基因编辑所用的技术。它是基于嗜热聚球藻(Thermosynechococcuselongatus)嗜热二型内含子TeI3c/4c建立的靶向基因失活系统[14]。此技术具有诱导条件简单(48 ℃温度诱导)、快速(热激时间短)、易控(37 ℃时打靶元件失活)和稳定(突变株稳定)等优点[14, 21]。本试验也验证了应用Thermotargetron系统构建基因失活突变株的可靠性,对大肠杆菌的基因编辑提供了新的技术方法。在构建突变株的过程中,突变株的筛选和鉴定尤为重要,研究除了利用打靶载体上的氯霉素抗性标记和菌落PCR进行筛选鉴定外,还通过DNA测序技术鉴定突变株。检测引物在靶基因的外侧,若菌落PCR扩增条带的分子质量比野生型菌株的增加839 bp,则表明TeI3c/4c二型内含子成功插入fliC基因,再将此片段进行DNA测序鉴定,通过分析比对后成功获得fliC基因失活突变株。获得突变株后,突变株在无抗性培养基中,37 ℃连续转接10次以便将突变株中的Thermotargetron打靶质粒丢失且经过连续传代的突变株可完全恢复热激前状态[22]。因此,由Thermotargetron构建的基因失活突变株可用于后续的突变株表型分析,以研究靶基因的功能。
应用Thermotargetron系统构建大肠杆菌fliC基因失活突变株,探究该突变株在应激状态下的生物学特征,阐明了fliC基因具有增强大肠杆菌对外环境抵抗力的重要作用,特别是在抗生素耐受性方面,这对该基因的研究具有重要的延伸意义,也为大肠杆菌病的预防及疫苗的研发提供一定的理论基础。
