儿童及青少年间变性大细胞淋巴瘤预后因素的Meta分析
2022-02-21杜鹃刘力
杜鹃 刘力
(天津大学儿童医院综合内科免疫方向,天津 300070)
间变性大细胞淋巴瘤(anaplastic large cell lym‑phoma,ALCL)是一种少见的T细胞来源的非霍奇金淋巴瘤(non-Hodgkin's lymphoma,NHL),由STEIN等[1]1985年首次报道。ALCL约占所有儿童NHL的10%~15%,成人NHL的1%~2%[2-3]。ALCL标志性的肿瘤细胞具有丰富、多形性的胞浆和马蹄形细胞核,表达CD30抗原[4]。相当一部分ALCL患病与间变性淋巴瘤激酶(anaplasticlymphomakinase,ALK)基因畸变有关[5]。染色体5q35上的核仁磷酸蛋白(nucleophosmin,NPM)基因与2p23上的ALK基因相互融合可导致NPM-ALK融合蛋白产生。NPM-ALK通过一些细胞下游信号通路的异常活化,如JAK/STAT3、PI3K/AKT/mTOR等通路,导致细胞增殖和凋亡失控促进淋巴瘤发生[6]。2008年世界卫生组织(WHO)进一步根据是否存在ALK基因的异常表达,将ALCL分为3个不同类型:ALK阳性ALCL、ALK阴性ALCL和原发性皮肤ALCL[7]。在儿童和青少年中,95%以上为ALK阳性病例[8]。本文主要研究儿童及青少年ALK阳性ALCL。
儿童及青少年ALCL的临床表现主要为淋巴结肿大(外周、腹膜后淋巴结和纵隔肿物),并容易发生淋巴结外侵犯,包括皮肤、骨、软组织、肺、中枢神经系统等,且经常伴随全身症状,特别是发热等B组症状(B symptoms),更多表现为高热,同时该疾病比其他类型的淋巴瘤更易出现高细胞因子血症(hypercytokinemia),甚至引发炎症因子风暴和噬血细 胞 综 合 征(hemophagocytic syndrome,HPS)[9]。ALCL有5个主要的形态学亚型:①普通型;②淋巴组织细胞型;③小细胞型;④霍奇金样型;⑤混合型[7]。免 疫 组 化 方 面,CD2、CD4和CD5为 阳 性(70%),但CD8常为阴性。大多数病例表达细胞毒性相关抗原TIA1、颗粒酶B和穿孔素。
ALCL的临床表现和体征不具有特异性,确诊常依赖于实验室检查结果和影像学检查。实验室检查中,组织病理学和免疫表型仍是重要的确诊依据。影像学检查可以尽早发现病变位置,有无淋巴结外受累,同时对疾病分期的判断也有重要意义[10]。
关于儿童及青少年ALCL的治疗,以往采用不同的一线化疗方案,儿童和青少年的无病生存率比例大致为65%~75%[11-12]。目前儿童肿瘤协作组多选择采用EICNHL-ALCL99方案治疗。该方案中蒽环类药物和烷化剂等与长期副作用相关的药物累积剂量较低,因此长期毒性有限,但一些急性的毒性反应较明显,60%患者出现4级中性粒细胞减少,15%患者出现黏膜炎,20%患者体重显著增加[4]。
ALCL化疗后仍有较高的复发率,可达20%~40%[13];针对复发ALCL患者,还有很多治疗方法可以应用。如单一使用药物长春花碱可使复发低风险患者受益[14-15];在治疗方案中添加ALK抑制剂会产生 更好 的效 果[16-17]。抗CD30抗 体Brentuximab vedotin(BV)是一种新型靶向药物,其在临床试验中对复发ALCL的治疗也取得了较满意的效果[18]。此外,PD GFRB、JAK-STAT、免疫检查点抑制剂和ALK疫苗等大量新型治疗方案正在研究和应用中[4]。对于难治复发的ALCL患者,重新化疗、应用长春花碱、靶向药物等方法使其完全缓解后再实施自体造血干细胞移植(ASCT)或异基因造血干细胞移植(allo-HSCT)是目前得到证实的有效的挽救治疗方法[19-20]。
我国对于儿童及青少年ALCL的实际疗效尚未达国际最先进水平,且这一疾病易复发,研究其预后危险因素,针对具有不同预后危险因素的患者采取精准分层和个性化的治疗方案,对改善患者预后、减少治疗的副作用等具有较大意义。但关于儿童及青少年ALCL的预后危险因素目前仍有争议,欧洲一项关于该疾病的组间研究表明:纵隔、内脏和皮肤受累是高危特征[21]。然而ALCL99(儿童ALCL中最大的前瞻性研究)不支持这些结果[22]。
本文采用Meta分析方法,对以往已发表的儿童及青少年ALCL的回顾性队列分析中关于这些有争议的临床预后因素数据进行分析,增大样本含量,增加结果的可靠性。
1 资料与方法
1.1 文献检索
1.1.1 检索范围及来源检索中文数据库包括:中国期刊全文数据库(CNKI)、万方数据库、维普数据;英文数据库包括:PubMed数据库、Embase全文数据库、Corchrane Library。计算机的检索时间限制至2020年12月31日,语言限制为英文和中文。
1.1.2 检索策略英文检索词包括“Anaplastic large cell lymphoma”“children”“adolescent”“prognosis factor”“outcome”。中文检索词包括“间变大细胞淋巴瘤”“儿童”“青少年”“预后”“临床分析”“临床研究”。
1.2 纳入及排除标准
1.2.1 纳入标准①研究对象为儿童及青少年(<22岁)ALCL患者,已明确诊断,并依据St.Jude分期对研究对象进行了分期;②涉及儿童及青少年ALCL相关预后影响因素的研究,主要为队列研究;③文献中提供了较为完整的原始生存数据可供定量计算,包括生存率风险比(hazard ratio,HR)、总生存率(overall survival,OS)、生存曲线等;以五年总生存率为结局指标,以死亡为终点,失访率≤20%;④均为公开且可获得全文的文献。
1.2.2 排除标准①综述、病例个案临床研究报道、文献评论、动物研究、会议摘要以及其他非ALCL预后相关文献。非中、英文研究文献;②文献数据不完整或没有充足的临床数据可供生存数据的计算;随访时间<5年;③未正式发表的文献(如仅有摘要的文献);同一团队重复发表的文献取数据最全的研究,排除其余研究;④研究随访过程中失访率超过20%。
1.3 文献筛选及结果由2名研究员分别进行文献筛选。首先根据文章题目和摘要选择相关文献,排除不符合纳入标准的文献后,对可能符合纳入标准的文献由2名研究员交叉核对,仔细阅读全文,如存分歧,则请第3名研究员决定。
通过上述搜索方法共检索出164篇文献。将结果导入EndNote X9软件中进行文献管理,剔除重复文献后,按照排除标准共排除151篇文献。最后选取满足标准的且能够进行定量分析的13篇文献纳入本文做定量Meta分析(图1)。

图1 文献检索流程及结果Fig.1 Flow chart of literature search and study selection
1.4 检索文献的基本特征和质量评分纳入文献样本量共1 792例,男女比例约为1.7∶1,年龄均小于22岁,分布地区包括中国台湾、英国、法国、意大利、德国、日本、韩国,发表时间为2002年至2020年,随访的时间均≥5年。
本研究纳入的文献均为回顾性队列研究,评价文献质量时由2名研究员根据纽卡斯尔-渥太华量表(Newcastle-Ottawa Quality Assessment Scale,NOS)的标准对纳入的13篇文献进行质量评分,如评分不一致,则由第3名研究员评判。NOS高质量研究为5~9分,满分为9分。纳入文献的基本特征及质量评分见表1。

表1 纳入文献基本特征及质量评分Tab.1 Basic characteristics and quality scores of the literatures
1.5 文献数据提取提取数据包括:①纳入研究的基本特征,包括文献第一作者、文献发表时间、研究发生地区、纳入研究的患者数;②暴露因素:根据纳入文献涉及的ALCL影响因素,选择有不同结果即有争议的临床因素,包括组织学病理类型、免疫表型、临床表现有无有B组症状,有无淋巴结外侵犯(包括纵隔受累、内脏累及、皮肤受累及骨髓受累);③结局指标:包括生存指标、随访时间、随访率、各组五年总生存率及各指标分别对应的生存曲线、单因素分析、多因素分析结果等。
1.6 统计学方法本文研究采用Review Manager 5.3软件对提取的数据进行统计分析。为了评价各个暴露因素对患者五年总生存率或五年无事件生存率的影响,应用HR及其95%可信区间(confi‑dence interval,CI)作为评价指标。本文获取HR的方法包括:①一些文献中已直接提供HR值及其95%CI数据;②如文献中未直接提供HR值和95%CI数据,可根据王朝阳等[34]提供的方法,对文中的RR、OR等原始数据应用Revman5.3软件实现HR的数据转换,或根据由TIEMEY等[35]提供的方法,使用Engauge Digitizer软件从Kaplan-Meier曲线上读取,将生存数据输入相应电子表格,计算出相应的HR及95%CI数据。合并的效应量如果HR的95%CI数据与1无重合,Z检验P<0.05,可认为合并结果有统计学意义,在森林图中,如果合并效应量的菱形图形与无效线不重合,则提示合并结果具有统计学意义。
本研究采用卡方检验和I2对纳入的文献进行异质性检验,当P≥0.1、I2<50%时,可认为各项研究间无异质性,应用固定效应模型进行合并分析,当P<0.1、I2≥50%时,则认为各项研究间存在异质性,采用随机效应模型进行合并分析。
对于儿童及青少年ALCL预后因素的生存分析,采取单因素和多因素分析相结合的方法。单因素分析可初步探索预测各个预后因素与患者生存率的关系,多因素分析可进一步排除其他混杂因素的影响,从而确定预后因素与患者生存率的关系,二者结合分析能更全面地反映各因素对ALCL患者预后的影响。
根据所有纳入文献中的儿童及青少年ALCL预后因素研究结果,选择了6个临床危险因素(发病年龄<10岁、有B组症状、免疫表型表达CD3、肿瘤侵犯骨髓、肿瘤侵犯纵隔和皮肤受累)进行基于Kaplan-Metier法绘制的生存曲线的单因素Meta分析。选择2个临床危险因素进行基于Cox比例风险模型的多因素Meta分析(肿瘤侵犯骨髓、病理类型为非普通型)。对这些因素分别进行数据分析后,结果如下。
2 结果
2.1 基于Kaplan-Metier法绘制的生存曲线的单因素的Meta分析
2.1.1 发病年龄和儿童及青少年ALCL预后关系的Meta分析共纳入5项研究[21,23,25-26,33],将研究对象分为>10岁及≤10岁两组,各项研究之间无异质性(P=0.91,I2=0),采用固定效应模型分析。分析结果显示差异无统计学意义[HR=1.01,95%CI(0.89,1.15),P=0.870],尚不能认为10岁以下患儿的生存率低于10岁以上患者(图2)。
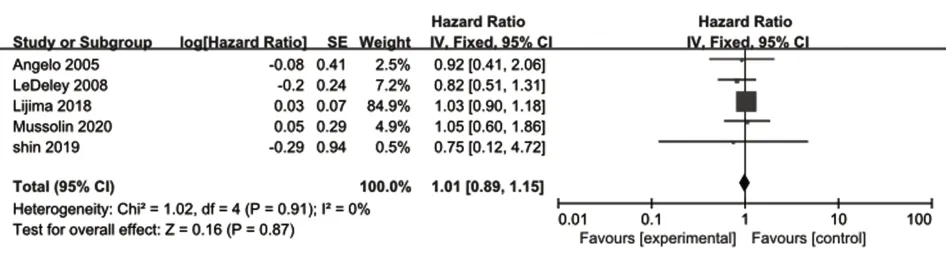
图2 发病年龄和儿童及青少年ALCL预后关系的单因素Meta分析Fig.2 Meta-analysis of univariate factor analysis on age of onset of ALCL in children and adolescents
2.1.2 临床中存在B组症状和儿童及青少年ALCL预后关系的Meta分析共纳入5项研究[21,25-27,32],5项研究均将患者分为两组,即临床有B组症状(B组症状定义为无原因的发热>38℃、盗汗、可湿透衣服或被单、就诊前6个月无其他原因体重减轻10%以上)和无B组症状,各项研究之间有轻度异质性(P=0.09,I2=50%),采用随机效应模型分析。分析结果差异有统计学意义[HR=1.43,95%CI(1.08,1.90),P=0.010],可以认为临床中存在发热等B组症状是儿童及青少年ALCL的不良预后因素(图3)。

图3 B组症状和儿童及青少年ALCL预后关系的单因素Meta分析Fig.3 Meta-analysis of univariate factor analysis on B symptoms of ALCL in children and adolescents
2.1.3 免疫表型表达CD3和儿童及青少年ALCL预后关系的Meta分析共纳入3项研究[22,25,31],以五年生存率HR为效应量指标,异质性检验结果提示无异质性(P=0.93,I2=0),使用固定效应模型进行Meta分析,结果显示合并结果有差异统计学意义[HR=2.03,95%CI(1.43,2.88),P<0.001](图4)。提示肿瘤细胞免疫表型表达CD3是儿童及青少年ALCL的不良预后因素。
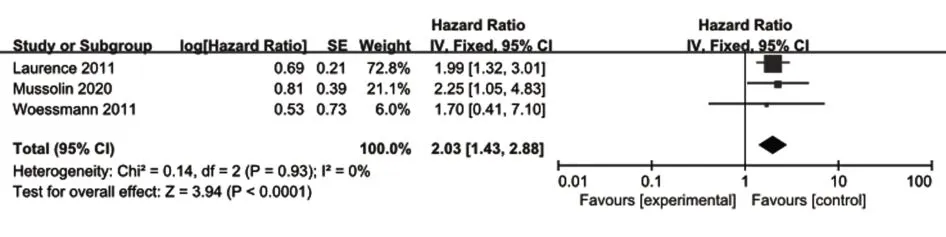
图4 是否表达免疫表型CD3和儿童及青少年ALCL预后关系的单因素Meta分析Fig.4 Meta-analysis of univariate factor analysis on CD3 expression of ALCL in children and adolescents
2.1.4 肿瘤侵犯骨髓和儿童及青少年ALCL预后关系的Meta分析纳入6项研究[21,23,25-27,29],以五年生存率HR为结局指标,异质性检验结果提示无异质性(P=0.38,I2=5%),使用固定效应模型进行Meta分析,结果显示合并结果有统计学意义[HR=2.23,95%CI(1.43,3.48),P<0.001](图5)。认为骨髓侵犯是影响儿童及青少年ALCL生存率的不良预后因素。

图5 肿瘤侵犯骨髓和儿童及青少年ALCL预后关系的单因素Meta分析Fig.5 Meta-analysis of univariate factor analysis on bone marrow involvement of ALCL in children and ado⁃lescents
2.1.5 肿瘤侵犯纵隔和儿童及青少年ALCL预后关系的Meta分析共纳入6项研究[23-27,32],异质性检验结果提示无异质性(P=0.38,I2=6%),使用固定效应模型进行Meta分析,结果显示合并结果差异无统计学意义[HR=1.17,95%CI(1.00,1.36),P=0.040](图6)。尚不能认为纵隔侵犯是儿童及青少年ALCL的不良预后因素。

图6 肿瘤侵犯纵隔和儿童及青少年ALCL预后关系的单因素Meta分析Fig.6 Meta-analysis of univariate factor analysis on mediastinal invasion of ALCL in children and adolescents
2.1.6 肿瘤侵犯皮肤对儿童及青少年ALCL预后关系Meta分析共纳入5项研究[21,23,25-26,32],异质性检验结果提示无异质性(P=0.24,I2=28%),应用固定效应模型进行Meta分析,结果显示合并结果有统计学意义[HR=1.38,95%CI(1.13,1.69),P=0.002](图7)。可以认为肿瘤侵犯皮肤对儿童及青少年ALCL的预后有不良影响。
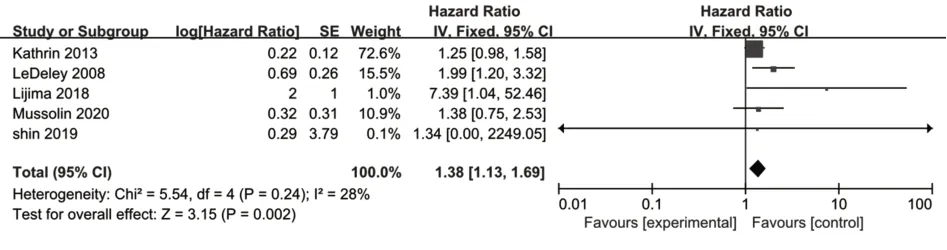
图7 皮肤受累和儿童及青少年ALCL预后关系的单因素Meta分析Fig.7 Meta-analysis of univariate factor analysis on skin involvement of ALCL in children and adolescents
2.2 基于Cox比例风险模型多因素的Meta分析
2.2.1 病理类型和儿童及青少年ALCL预后关系的Meta分析共纳入3项研究[23,29-30],均将研究对象根据病理类型分为普通型和非普通型2组,异质性检验结果提示异质性较低(P=0.21,I2=36%),使用固定效应模型进行Meta分析,结果显示合并结果有统 计 学 意 义[HR=1.99,95%CI(1.37,2.89),P<0.001](图8)。可以认为病理类型为普通型的预后相对非普通型预后较好。

图8 病理类型(普通和非普通型)和儿童及青少年ALCL预后关系的多因素Meta分析Fig.8 Meta-analysis of multivariate factor analysis on pathologic subtypes(common and non-common)of ALCL in children and adolescents
2.2.2 骨髓侵犯对于儿童及青少年ALCL五年生存率的影响纳入3项研究[23,25,29],以五年生存率HR为效应量指标,异质性检验结果提示组间无异质性(P=0.79,I2=0%),使用固定效应模型进行Meta分析,结果提示合并结果有统计学意义[HR=2.60,95%CI(1.21,5.57),P=0.010](图9)。可以认为有骨髓侵犯是影响儿童及青少年ALCL预后的独立不良预后因素。

图9 骨髓受累和儿童及青少年ALCL预后关系的多因素Meta分析Fig.9 Meta-analysis of multivariate factor analysis on bone marrow involvement of ALCL in children and adolescents
3 讨论
3.1 发病年龄对儿童及青少年ALCL预后的影响儿童及青少年ALCL诊断时的中位年龄约为12岁,1岁以内少见,男性明显多于女性。关于发病年龄是否影响ALCL预后的研究目前不多,北京儿童医院杨菁等[36]分析了我国38例儿童ALCL的临床特征,发现3岁以下的幼儿生存率明显降低。考虑可能与婴幼儿免疫功能较差,不能形成有效的针对ALK的免疫有关。本篇研究纳入的研究对象均分成>10岁和≤10岁两组,Meta分析显示两组数据差异不具有统计学意义,提示这两个年龄组的患儿五年生存率差别不明显。因婴幼儿患病率更低,需要更多研究提供小年龄患者的生存数据进一步分析3岁以下ALCL的预后。
3.2 临床中是否存在B组症状对儿童及青少年ALCL预后的影响在所有儿童及青少年NHL中,ALCL是最常出现B组症状的一类淋巴瘤,尤其是高热症状,主要与ALCL特有的高细胞因子血症有关。B组症状是否在ALCL患者中提示预后不良,目前尚无定论。BAYLE等[37]和GREWAL等[38]的研究认为B组症状为ALCL高危患者的表现,但以上研究均为病例报告,结果可能受较小的样本量影响。本篇研究对5篇文献中的B组症状单因素分析进行了合并Meta分析,结果显示有统计学意义,认为此因素与ALCL不良预后有关。
3.3 不同病理类型和儿童及青少年ALCL预后的关系2008年WHO分类中描述了ALCL 5个主要的形态学亚型。此前YOUD等[39]报道小细胞亚型预后较差,侵袭性强。本篇研究中,应用Meta分析对基于Cox回归模型多因素分析的3篇关于不同病理类型的研究进行合并,得出普通型比其他3类非普通型ALCL预后更好的结论。
3.4 内脏侵犯和皮肤侵犯对于儿童及青少年ALCL预后的影响据文献报道,在来自BFM、英国儿童癌症研究小组和法国儿童肿瘤学会的235例ALCL患者中,确定纵隔受累、肺、肝、脾受累和皮肤受累为不良预后因素。出现这3种不利因素之一的患者五年EFS为61%,而没有这3种不利因素的患者五年EFS为89%。但截至2013年,没有研究能够一致证实哪种临床因素是确切的预后不良因素[4]。本篇研究对以往的此类研究进行Meta定量分析,初步证实皮肤侵犯是儿童和青少年ALCL的预后不良因素之一。
3.5 免疫表型和儿童及青少年ALCL预后的关系
ALCL除了表达CD30,约70%的患者还表达CD2、CD4和CD5,大约2/3患者CD43为阳性,但CD8常为阴性。同时,ALCL肿瘤细胞不同程度地表达CD45和CD45RO,并强烈表达CD25[4]。在75%以上的病例中CD3表达为阴性[40]。由于相关文献较少,本文中纳入3篇异质性小的研究进行Meta定量分析,结果显示差异具有统计学意义,即CD3表达是ALCL患者预后的不良因素。另外,根据ABRAMOV等[30]报道,在包括临床危险因素、组织学亚型和CD8表达的多因素分析中,证明CD8阳性率是不良预后的独立风险因素。但由于数据较少,本文并未对此进行研究。
3.6 肿瘤侵犯骨髓对儿童及青少年ALCL预后的影响本文对骨髓受累相关单因素和多因素分析研究进行Meta分析,结果均提示差异有统计学意义,提示ALCL患儿骨髓受累是重要的独立预后不良因素,建议将此因素作为治疗分层的依据。此外,骨髓标本的检测方法目前已有了长足的进步,除了传统的骨髓涂片或者活检(仅能发现不到15%的阳性病例)[25],微小残留病变(minimal residual disease,MRD)和微小播散病变(minimal disseminated disease,MDD)的定量检测均成为ALCL骨髓受累灵敏度高且具有特异性的检测方法,尤其是NPM-ALK基因定量检测的应用,研究表明,MDD对ALCL患者的预后影响可以得到证实,且血液的检测值甚至可以代替骨髓[30]。
3.7 其他因素和儿童及青少年ALCL预后的关系和ALCL免疫学研究进展除本文中所列举的预后因素外,还有一些其他与ALCL预后相关的因素被研究者所关注,PASQUALINI等[41]研究认为噬血细胞综合征(HPS)似乎对ALCL治疗中儿童的五年生存率等预后指标没有显著影响。
此外有研究认为,针对ALK蛋白的免疫反应(即抗ALK抗体滴度)似乎与较低的临床分期和预测复发风险相关,但与OS无关[42]。2000年PULFORD等[43]检测到ALK阳性的ALCL患者血浆中循环的ALK抗体。MUSSOLIN等[44]研究了儿童ALK阳性的ALCL患者,发现虽然在统计学上不显著,但患者治疗前后ALK抗体滴度越高,复发风险越低。近期的一项研究对122例儿童NPM-ALK阳性ALCL患者在标准化疗期间的ALK的抗体效价进行了系统分析,认为ALK抗体滴度的测量可作为风险分层的预后参数或代用指标,体内ALK的抗体滴度较高的ALCL患者复发率较低,可以认为是ALCL的预后保护因素[45]。关于ALK抗体滴度的预后因素,由于缺乏可应用的统计数据,在本文中未做定量分析。
3.8 局限性本研究仍然有不可避免的局限性,如Meta分析的异质性。由于该疾病较为少见,纳入的研究有限,数据不是很充分,对于异质性较大的因素难以分析来源;同时回顾性研究都无可避免地存有混杂偏倚,这些偏倚很可能是造成各项研究之间异质性存在的原因。