成人哮喘患者Treg/Th17细胞失衡与呼出气一氧化氮的相关性研究①
2022-02-21覃松梅刘彤龙胜泽蓝娇韦彩周农向阳冉果覃雪军
覃松梅 刘彤 龙胜泽 蓝娇 韦彩周 农向阳 冉果 覃雪军
(广西壮族自治区人民医院呼吸与危重症医学科,南宁 530021)
支气管哮喘是由肥大细胞、T淋巴细胞、中性粒细胞等多种细胞和细胞组分参与的一种以气道慢性炎症为特征的异质性疾病,其发病率在逐年上升,成为最常见的慢性疾病之一[1]。据统计,全球约有4.3%人口罹患哮喘,我国最新流行病学调查资料显示哮喘的总患病率为4.2%,即我国可能有4 570万哮喘患者。哮喘的发病机制目前尚不明确,可能与感染、环境因素、过敏体质和多基因遗传等相关[2]。近年来,哮喘患者体内Treg与Th17细胞失衡逐渐被认识并日益受到关注。控制气道炎症和缓解哮喘症状是治疗哮喘的最终目标。FeNO是由气道细胞产生,可作为一种非创伤性并可直接量化气道炎症的生物标志物,已成为气道炎症研究的新热点。故本研究检测了哮喘与慢性咳嗽非哮喘患者FeNO值及外周血Treg/Th17细胞,旨在分析哮喘患者FeNO水平与Treg/Th17失衡的相关性。
1 资料与方法
1.1 资料
1.1.1 临床资料回顾分析广西壮族自治区人民医院自2017年12月至2018年6月呼吸与危重症医学科收治的慢性咳嗽患者33例,其中17例为哮喘慢性持续期及咳嗽变异性哮喘患者,16例为非哮喘及非咳嗽变异性哮喘的慢性咳嗽患者。哮喘诊断、分级分期及咳嗽变异性哮喘诊断标准参照2016年版《支气管哮喘防治指南》[3]。(1)典型哮喘的临床症状和体征:①反复发作喘息、气急,伴或不伴胸闷或咳嗽,夜间及晨间多发,常与接触变应原、冷空气、物理、化学性刺激以及上呼吸道感染、运动等有关;②发作时双肺可闻及散在或弥漫性哮鸣音,呼气相延长;③上述症状和体征可经治疗缓解或自行缓解。(2)可变气流受限的客观检查:①支气管舒张试验阳性(吸入支气管舒张剂后,FEV1增加>12%,且FEV1绝对值增加>200 ml);②支气管激发试验阳性;③呼气流量峰值(peak expiratory flow,PEF)平均每日昼夜变异率>10%,或PEF周变异率>20%。符合典型哮喘的临床症状和体征,同时具备气流受限客观检查中的任一条,并排除其他疾病所引起的喘息、气急、胸闷及咳嗽,可以诊断为哮喘。哮喘慢性持续期是指每周均不同频度和(或)不同程度地出现喘息、气急、胸闷、咳嗽等症状。非哮喘的慢性咳嗽按2015年版《咳嗽的诊断与治疗指南》[4]诊断标准排除表现为慢性咳嗽的支气管哮喘及咳嗽变异性哮喘患者。咳嗽变异性哮喘:咳嗽作为唯一或主要症状,无喘息、气急等典型哮喘的症状和体征,同时具备可变气流受限客观检查中的任一条,排除其他疾病所引起的咳嗽。慢性咳嗽诊断标准参照2015年版《咳嗽的诊断与治疗指南》[4]:咳嗽持续时间超过8周,肺部影像学未见异常。纳入标准:①所有研究对象年龄≥15周岁;②无精神障碍;③无肺炎。排除标准:①来院时处于哮喘急性发作期及缓解期的患者,由于哮喘急性发作会诱发许多相关免疫反应,而缓解期患者免疫状态相对稳定,故予排除;②合并严重心、肝、肾等脏器疾病;③近期(1个月内)采用过全身激素治疗;④妊娠或哺乳期。本研究得到了广西壮族自治区人民医院伦理委员会的批准。
1.1.2 仪器及试剂流式细胞仪(BD FACS CantoⅡ,美国);流式抗体、淋巴细胞刺激剂(BD公司,美国);标准胎牛血清(CellMax,新西兰);RPMI1640培养基(Gibco,美国);Foxp3/转录因子染色缓冲液(Thermo,美国);IL-17 ELISA试剂盒(Abcam公司,英国);酶标仪(山东高密彩虹分析GF-M3000,中国);纳库仑呼气分析仪(Sunvou,中国);MasterScreen肺功能仪(耶格公司,德国)。
1.2 方法
1.2.1 肺功能测定用力肺活量(FVC)和第1秒用力呼气容积(FEV1):由同一位经肺功能检测培训的医师完成。
1.2.2 呼出气一氧化氮测定FeNO值测定由同一位接受过培训的技师通过纳库仑呼气分析仪完成。检测前1 d禁熏制品及腌制品等食物,检测前1 h禁止进食、吸烟、剧烈运动等。使用鼻夹夹紧患者鼻部,让患者吸气到最大肺活量通过滤嘴缓慢向测试仪器呼气,保持呼气速率(50±5)ml/s,仪器自动分析得出FeNO值。
1.2.3 外周血Treg和Th17细胞的检测真空肝素钠抗凝管采集患者外周静脉血2 ml,分别在2个流式检测管内取500 µl全血,加入2 ml红细胞裂解液,充分搅拌均匀后裂解5~10 min,融入1640培养基至8 ml,2 000 r/min离心5 min,弃上清;加入适量1640重悬,加入细胞刺激剂置于5%CO2培养箱37℃孵育6 h。第一管加入荧光标记单抗CD4-FITC 20µl,第二管加入抗体CD4-FITC、CD25-APC各20 µl,常温避光孵育25 min。两管分别先后加入细胞固定/破膜缓冲液1.5 ml、染色缓冲液1 ml,常温避光孵育20~30 min,2 000 r/min离心5 min,弃上清。于第一管内加入胞内荧光标记单抗IL-17A-PerCP-Cy5.5 5 µl,第二管加入抗体FoxP3-PE 20 µl,常温避光孵育30 min。加入1 ml染色缓冲液,1 500 r/min离心5 min,弃上清;加入2%多聚甲醛200µl重悬细胞并固定,采用流式细胞仪检测。
1.2.4 ELISA检测外周血血浆IL-17水平真空肝素钠抗凝管采集患者外周静脉血2 ml,4℃、2 000 r/min离心5 min,收集上清-80℃保存,IL-17水平检测严格按照ELISA试剂盒说明书操作。每份标本测定2次,结果取平均值。
1.3 统计学方法组间数据采用SPSS22.0软件进行处理,变量呈正态分布,采用t检验和非参数检验。指标间的相关性采用Pearson分析或Spearman秩相关分析,数据用±s表示。P<0.05为组间差异具有统计学意义。
2 结果
2.1 研究对象基础资料对比共纳入患者33例,哮喘组17例,其中咳嗽变异性哮喘7例、轻度慢性持续期哮喘4例、中度慢性持续期哮喘6例;非哮喘慢性咳嗽组16例,其中变应性咳嗽10例、胃食管反流性咳嗽6例。各组年龄、性别差异无统计学意义(P>0.05),具有可比性,见表1。

表1 各组基础资料对比Tab.1 Comparison of basic data of each group
2.2 Treg、Th17细胞、Treg/Th17、IL-17、FeNO表达情况两组外周血Treg占CD4+T淋巴细胞比例无明显差异[(0.80±0.39)%vs(1.04±0.25)%,P=0.091];哮喘组患者外周血Th17细胞占CD4+T淋巴细胞比例明显高于非哮喘的慢性咳嗽组[(4.01±2.11)%vs(0.93±0.75)%,P<0.001];哮喘组Treg/Th17细胞的比值明显低于非哮喘的慢性咳嗽组[(0.24±0.19)% vs(2.55±2.59)%,P<0.001];哮喘组外周血血浆IL-17浓度明显高于非哮喘的慢性咳嗽组[(4.60±1.96)ng/L vs(3.01±1.97)ng/L,P=0.012];哮喘组FeNO水平高于非哮喘的慢性咳嗽组[(95.53±37.86)ppb vs(26.94±9.84)ppb,P<0.001]。见表2和图1、2。
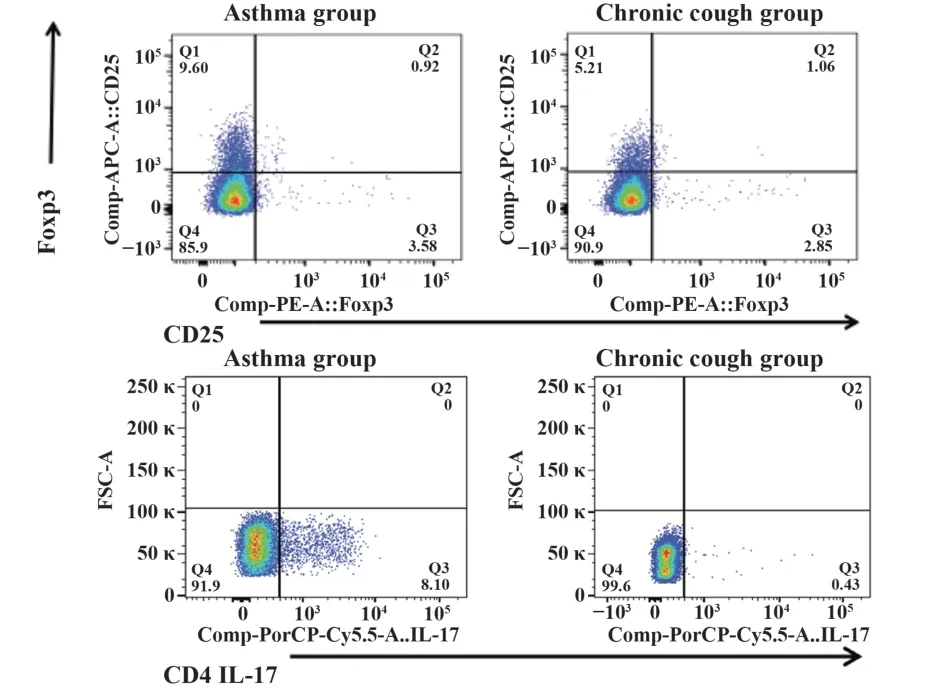
图1 外周血Treg、Th17细胞流式图Fig.1 Flow cytometry of Treg,Th17 cells in peripheral blood
表2 两组外周血Treg、Th17细胞占CD4+T淋巴细胞比例比较(±s)Tab.2 Comparisons of proportions of Treg and Th17 cells in CD4+T lymphocytes in peripheral blood between two groups(±s)
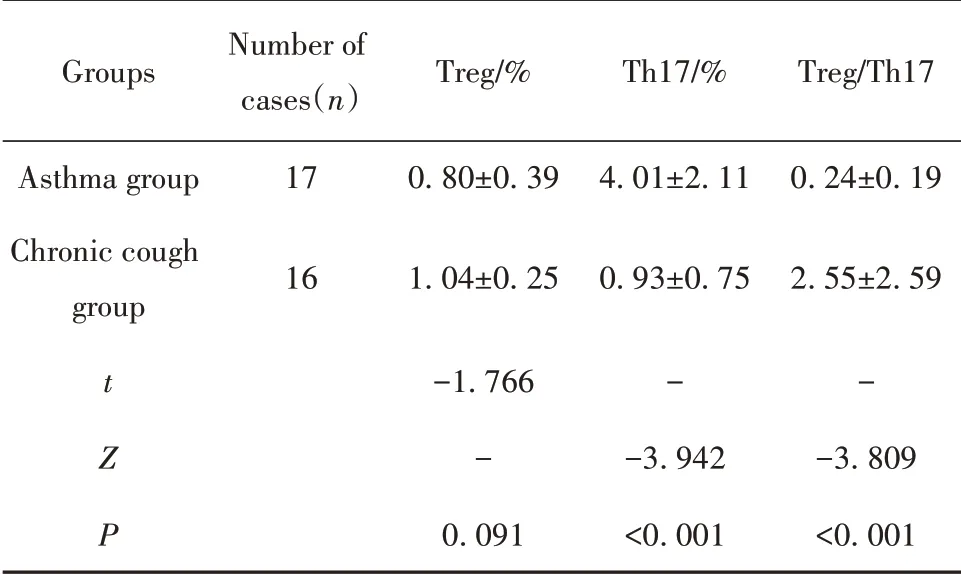
表2 两组外周血Treg、Th17细胞占CD4+T淋巴细胞比例比较(±s)Tab.2 Comparisons of proportions of Treg and Th17 cells in CD4+T lymphocytes in peripheral blood between two groups(±s)
Groups Asthma group Chronic cough group t Z P Number of cases(n)17 16 Treg/%0.80±0.39 1.04±0.25-1.766-0.091 Th17/%4.01±2.11 0.93±0.75--3.942<0.001 Treg/Th17 0.24±0.19 2.55±2.59--3.809<0.001
2.3 Treg、Th17、Treg/Th17和FeNO之 间 的 相 关性哮喘组FeNO值与外周血Treg占比无相关性(r=-0.328,P=0.253),与Th17细胞占CD4+T淋巴细胞比例呈正相关(r=0.663,P=0.01),与Treg/Th17细胞比值呈负相关(r=-0.757,P=0.002),见图3。
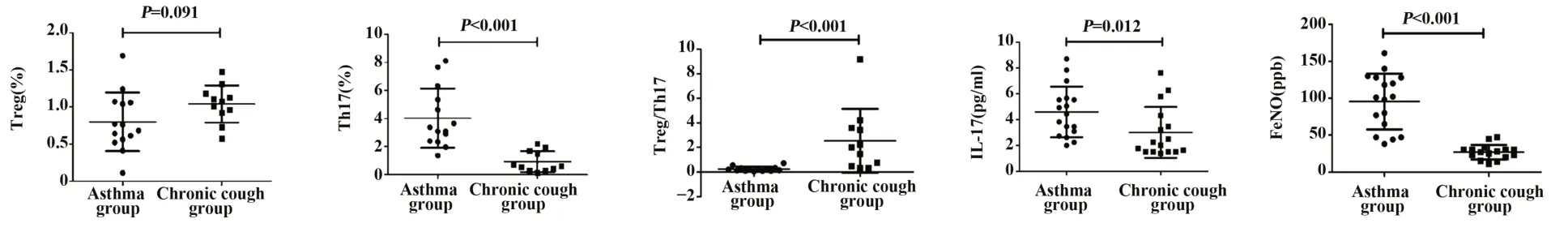
图2 两组外周血Treg、Th17细胞、Treg/Th17、血浆IL-17浓度、FeNO水平对比Fig.2 Comparisons of Treg,Th17 cells,Treg/Th17 in peripheral blood,IL-17 concentration in plasma and level of FeNO between two groups

图3 FeNO水 平 与Treg、Th17细 胞、Treg/Th17细 胞 的相关性Fig.3 Correlations between FeNO and Treg,Th17 cells,Treg/Th17
3 讨论
哮喘是呼吸科常见的气道慢性炎症疾病。近年来随生活习惯及环境的改变,其发病率呈逐年上升的趋势。数据显示全世界哮喘患者大约有1.5~2亿例,而治疗哮喘的过程漫长,给家庭和社会带来较重的经济负担[5]。研究表明哮喘患者气道的慢性炎症主要是由辅助性T(Th)淋巴细胞介导所致,其中Th1/Th2细胞及其特征细胞因子谱的失衡被认为与哮喘的发病密切相关,Th1/Th2失衡参与疾病的发病过程,但逆转Th1/Th2失衡却不能使哮喘患者的症状得到完全缓解[6-8]。有学者发现在哮喘患者体内还存在Treg细胞与Th17细胞失衡[9]。
Th17细胞是一种能够分泌IL-17的T细胞亚群,在自身免疫病、感染等疾病中发挥重要作用[10]。Th17细胞的分化由RORγt和RORα共同介导,IL-23并不参与初始T淋巴细胞的分化,但其也是维持Th17细胞增殖和功能稳定的重要因子。Treg是免疫反应的负性调节细胞,在多种疾病中参与调节变态反应、自身免疫反应和移植物抗宿主反应等,避免机体出现免疫失衡[11-12]。JIANG等[13]研究表明,在被卵清蛋白致敏的小鼠哮喘模型中,小鼠肺组织里Treg/Th17细胞比例降低,表明小鼠哮喘的发病与Treg/Th17细胞失衡存在一定联系。本研究分析哮喘患者与非哮喘慢性咳嗽患者Treg、Th17细胞及其细胞因子IL-17表达水平的差异,发现与非哮喘慢性咳嗽组相比,哮喘组Th17细胞呈高表达,且IL-17的表达也呈高表达,进一步说明,Th17细胞及IL-17的表达水平上升与哮喘发病密切相关。其原因是哮喘患者在接触过敏原刺激后,Th17细胞生成IL-17,促进气道嗜酸粒细胞浸润性炎症反应,最终促使患者哮喘发作[14]。
T淋巴细胞在哮喘发生过程中具有重要调节作用,T细胞参与气道炎症的免疫反应,调节免疫应答。在正常情况下,T淋巴细胞及亚群数目处于较稳定的状态,当T淋巴细胞呈高表达则哮喘患者气道炎症发生变化。相关研究证实,哮喘气道炎症的发病机制还包括Treg数目的变化[15]。当哮喘患者接触到过敏原后,体内Treg数目明显发生变化,但各研究团队对Treg变化趋势的研究结果不一致。XIN等[16]研究显示,Treg在轻度和中度哮喘患者中数目呈增多趋势,且会根据病情的加重而增多。STELMASZCZYK-EMMEL等[17]研究发现,Treg在儿童过敏性哮喘患者中呈减少趋势,但在不同病情与年龄段Treg表达水平不同。本研究发现哮喘组患者Treg/Th17下降,提示哮喘患者存在Treg/Th17细胞失衡现象,Th17细胞数量增多是引起Treg/Th17细胞失衡的主要因素。
FeNO是当气道受到炎症或炎症因子刺激时所合成产生的,在哮喘患者中FeNO值明显升高,FeNO值可在一定程度上反映气道炎症水平[18-19]。气道炎症的深层原因与Treg/Th17细胞的失衡相关,目前国内外对Treg/Th17细胞失衡与FeNO相关性尚无相关研究报道。本研究发现,哮喘患者FeNO值与外周血中Treg/Th17细胞比值呈负相关,表明FeNO值在一定程度上反映哮喘患者体内Treg/Th17细胞失衡。当哮喘患者接触过敏原后,受到刺激的Th17细胞活化生成IL-17,两者共同诱导嗜酸性粒细胞释放趋化因子,从而使气道炎症持续,FeNO作为炎症反应的产物随之升高。Th17细胞在哮喘患者呈高表达,同时FeNO值也呈高表达,两者呈正相关,进一步表明FeNO值及Th17细胞水平升高与哮喘发病相关,可作为哮喘气道炎症发病机制中的重要指标之一。
综上所述,FeNO水平的升高与Treg/Th17细胞失衡密切相关,尤其与Th17细胞增加的关系更加密切,患者Th17细胞升高导致气道炎症发生,进一步导致FeNO值上升,为哮喘的诊治提供新的依据,FeNO水平可作为诊断哮喘或预测哮喘发作的指标,而Th17细胞增高导致FeNO值随之升高的机制尚需进一步研究。