寿胎丸靶向miR-374c-5p/ATG12信号轴减轻滋养细胞自噬治疗原因不明复发性自然流产①
2022-02-21付笑笑褚楚黑国真魏然朱肖肖张振赵霖郭强许珂李霞
付笑笑 褚楚 黑国真 魏然 朱肖肖 张振 赵霖 郭强 许珂 李霞
(山东中医药大学中医药创新研究院,济南 250355)
自然流产连续发生2次或2次以上称为复发性流产(recurrent spontaneous abortion,RSA),发病率约为育龄妇女的3%~5%,约占妊娠妇女的10%~15%,且随着流产次数增多,患者再次流产的风险显著增加[1-2]。随着我国三胎生育政策全面放开,RSA发病率呈上升趋势,严重危害妇女生殖健康,其防治是临床亟需解决的难题。RSA病因复杂,除染色体、内分泌、解剖、感染等因素外,仍有50%患者病因不明,称为原因不明复发性自然流产(unexplained recurrent spontaneous abortion,URSA)[3]。因此,研究URSA的发病机制,探索其治疗方法是目前国内生殖领域研究的热点与难点。URSA西医治疗主要采用妊娠激素补充、免疫治疗等方法,但存在长期肌内注射疼痛、易并发感染、免疫细胞转输功能不稳定、过敏、致畸等副作用。中医药保胎历史悠久,寿胎丸是补肾固冲安胎经典方剂,临床反复验证了其有效性与安全性,但其干预靶点与作用机制尚未阐明[4]。
自噬是维持细胞内环境稳定性的重要保护机制,自噬异常参与慢性阻塞性肺疾病、肺动脉高压以及动脉粥样硬化等多种疾病发生与发展[5-6]。随着生殖医学研究深入,发现细胞自噬与妊娠密切相关,正常妊娠早期存在滋养细胞自噬,适度自噬在促进胎盘发育、维持妊娠中发挥重要作用,而自噬过度或不足将破坏滋养细胞功能、打破母胎免疫耐受等导致流产,但其具体调控机制尚不明确[7-8]。本研究探讨非编码miRNA调控滋养细胞自噬在URSA中的作用及寿胎丸干预机制,以期进一步阐释URSA发病机制,为临床治疗提供新的靶点与思路。
1 资料与方法
1.1 资料
1.1.1 研究对象选取2019年9月至2020年8月山东省妇幼保健院妇产科病房及门诊就诊的URSA患者和正常早孕妇女各30例作为研究对象,分为URSA组及正常早孕妇女组(NP),纳入标准参照本课题组前期报道[4]。URSA组孕(7.60±1.75)周、平均年龄(27.03±3.03)岁,NP组孕(7.50±1.24)周、平均年龄(27.43±1.17)岁。各组差异均无统计学意义(P>0.05),具有可比性。本研究经山东第一医科大学基础医学院伦理委员会批准,研究对象知情同意。
1.1.2 实验动物8周龄雌性CBA/J小鼠、雄性DBA/2小鼠购自北京华阜康生物科技有限公司,体质量18~20 g。动物实验按照《实验动物护理和使用指南》(山东第一医科大学基础医学院)进行,并经动物护理和使用委员会批准。
1.1.3 细胞和药物人肾上皮细胞系293T细胞和人滋养细胞系HTR-8/SVneo均购自武汉普诺赛生命科技有限公司;寿胎丸由菟丝子、桑寄生、阿胶、续断按2∶1∶1∶1比例组成,购自山东中医药大学附属医院。
1.1.4 主要试剂miR-374c-5p mimics及相应对照NC、miR-374c-5p inhibitor及相应对照INC由上海吉玛公司合成;Lipofectamine2000购于美国Invitrogen公司;miRNA 1st Strand cDNA Synthesis Kit购于南京诺唯赞生物科技有限公司;逆转录试剂盒(mRNA)购自上海东洋纺生物科技有限公司;GAPDH、ATG12、P62和LC3抗体购自美国CST公司;ATG12 3'UTR载体由美国Promega公司设计合成。
1.1.5 主 要 仪 器qRT-PCR仪(型 号:7500,Applied Biosystems);垂直电泳仪(型号:165-8001,美国Bio-Rad);全自动凝胶成像仪(型号:GloMax20/20,德国Royal);快速半干转膜仪(型号:FTB1,广州道一)。
1.2 方法
1.2.1 样本采集采用人工流产负压吸引收集两组绒毛膜组织,立即置于预冷的1×PBS中研磨制备单细胞悬液用于Western blot及qRT-PCR检测。
1.2.2 寿胎丸灌胃溶液制备菟丝子、桑寄生、续断、阿胶按2∶1∶1∶1比例水煎浓缩至含生药0.8 g/ml。
1.2.3 含药血清制备CBA/J雌鼠随机分为寿胎丸、对照组,每组8只。按照人与小鼠体表面积换算公式,寿胎丸组小鼠灌胃给予寿胎丸溶液,0.5 ml/(只·d),连续11 d;对照组灌胃给予等量蒸馏水。末次灌胃后1 h眼球取血,分离血清,-80℃保存备用。
1.2.4 小鼠模型建立CBA/J雌鼠与DBA/2雄鼠交配建立URSA模型,每日清晨观察小鼠阴栓,发现阴栓日为妊娠第0.5天[1]。URSA小鼠随机分为寿胎丸组、对照组、寿胎丸+miR-374c-5p inhibitor组及寿胎丸+INC组,每组5只。寿胎丸组灌胃给予寿胎丸水溶液,0.5 ml/(只·d),对照组灌胃给予等量蒸馏水,寿胎丸+miR-374c-5p inhibitor组及寿胎丸+INC组在灌胃给予寿胎丸水溶液基础上于妊娠第0.5天开始每隔3 d尾静脉分别注射miR-374c-5p inhibitor及INC各10 nmol。各组小鼠均连续灌胃11 d,于妊娠第11.5天处死小鼠,观察小鼠胚胎吸收率,收集胎盘组织用于Western blot及qRT-PCR检测。
1.2.5 细胞分组和处理HTR-8/SVneo细胞分为miR-374c-5p mimics组、inhibitor组及相应对照组,利用Lipofectamine2000分别转染miR-374c-5p mimics、inhibitor及相应对照,24 h后收集各组细胞,检测各组ATG12表达及自噬情况。采用无血清培养基饥饿诱导HTR-8/SVneo细胞6 h建立自噬模型[9],随机分为寿胎丸组及对照组。寿胎丸组细胞采用含20%寿胎丸药物血清的1640培养基培养,对照组细胞采用含20%空白血清的1640培养基培养[10]。24 h后收集各组细胞,检测寿胎丸体外调控miR-374c-5p/ATG12信号轴的作用及对自噬的影响。
1.2.6 Western blot检测LC3、P62及ATG12蛋白水平提取人绒毛组织、小鼠胎盘组织及HTR-8/SVneo细胞总蛋白,聚丙烯酰胺凝胶电泳,转膜,5%脱脂奶粉封闭,分别加入ATG12、LC3、P62一抗4℃孵育过夜,1×PBST洗膜,加入二抗室温摇床孵育1 h,1×PBST洗膜,化学发光法检测LC3、P62及ATG12蛋白表达。
1.2.7 qRT-PCR检测ATG12 mRNA及miR-374c-5p表达TRIzol法提取人绒毛、小鼠胎盘组织及HTR-8/SVneo细胞总RNA,紫外分光光度仪测定RNA浓度与纯度。分别按照逆转录试剂盒(mRNA)以及miRNA 1st Strand cDNA Synthesis Kit说明书合成cDNA,选用UltraSYBR Mixture PCR反应体系进行PCR扩增,2-ΔΔCt法 计 算ATG12 mRNA及miR-374c-5p相 对 表达。引物序列见表1。

表1 qRT-PCR引物来源及序列Tab.1 qRT-PCR primer source and sequences
1.2.8 与ATG12结合的差异miRNA筛选采用生物信息学软件(Target Scan 7.2、DIANA、miRDB)结合课题组前期芯片检测结果(https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=GSE178619)筛选可能与ATG12结合的差异miRNA。
1.2.9 双荧光素酶报告基因验证miR-374c-5p与ATG12互补结合以pmirGLO为载体构建包含结合位点的野生型及突变型ATG12 mRNA 3'UTR质粒,采用Lipofectamine2000转染至293T细胞,同时分别转染NC及miR-374c-5p mimics,24 h后收集细胞并检测相对荧光素酶活性。
1.3 统计学处理采用GraphPad Prism Version 7.0软件进行实验数据和图片处理,结果以±s表示;配对t检验比较两组间差异;单因素方差分析(One-Way ANOVA)比较多组间差异;Pearson相关分析分析样本相关性,P<0.05为差异有统计学意义。
2 结果
2.1 人绒毛组织ATG12及LC3、P62表达与NP组相比,URSA患者绒毛组织中ATG12 mRNA及蛋白表达均显著上升(P<0.000 1),自噬相关蛋白LC3Ⅱ/Ⅰ比值显著升高,P62表达显著降低(P<0.01,图1),提示ATG12介导滋养细胞自噬参与URSA发生过程。

图1 URSA患者绒毛组织中ATG12及自噬相关蛋白表达Fig.1 Expressions of ATG12 and autophagy-related proteins in villous tissues of patients with URSA
2.2 人绒毛组织中miR-374c-5p表达为阐释自噬关键分子ATG12上游调控机制,结合生物信息学软件及课题组前期芯片检测数据筛选发现,miR-374c-5p、miR-23a-5p与ATG12 mRNA 3′UTR具有潜在结合位点(图2A)。进一步扩大临床样本表达验证显示,与NP组相比,URSA组miR-374c-5p表达显著降低(P<0.000 1),而miR-23a-5p表达差异无统计学意义(P>0.05,图2B、C)。Pearson相关性分析显示,ATG12 mRNA与miR-374c-5p表达呈显著负相关(r=-0.603 1,P<0.01,图2D);ROC曲线分析显示,曲线下面积(AUC)为0.827 7(95%CI:0.728 0~0.941 0,P<0.000 1),提示miR-374c-5p表达变化可敏感区分URSA患者与正常早孕妇女(图2E)。

图2 调控ATG12表达筛选差异miRNAsFig.2 Screening of differential miRNAs by regulating ATG12 expression
2.3 调控miR-374c-5p表达对ATG12表达及自噬的影响HTR-8/SVneo细胞转染miR-374c-5p mimics后,miR-374c-5p表达显著升高(P<0.001),ATG12 mRNA及蛋白表达、LC3Ⅱ/Ⅰ比值显著降低(P<0.001),P62蛋白表达显著升高(P<0.001,P<0.000 1);转染miR-374c-5p inhibitor后,miR-374c-5p显 著 降低(P<0.001),同时ATG12 mRNA及蛋白表达、LC3Ⅱ/Ⅰ比值显著升高(P<0.05),P62蛋白表达显著降低(P<0.001,图3)。提示miR-374c-5p可负向调控ATG12表达影响滋养细胞自噬。
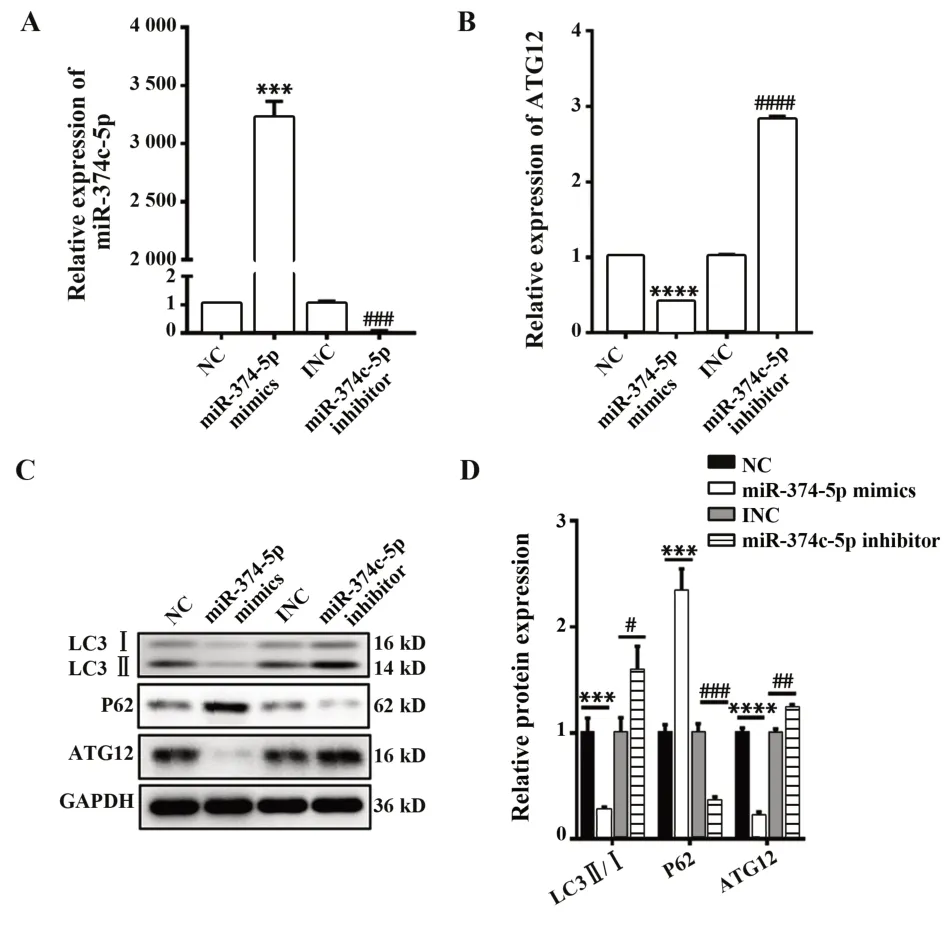
图3 调控miR-374c-5p表达对ATG12 mRNA及自噬蛋白表达的影响Fig.3 Effect of regulating miR-374c-5p expression on ex⁃pressions of ATG12 mRNA and autophagy proteins
2.4 miR-374c-5p对ATG12的靶向调控作用生物信息学软件预测miR-374c-5p与ATG12 mRNA 3′UTR存在潜在碱基互补结合位点(图4A),双荧光素酶报告基因系统显示,miR-374c-5p mimics可显著降低WT-pmirGLO-ATG12 3'UTR相对荧光素酶活性(P<0.01,图4B),而对Mut-pmirGLO-ATG12 3'UTR相对荧光素酶活性无影响(P>0.05,图4C),提示miR-374c-5p通过碱基互补直接结合ATG12 mRNA 3′UTR抑制其转录和翻译。

图4 ATG12是miR-374c-5p的直接靶点Fig.4 ATG12 is a direct target of miR-374c-5p
2.5 寿胎丸含药血清对miR-374c-5p/ATG12信号轴及自噬的影响与空白血清组相比,寿胎丸含药血清组miR-374c-5p表达显著升高(P<0.01),同时ATG12 mRNA及蛋白表达显著降低(P<0.000 1),LC3Ⅱ/Ⅰ比值显著降低(P<0.000 1),P62蛋白水平显著升高(P<0.01,图5),提示寿胎丸含药血清可体外调控miR-374c-5p/ATG12信号轴抑制滋养细胞自噬。

图5 寿胎丸含药血清对miR-374c-5p及自噬的影响Fig.5 Effect of Shoutai Pill medicated serum on miR-374c-5p and autophagy
2.6 寿胎丸靶向miR-374c-5p/ATG12信号轴抑制滋养细胞自噬发挥妊娠保护作用与对照组相比,寿胎丸治疗组小鼠胚胎吸收率明显降低(P<0.001),miR-374c-5p表达显著升高(P<0.000 1),ATG12 mRNA及蛋白表达显著降低(P<0.001),同时LC3Ⅱ/Ⅰ比值显著降低(P<0.000 1),P62蛋白水平显著升高(P<0.001),提示寿胎丸可通过调控miR-374c-5p/ATG12信号轴抑制滋养细胞自噬发挥妊娠保护作用。尾静脉注射miR-374c-5p inhibitor可逆转寿胎丸对妊娠的保护作用,小鼠胚胎吸收率明显升高(P<0.01),miR-374c-5p表达显著降低,ATG12表达及LC3Ⅱ/Ⅰ比值显著升高,P62表达显著下降(P<0.01,图6)。进一步证实寿胎丸通过调控miR-374c-5p/ATG12信号轴抑制滋养细胞自噬发挥妊娠保护作用。
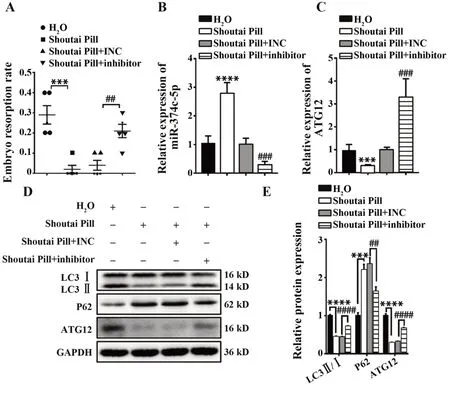
图6 寿胎丸靶向ATG12调控自噬对妊娠的保护作用Fig.6 Protective effect of Shoutai Pill targeting ATG12 to regulate autophagy on pregnancy
3 讨论
妊娠类似于同种异体移植,是母胎间复杂而精细的调控过程,任何因素失衡都可能导致流产。自噬是维持细胞内环境稳定性的一种保护机制,通过形成双层膜结构的自噬小体吞噬包裹细胞内待降解的大分子蛋白与细胞器等,并形成自噬溶酶体对其进行降解[11-12]。适度自噬对维持细胞正常功能及内环境稳定具有重要作用,但自噬过度及不足均可导致类风湿关节炎、系统性红斑狼疮、肿瘤等多种疾病发生与发展[13-14]。随着生殖医学研究深入,发现滋养细胞自噬过度激活参与URSA发生过程,如URSA患者滋养细胞表达下调的音猬因子(shh)信号通路通过激活自噬促进E-钙黏素(E-Cad)表达抑制滋养细胞迁移[7];线粒体融合蛋白-2(MFN2)缺乏导致滋养细胞ATG5表达增加促进自噬进而抑制基质金属蛋白酶(MMP)-2、MMP-9及整合素β1表达损伤滋养细胞植入功能[15]。
自噬相关蛋白ATG12是一种泛素样蛋白,在自噬体形成过程中扮演关键角色,可与多种蛋白相互作 用,如ATG12与ATG5耦 联 并 激 活ATG7和ATG10,ATG12-ATG5共轭物与ATG16L1相互作用形成ATG12-ATG5-ATG16L1复合物并促进ATG8(LC3)脂质化,指导其正确的亚细胞定位,是自噬体延长和成熟所必需的[16]。因此,ATG12是调节自噬的关键分子,其表达变化可影响自噬体形成及功能。人ATG12基因是由140个氨基酸编码的定位于染色体5q21-q22 34区的蛋白,普遍表达于各种组织。研究表明ATG12介导的细胞自噬参与帕金森病、骨肉瘤等多种疾病病理过程,但其介导的滋养细胞自噬在URSA中的作用及上游调控机制尚不清楚[17-18]。本研究发现URSA患者绒毛组织中ATG12 mRNA及蛋白表达均显著上升,同时发现LC3Ⅱ/Ⅰ比值升高、P62表达明显下降,提示ATG12介导的滋养细胞自噬参与URSA发生,未来将继续寻找URSA发生时ATG12表达升高的上游调控机制。
随着人类多个基因组计划的完成及测序技术的飞速发展,越来越多的非编码RNA被分离和鉴定。miRNA是一类长约22个核苷酸的单链非编码RNA,其前体在Drosha和Dicer水解酶剪切下与Ago蛋白结合为成熟的miRNA。成熟的miRNA通过与靶基因3'UTR碱基互补结合,降解靶基因或抑制靶基因转录和翻译。越来越多证据表明,miRNA参与多种病理和生理过程,对细胞增殖、分化、迁移、侵袭及凋亡等发挥重要调控作用[19]。miRNA在URSA中的作用日益受到关注,研究发现miRNA对滋养细胞功能及母胎免疫耐受均具有重要调控作用[20-21]。miRNA通过调控细胞自噬在多种疾病中发挥重要作用,如人心肌缺血细胞中miR-103a-3p表达降低促进ATG5介导的心肌细胞自噬[22]。急性心肌梗死患者及缺血再灌注小鼠模型中,miR-26a-5p表达下调促进ATG12介导的心肌细胞自噬[23]。此外,研究发现胰腺癌细胞中miR-23b表达降低促进ATG12介导的细胞自噬从而导致放疗抵抗[24]。尽管已证明miRNA在URSA及自噬中均具有重要作用,但miRNA调控滋养细胞自噬在URSA中的作用与调控机制尚未见报道。本研究发现URSA患者绒毛滋养细胞ATG12表达及其介导的细胞自噬均显著升高,通过生物信息学分析结合前期高通量检测筛选到对ATG12具有潜在调控作用的miR-374c-5p,并证实miR-374c-5p在URSA患者绒毛组织中表达显著下降,且与ATG12表达呈显著负相关,ROC分析表明miR-374c-5p可显著区分URSA患者和正常妊娠妇女,提示miR-374c-5p调控ATG12介导的滋养细胞自噬参与URSA发生,有望成为新的临床生物学诊断标志物及药物干预靶点。
miR-374c-5p是由23个核苷酸组成的内源性非编码RNA,由人X染色体转录而来,属于miR-374家族,已被广泛研究并证实其表达异常参与宫颈癌、阿尔茨海默病、动脉粥样硬化等疾病发生发展[25-26]。本研究通过生物信息学软件结合前期全转录组高通量检测发现,miR-374c-5p与ATG12 mRNA 3′UTR存在碱基互补结合位点,并通过双荧光素酶报告基因系统证实miR-374c-5p与ATG12 mRNA 3'UTR可通过碱基互补直接结合。体外实验发现过表达miR-374c-5p可显著抑制ATG12 mRNA及蛋白表达、降低LC3Ⅱ/Ⅰ比值、促进P62蛋白表达;而抑制miR-374c-5p表达作用相反,提示miR-374c-5p通过碱基互补结合对ATG12发挥负向调控作用,靶向miR-374c-5p/ATG12信号轴调控滋养细胞自噬可能成为治疗URSA的有效途径。
URSA属中医学“滑胎”范畴,亦称“数堕胎”“屡孕屡堕”,历代医家对其病机认识和治疗积累了许多宝贵经验。中医认为“肾主生殖”,肾虚冲任不固是URSA的根本病机,补肾固冲是本病基本治则,张锡纯《医学衷中参西录》中创制补肾固冲经典方剂寿胎丸,流传至今,取得良好临床疗效,但其作用靶点与机制尚未完全阐明[27]。本研究发现寿胎丸含药血清可显著促进HTR-8/SVneo细胞miR-374c-5p表达,抑制ATG12 mRNA及其蛋白表达、降低LC3Ⅱ/Ⅰ比值、促进P62表达。同时,体内实验发现寿胎丸治疗后小鼠胚胎吸收率明显下降,同时发现miR-374c-5p表达显著升高、ATG12表达及LC3Ⅱ/Ⅰ比值显著降低、P62蛋白表达显著升高,而尾静脉注射miR-374c-5p inhibitor可拮抗寿胎丸妊娠保护及对自噬的调控作用,进一步证实寿胎丸通过调控miR-374c-5p/ATG12信号轴减轻滋养细胞自噬进而治疗URSA。
综上所述,本研究揭示了miR-374c-5p通过碱基互补直接结合ATG12负向调控其表达的作用,证实miR-374c-5p/ATG12信号轴介导的滋养细胞自噬在URSA发病中的作用,阐释了中药复方寿胎丸靶向调控miR-374c-5p/ATG12信号轴减轻滋养细胞自噬治疗URSA的作用与分子机制。从非编码RNA调控角度进一步揭示了URSA发病机制,为临床诊断及治疗提供了新的靶点与思路。
