柔肝方通过抑制纤维化蛋白抗肝纤维化的机制研究①
2022-02-21李茜吴惠春谭家鑫黄凌鹰高月求李曼
李茜 吴惠春 谭家鑫 黄凌鹰 高月求 李曼
(上海中医药大学附属曙光医院上海市中医临床重点实验室,细胞免疫学实验室,上海 201203)
肝纤维化是各种病因引起的慢性肝病进展为肝硬化的必经环节,其关键过程是肝星状细胞(hepatic stellate cells,HSC)的活化并转分化为肝成纤维细胞,大量合成细胞外基质(extracellular matrix,ECM)成分,引起ECM的进行性过度积累[1]。纤维化蛋白(fibrosin,FBRS)是一种由CD4+T细胞和成纤维细胞分泌的促进纤维化的细胞因子,能够促进肌纤维母细胞的生成和胶原纤维的表达[2-4]。课题组前期研究发现,慢性乙型肝炎(chronic hepatitis B,CHB)患者外周血CD4+T细胞表达的FBRS水平与肝纤维化程度正相关,提示FBRS参与了肝纤维化的发病过程[5]。柔肝方(Rougan Formula)是上海市名中医王灵台教授治疗肝纤维化的有效验方,以益气养阴、活血化瘀为治则。前期临床研究发现,柔肝方可显著改善慢乙肝肝纤维化患者的症状、体征和肝功能,降低肝纤维化血清学指标,实验研究证实RGF可抑制肝纤维化模型小鼠肝脏的胶原合成,但其机制尚不清楚[6-7]。因此,本研究在明确柔肝方主要成分基础上,应用肝纤维化小鼠模型和体外细胞模型,深入研究柔肝方抗肝纤维化的分子机制,为阐释中药抗肝纤维化提供现代医学依据。
1 材料与方法
1.1 材料
1.1.1 实验动物和细胞6~8周龄健康BALB/c雄性小鼠74只,体质量18~21 g,购自浙江维通利华实验动物技术有限公司,合格证为SCXK(浙)2019-0001,饲养于上海南方模式生物科技股份有限公司,动物伦理IACUC号为2020-0018,喂食标准颗粒饲料。雄性SD大鼠30只,体质量200~220 g,购自浙江维通利华实验动物技术有限公司,适应性饲养1周后使用。人肝星状细胞株LX2细胞购自上海复蒙基因生物公司。
1.1.2 实验药物和主要试剂柔肝冲剂为曙光医院的院内制剂(批号:Z05100975),购自上海曙光医院药房,组成如下:淫羊藿15 g、炙黄芪15 g、枸杞子12 g、炙鳖甲12 g、丹参30 g、郁金12 g、苦参12 g。对照品淫羊藿苷(货号E-0062)、绿原酸(货号E-0075)、黄芪甲苷(货号E-0146)、芒柄花黄素(货号E-0216)、丹参酮ⅡA(货号E-0021)、丹酚酸B(货号E-0136)、苦参碱(货号E-0064)、氧化苦参碱(货号E-0095),质量分数>98%,均购自上海同田生物技术有限公司;Ⅳ型刀豆蛋白A(ConA,C2010)购自美国Sigma公司;小鼠的ALT测试盒、AST测试盒、LN酶联免疫检测试剂盒、HA酶联免疫检测试剂盒、PⅢNP酶联免疫检测试剂盒、Col-Ⅳ酶联免疫检测试剂盒、HE染液购自南京建成生物技术研究所;Masson染液购自Solarbio公司;人重组FBRS蛋白购自Abnova;anti-α-SMA(ab124964)、anti-Col-Ⅰ(ab88147)和anti-TGF-β1(ab215715)购自英国Abcam公司;FBRS Polyclonal Antibody(PA5-60615)购自Thermo Fisher公司;GAPDH Antibody(60004-1-lg)购自Protein Tech公司;Col-Ⅰ、TGF-β1和FBRS酶联免疫检测试剂盒购自科诺迪生物科技有限公司。
1.2 方法
1.2.1 RGF化学成分及其入血成分的分析与鉴定应用UPLC-Q-TOF-MS/MS技术对RGF及其含药血清的化学成分进行分析[8],查阅《中华人民共和国药典(2015年版)》分析柔肝方中各组成药物的主要成分,使用淫羊藿苷、绿原酸、黄芪甲苷、芒柄花黄素、丹参酮ⅡA、丹酚酸B、苦参碱、氧化苦参碱作为对照品进行成分分析。供试品的制备:分别取柔肝方于研钵中研磨,精密称定柔肝方219.40 mg,加入甲醇溶液10 ml,超声(功率250 W,频率40 kHz)提取30 min,经0.22 μm微孔滤膜滤过,取续滤液100 μl,加到液相小瓶中,上样分析。血浆样品处理方法:取血浆10 ml,加入30 ml乙腈,涡旋1 min后,4 000 r/min离心10 min,精密移取37.50 ml上清,旋转蒸发,加入500 L甲醇复溶,12 000 r/min离心10 min。精密吸取上清液100 L,转移至液相小瓶,上样分析。
1.2.2 动物分组及模型建立74只BALB/c小鼠按体质量随机区组分为正常对照组、模型组和柔肝方低、中、高剂量组(RGF-L、RGF-M、RGF-H),其中对照组6只,其余每组各17只。按公式:小鼠给药剂量(g/kg)=成人用药量(g)/成人标准体重(kg)×9.1为中剂量组,低剂量组为中剂量组的1/2浓度,高剂量组为中剂量组的2倍浓度。除对照组外,造模小鼠按照12.5 mg/kg小鼠体质量予尾静脉注射ConA试剂,1次/周,连续10周;对照组小鼠注射相应剂量生理盐水[9]。柔肝方组在造模当日按照10 ml/kg小鼠体质量灌服中药,其余组则灌服等量饮用水,1次/d,共10周。在第10次注射ConA后次日采集小鼠标本,取小鼠肝右叶约0.5 cm×0.5 cm大小的肝组织固定于4%多聚甲醛,48 h后经脱水、二甲苯透明、石蜡包埋、切片后用于后续染色。以天狼猩红染色和Masson染色的胶原表达半定量结果作为判断肝纤维化程度的指标。
1.2.3 各组小鼠肝脏指数及脾脏指数的测定称量各组小鼠体质量,分离肝脏和脾脏后称重,分别计算肝脏指数及脾脏指数:肝脏指数(%)=肝脏质量(g)/体质量(g)×100%;脾脏指数(%)=脾脏质量(g)/体质量(g)×100%[10-13]。
1.2.4 HE染色取肝组织石蜡切片,60℃烤片30 min后依次放入二甲苯Ⅰ、Ⅱ染缸中脱蜡,每次10 min,梯度乙醇逐级脱水,100%、95%、85%、70%各3 min,自来水冲洗3次,洗净乙醇,苏木素染色5 min,水洗1次,伊红染色30 s,用增色液冲洗2次,晾干封片镜检并采集图像。
1.2.5 天狼猩红染色取肝组织石蜡切片,常规脱蜡至水,用纸擦干肝组织周围水滴,滴加1滴天狼猩红染液于肝组织上,将载玻片放于湿盒中,置于37℃恒温箱中25 min,无水乙醇分化1 min,二甲苯透明1 s,中性树胶封片镜检并采集图像,使用Image-pro plus软件进行半定量分析阳性区域面积百分比。
沙美特罗替卡松联合孟鲁司特对比沙美特罗替卡松治疗咳嗽变异性哮喘疗效和安全性的Meta分析…… 冯文涛等(5):699
1.2.6 Masson染色取肝组织石蜡切片,常规脱蜡至水,苏木素染核,天青石蓝染色液染10 min,充分水洗,丽春红品红染色液覆盖住标本10 min,使用0.2%冰醋酸水溶液去除浮色,滴加磷钼酸水溶液分化处理1 min,用苯胺蓝染色液染5 min,冰醋酸水溶液清洗玻片,无水乙醇脱水、二甲苯透明、中性树胶封固镜下观察,使用Image-pro plus软件进行半定量分析[14]。
1.2.7 肝功能指标和肝纤四项检测取各组小鼠血清,应用生化法,根据ALT、AST、肝纤四项(HA、LN、PⅢNP、ColⅣ)说明书进行实验测定其水平。
1.2.8 Western blot取30 mg肝组织放入含1%PMSF的细胞裂解液中,匀浆后冰上放置30 min,12 000 g离心15 min取上清,BCA法测定蛋白浓度并制样。每次上样量为30 μg,上样体积为10 μl。使用12.5%分离胶分离蛋白,湿转法将蛋白转移至PVDF膜,5%脱脂奶粉封闭1 h,一抗4℃孵育过夜,TBST洗膜4次后加入二抗,TBST洗膜4次后显影,并使用Image J软件统计灰度值计算相对表达量[15]。
1.2.9 柔肝方含药血清制备30只SD大鼠随机分为正常对照组和柔肝方组(RGF组)。大鼠适应性喂养1周后,按1 ml/100 g灌胃体积予高剂量RGF灌胃,正常对照组灌服饮用水,每日早晚各灌胃1次,第3天灌胃后禁食、禁水12 h,第4天给药1次后30 min腹主动脉取血[16]。室温静置2 h后,以3 000 r/min离心10 min,分离血清,过滤灭活后-80℃冻存,备用。
1.2.10 重组FBRS蛋白刺激LX2细胞LX2细胞按照3×105个/孔接种于6孔板,培养12 h后,分为对照组和重组FBRS蛋白干预组,干预组分为不同时间和不同浓度,人重组FBRS蛋白(10 ng/ml)分别干预LX2细胞0 h、24 h和48 h,不同浓度FBRS蛋白(0、10、100 ng/ml)干预24 h。Western blot法检测α-SMA表达。ELISA法测定培养上清Col-Ⅰ、TGF-β1和FBRS表达。
1.2.11 柔肝方含药血清对LX2细胞活化的调节作用3×105个/孔的LX2细胞接种于6孔板,培养12 h,PBS洗2次,分为正常血清组、正常血清+FBRS刺激(100 ng/ml)组和柔肝方含药血清+FBRS刺激组(100 ng/ml),10%血清培养48 h,Western blot法检 测α-SMA水 平,Western blot和ELISA法 测 定Col-Ⅰ、TGF-β1和FBRS表达。
1.3 统计学处理本文实验数据应用SPSS20.0软件进行统计学分析。计量资料以±s表示,组间比较用t检验,组间差异采用单因素方差分析,两两比较采用LSD法。以P<0.05表示差异具有统计学意义。
2 结果
2.1 柔肝方化学成分及其入血成分分析结果应用UPLC-Q-TOF-MS/MS技术对柔肝方及其含药血清的化学成分进行分析,结果显示,根据标准品鉴定每克柔肝方中主要成分含量如下:绿原酸195.79 ng,黄芪甲苷88.52 ng,芒柄花黄素13.72 ng,淫羊藿苷1 186.46 ng,丹参酮ⅡA 6.93 ng,丹酚酸B 75 236.24 ng,苦参碱1.66 ng,氧化苦参碱24.91 ng。
柔肝方入血成分分析结果显示,主要为淫羊藿苷、绿原酸、黄芪甲苷、芒柄花黄素、丹参酮ⅡA、丹酚酸B、苦参碱和氧化苦参碱,详见表1。
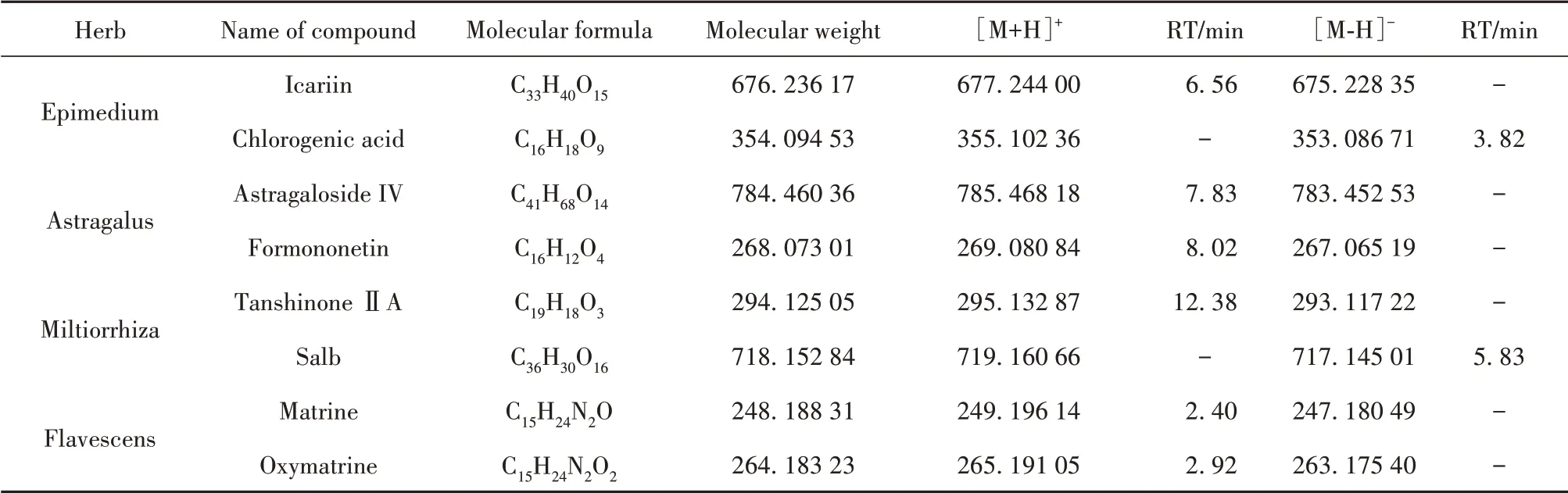
表1 柔肝方入血成分鉴定情况Tab.1 Identification of serum components of Rougan Formula
2.2 柔肝方降低ConA肝纤维化模型小鼠的肝脏指数和脾脏指数尾静脉注射ConA建立肝纤维化小鼠模型,并予柔肝方不同剂量进行治疗。与对照组相比,模型组小鼠肝脏指数与脾脏指数明显增高(P<0.01,P<0.001);与模型组相比,柔肝方组肝脏指数和脾脏指数均有下降趋势,其中高剂量组降低最为显著(P<0.001,图1)。

图1 柔肝方对ConA肝纤维化模型小鼠肝脏指数和脾脏指数的影响Fig.1 Effects of Rougan Formula on liver index and spleen index of ConA-induced hepatic fibrosis model mice
2.3 柔肝方改善ConA肝纤维化模型小鼠肝组织炎症、减少胶原沉积如图2所示,HE染色结果表明,对照组小鼠肝小叶结构清晰、完整,肝索呈放射状排列,排列规则,无变形、坏死;模型组小鼠肝小叶结构被破坏,肝索排列紊乱,可见多处肝组织坏死区域,并有大量炎症细胞浸润;与模型组相比,柔肝方各用药组小鼠肝小叶结构破坏程度明显减轻,炎症浸润细胞明显减少。天狼猩红染色和Masson染色结果表明,对照组未见胶原沉积;模型组小鼠肝小叶结构被破坏,胶原沉积明显增多,形成了纤维间隔,甚至假小叶形成;与模型组相比,柔肝方用药组胶原沉积呈剂量依赖性减少。

图2 柔肝方对小鼠肝组织炎症和胶原沉积的改善作用Fig.2 Effects of Rougan Formula on inflammation and collagen deposition in mice liver tissue
2.4 柔肝方改善ConA模型小鼠的肝功能和降低血清肝纤维化指标表达的作用与对照组相比,ConA模型组小鼠血清ALT、AST、肝纤四项(HA、LN、PⅢNP、Col-Ⅳ)水平显著升高(P<0.001);与模型组相比,柔肝方组ALT、AST、肝纤四项水平较模型组有明显降低(P<0.05)。见图3。

图3 柔肝方对小鼠肝功能和纤维化指标的改善作用Fig.3 Effects of Rougan Formula on liver function and fibrosis related items in mice
2.5 柔肝方降低ConA肝纤维化模型小鼠肝组织FBRS的表达为探究柔肝方抑制ConA肝纤维化模型小鼠肝脏胶原沉积的分子机制,检测了柔肝方对肝内肝星状细胞活化相关指标的调节作用。结果表明,柔肝方可明显降低模型小鼠肝组织的α-SMA、Col-Ⅰ、TGF-β1、FBRS的表达水平(P<0.01,P<0.001),提示柔肝方可能通过抑制肝星状细胞的活化、减少胶原沉积发挥抗肝纤维化的作用。见图4。

图4 柔肝方对肝组织TGF-β1、α-SMA、Col-Ⅰ、FBRS蛋白表达的调节作用Fig.4 Effects of Rougan Formula regulating protein expressions of TGF-β1,α-SMA,Col-Ⅰand FBRS
2.6 重组FBRS蛋白可诱导LX2细胞活化为明确柔肝方抑制肝星状细胞活化的机制,体外应用重组FBRS蛋白刺激人肝星状细胞系LX2。结果表明,随着重组FBRS蛋白浓度和作用时间的增加,LX2细胞表达α-SMA水平逐渐增加,提示FBRS可以活化肝星状细胞。此外,重组FBRS蛋白可上调LX2胞内和分泌的Col-Ⅰ、TGF-β1和FBRS表达水平(P<0.05),其中胞内蛋白应用Western blot法测定,分泌蛋白应用ELISA法测定。见图5。

图5 重组FBRS蛋白对LX2细胞活化的调节作用Fig.5 Effects of recombinant FBRS proteins activating in LX2 cells
2.7 柔肝方含药血清可抑制FBRS诱导的LX2细胞的活化应用柔肝方药物血清干预经FBRS刺激的LX2细胞,结果表明柔肝方含药血清不仅抑制FBRS诱导的LX2表达α-SMA,且抑制LX2的胞内和分泌的Col-Ⅰ、TGF-β1、FBRS水平(P<0.05,图6),提示柔肝方通过抑制FBRS诱导肝星状细胞活化,抑制胶原分泌,发挥抗纤维化作用。

图6 柔肝方抑制LX2细胞激活和胶原沉积Fig.6 RGF inhibits activation and collagen deposition of LX2 cells
3 讨论
肝纤维化是慢性或反复肝损伤的最终共同途径,急性的、自限性纤维化是一种对组织损伤可逆的保护性反应,终末期肝纤维化导致肝硬化,伴有危及生命的后果,但目前除病因治疗或肝移植,仍没有公认的治疗肝纤维化的有效方法[17-18]。中医药在肝纤维化的治疗上有明确优势,明确其抗肝纤维化的机制将有助于发现新的肝纤维化治疗靶点及有效药物[19]。
3.1 柔肝方是治疗肝纤维化的有效验方柔肝方是曙光医院肝病科治疗肝纤维化的有效验方,前期临床研究证实柔肝方联合恩替卡韦治疗乙肝后肝纤维化患者,其肝功能指标、肝脏弹性值的改善作用明显优于恩替卡韦对照治疗组[20]。柔肝方对CHB患者具有一定的抑制病毒复制的作用,病理结果显示有一定的抗炎、抗纤维化作用,其疗效与抑制HSC的激活有关[6-7]。
3.2 FBRS在肝纤维化发病机制中的作用TGF-β1是目前已知的致肝纤维化最重要的细胞因子,可来源于自分泌和旁分泌。发生肝纤维化时,TGF-β1生成显著增多,刺激HSC转化为MFB,产生大量ECM,导致肝纤维化[21-22]。1993年,FBRS作为一种新的促纤维化的细胞因子被发现,其在血吸虫性肝纤维化和酒精性肝纤维化时均有高表达[2,23-24]。研究表明,FBRS会促进表达α-SMA的肌纤维母细胞的生成,同时促进胶原纤维的表达[4]。宗欣等[25]研究表明,随着肝纤维化的程度不同,血清FBRS mRNA表达水平随肝脏胶原沉积水平同步升高。另外,肝组织FBRS mRNA表达水平与肝纤四项检查均呈正相关。前期研究中,发现CHB患者肝纤维化的程度越高,其外周血CD4+T细胞的FBRS表达水平越高,表明CD4+T细胞的FBRS表达与肝纤维化程度密切相关,但相关的机制尚未探讨[5]。
3.3 柔肝方通过调节FBRS表达抗肝纤维化的机制本研究中,应用ConA肝纤维化模型小鼠证实,柔肝方可减少组织中炎症细胞浸润,减轻炎症反应,降低血清ALT、AST水平,减少小鼠肝内胶原沉积,与前期CCL4肝纤维化模型的研究结果一致[26]。α-SMA是HSC活化的标志物,RGF可下调肝纤维化模型小鼠肝组织α-SMA、Col-Ⅰ、TGF-β1和FBRS表达,提示柔肝方可抑制HSC的活化,其机制可能与调节FBRS表达有关。
体外研究证实,重组FBRS蛋白可诱导人肝星状细胞LX2细胞表达α-SMA,提示FBRS可作为诱导LX2活化的始动因素之一。进一步应用柔肝方药物血清干预,证实柔肝方可降低FBRS上调的α-SMA、Col-Ⅰ和TGF-β1表达,提示柔肝方对FBRS诱导的LX2细胞活化具有抑制作用。FBRS可上调TGF-β1的表达,但在TGF-β1在FBRS诱导LX2细胞活化中的作用仍有待研究。
3.4 柔肝方抗肝纤维化可能的效应物质鉴定柔肝方的主要入血成分是淫羊藿苷、绿原酸、丹酚酸B、黄芪甲苷、芒柄花黄素、丹参酮ⅡA、苦参碱、氧化苦参碱,其可能是抗纤维化作用的主要物质。有研究表明,淫羊藿苷能抑制HSC的上皮-间充质转化和胶原蛋白的降解,对CCL4诱导的肝纤维化小鼠模型具有保肝作用[27]。丹酚酸B通过调节TGF-β/Smad和MAPK信号通路减轻肝纤维化,特别是抑制MAPK介导的P-Smad2/3L信号通路[28]。绿原酸能够剂量依赖性的改善CCL4导致的肝纤维化大鼠的肝功能和氧化应激,抑制胶原纤维的增生起到保肝和抗肝纤维化作用[29]。在今后的实验中,将针对柔肝方主要入血成分的抗肝纤维化作用进行筛选和鉴定,以期进一步明确柔肝方抗肝纤维化的效应物质。
综上,本研究在明确FBRS诱导HSC活化的基础上,初步探讨中药柔肝方通过调节FBRS抗肝纤维化的机制。将在后续研究中,应用已建立的FBRS诱导HSC活化的筛选体系对柔肝方的各主要活性成分进行抗肝纤维化作用的筛选,为明确中药柔肝方肝纤维化的机制提供现代医学依据,为开发有效的机制明确的现代中药奠定基础。
