羟基红花黄色素A对糖氧剥夺/复糖复氧后星形胶质细胞保护作用及其机制研究①
2022-02-21韩光远刘可心魏汝恒苗珠月马存根肖保国黄建军宋丽娟
韩光远 刘可心 魏汝恒 苗珠月 马存根 肖保国 黄建军 宋丽娟
(山西中医药大学神经生物学研究中心/国家中医药管理局多发性硬化益气活血重点研究室,晋中 030619)
羟基红花黄色素A对糖氧剥夺/复糖复氧后星形胶质细胞缺血性脑血管病严重危害人类健康,炎症反应和氧化应激是其重要的病理生理过程。星形胶质细胞(astrocyte,Ast)作为中枢神经系统(central nervous system,CNS)中分布最广、数量最多的细胞类型,在脑缺血缺氧后过度活化会引起胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)高表达,其在炎症反应中的双重作用备受关注:脑缺血后,反应性星形胶质细胞(reactive astrocytes,RAs)一方面通过产生抗炎细胞因子和形成胶质瘢痕等发挥保护作用,另一方面又可以通过释放促炎因子和氧化应激损伤等进一步破坏脑组织[1-3]。研究发现,Ast在缺血性脑卒中炎症反应中的双重作用可能与其极化形成A1、A2两种不同亚型密切相关[4]。另外,脑缺血再灌注过程中Ast氧化应激会产生大量的酶使氧化-抗氧化系统紊乱,从而导致细胞损伤[5]。
作为治疗缺血性脑卒中的经典活血代表药物红花的有效单体成分羟基红花黄色素A(hydroxysafflor yellow A,HSYA),其相对分子质量为612(分子结构式如图1所示),具有抗缺血、抗炎、抗氧化及抗血栓的作用,对多种神经细胞都有保护功能[6-8]。但目前HSYA对糖氧剥夺/复糖复氧(oxygen-glucose deprivation/reoxygenation,OGD/R)后Ast的作用鲜有报道。本研究利用原代Ast,观察HSYA对OGD/R状态下Ast的保护作用并探索其相关机制,为临床应用活血化瘀药有效防治缺血性脑卒中提供实验依据,并试图为临床脑缺血的治疗提供新的治疗靶点。

图1 HSYA的分子结构式Fig.1 Molecular structure of HSYA
1 材料与方法
1.1 材料
1.1.1 动物C57BL/6小鼠,体质量16~18 g,购自北京斯贝福动物有限公司。动物实验遵照山西中医药大学生物医学研究伦理审查委员会制定的实验动物伦理原则执行科学实验。动物许可证号:SCXK(京)2019-0010。
1.1.2 主要药物与试剂HSYA(批号:4261)购自上海诗丹德标准技术服务有限公司;DMEM培养液、无糖型DMEM培养液和胎牛血清购自美国Gibco公司;胰酶、双抗、MTT检测试剂盒、LDH检测试剂盒购自北京索莱宝科技有限公司;抗C3抗体(ab200999)、抗S100A10抗体(ab76472)购自美国Abcam有限公司;抗PTX3抗体(D262383)购自上海生物工程有限公司;抗GFAP抗体(3670S)、抗p-NF-κB抗体(8242S)、抗p-STAT3抗体(9145S)购自美国Cell Signaling Technology公 司;HRP-羊 抗 兔 二 抗(BST15I16B15J55)、ALexa FluorTM488标记的山羊抗兔IgG二抗购自Thermo Fisher公司;TNF-α、IL-1β、IL-6、IL-10 ELISA检测试剂盒购自Elabscience生物科技有限公司;CAT、SOD、GSH-Px、ROS、RNS、MDA检测试剂盒购自上海泛柯实业有限公司。
1.1.3 主要仪器多用途低温高速离心机购自德国Eppendorf公司;MCO175型CO2培养箱购自日本SANYO公司;酶标仪购自美国Thermo公司;Bugbox M厌氧工作站购自英国Baker Ruskinn公司;荧光显微镜购自德国徕卡公司。
1.2 方法
1.2.1 小鼠原代Ast培养无菌条件下取新生1~3 d C57BL/6小鼠大脑皮质,在预冷的DMEM中剥离脑膜和血管,用吸管吹打形成单细胞悬液;4℃、1 500 r/min离心10 min。弃上清,加DMEM完全培养液继续吹打,过100目筛网,再次离心,1 500 r/min离心5 min。弃上清,加完全培养液重悬。接种于多聚赖氨酸包被的细胞培养瓶中。置于37℃、5%CO2的培养箱中进行培养。每3 d换液1次,直到细胞铺满整个瓶底,然后置于恒温摇床,37℃、180 r/min离心18 h,以去除小胶质细胞和少突胶质细胞。2.5 g/L胰酶消化传代。免疫荧光鉴定Ast纯度≥95%用于实验。
1.2.2 MTT检测Ast活力将第二代Ast接种于96孔板中,待细胞生长融合至80%时,加入含终浓度为0、1、5、25、75、150 μmol/L HSYA的DMEM培养液,按上述实验条件继续培养。培养24 h后小心吸弃上清,加入90 μl DMEM,再加入10 μl MTT,继续孵育4 h,终止培养。然后吸弃上清,加入110 μl Formanzan溶解液,摇床低速振荡孵育10 min,使结晶全部溶解。酶标仪490 nm波长测定吸光度A值。细胞活力=(A样本-A空白)/(A对照-A空白)×100%。
1.2.3 LDH检测HSYA对Ast的毒性(漏出率)将第二代Ast接种于96孔板中,待细胞生长至80%时,加入终浓度为0、1、5、25、75、150 μmol/L HSYA的DMEM培养液,按上述实验条件继续培养。取上清液检测LDH活性。根据标准曲线和试剂盒测得LDH活性。
1.2.4 相关实验分组及处理为探讨HSYA对Ast的保护作用,实验分为正常对照组(Normal)、模型组(OGD/R)和HSYA干预组(OGD/R+HSYA)。正常对照组在培养箱中常规培养,模型组在糖氧剥夺期间更换无糖DMEM培养液,放入95%N2、5%CO2的厌氧箱中孵育,4 h后更换为含糖DMEM培养液,然后放在常氧培养箱中继续孵育24 h。HSYA组在糖氧剥夺期间更换为含终浓度为75 μmol/L HSYA无糖培养液。
1.2.5 免疫荧光染色细胞爬片用4%多聚甲醛固定30 min,加入抗GFAP抗体,4℃孵育过夜,PBST洗涤,加入荧光二抗室温孵育2 h,PBST洗涤,加入DAPI染液避光孵育5 min,50%甘油封片,荧光显微镜下观察取图像,Image-ProPlus6.0软件分析结果。
1.2.6 RT-qPCR检测按照RNA提取试剂盒说明书从细胞中提取总RNA。按照TaKaRa逆转录试剂盒说明书合成cDNA;逆转录条件:37℃15 min,85℃5 s。特异性扩增引物由上海生工生物工程股份有限公司合成(表1)。按照2×M5 HiPer SYBR Premix EsTaq试剂盒说明书进行实时荧光定量PCR。反应体系(20 μl):SYBR Premix EsTaq 10 μl,上下游引物各0.4 μl,ddH2O 7.2 μl,cDNA模板2 μl。扩增条件:预变性95℃30 s;变性95℃5 s,退火62℃30 s,延伸72℃30 s,重复45个循环。使用2-ΔΔCt计算mRNA相对表达量。

表1 RT-qPCR引物种类及其序列Tab.1 RT-qPCR primer types and sequences
1.2.7 Western blot检测提取各组蛋白,用BCA法检测蛋白浓度。采用8%、10%凝胶SDS-PAGE电泳,湿转法将蛋白质转移至PVDF膜上,5%的脱脂奶粉室温封闭2 h,加入一抗,按比例稀释,4℃过夜,TBST清洗后加入二抗37℃孵育2 h,TBST洗去二抗,加入显影液。Bioanalytical Imaging System显影。目的条带采用Image J软件进行图像分析。
1.2.8 ELISA检测收集培养细胞上清液,细胞因子TNF-α、IL-1β、IL-6、IL-10测定采用相应的ELISA检测试剂盒,氧化抗氧化指标CAT、SOD、GSH-Px、ROS、RNS、MDA采用相应的氧化损伤检测试剂盒,具体操作方法按说明书推荐进行,参照各细胞因子标准曲线计算其含量。
1.3 统计学方法采用GraphPad Prism 8.0统计学软件进行分析,实验数据以±s表示,两两比较采用t检验,多组数据比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 HSYA对Ast活性的影响采用MTT和LDH检测HSYA对Ast的活性和毒性影响。如图2A所示,各组数据统计后无显著差异(P>0.05),表明Ast在正常培养条件下经不同浓度的HSYA处理后,并不影响细胞的活性和毒性,可根据后续实验需要,选择适当浓度。如图2B所示,Ast在OGD/R条件下,HSYA终浓度为75 μmol/L时Ast活力处于最高峰;如图2C所示,相比正常对照组,模型组在OGD/R后Ast的LDH释放量明显增多(P<0.01);75 μmol/L HSYA作用于OGD/R后的Ast时LDH释放量明显少于模型组(P<0.05)。因此,本实验选择终浓度为75 μmol/L HSYA作为后续实验药物的最佳浓度。
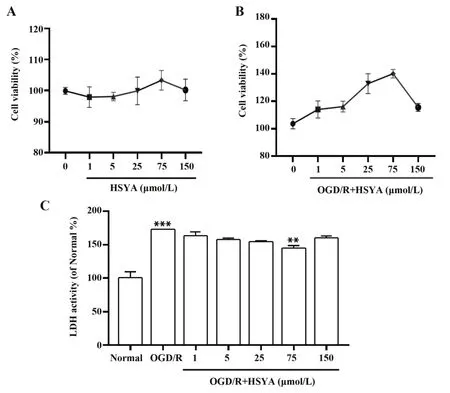
图2 MTT和LDH检测HSYA对Ast药物安全性Fig.2 MTT and LDH testing HSYA for Ast drug safety
在倒置相差显微镜下观察,可见正常组Ast贴壁生长,呈星形或不规则形态,细胞与细胞之间紧密连接,透光度好;糖氧剥夺4 h,复糖复氧24 h后镜下观察,发现Ast数量减少,突触回缩,细胞间紧密连接断开,细胞肿胀变形,从形态学观察可以看到氧糖剥夺对Ast有一定的损伤。75 μmol/L的HSYA可减轻OGD/R后Ast的损伤(图3A)。
免疫荧光染色显示,Ast的活化指标GFAP蛋白在正常组中表达较少(图3B)。但在OGD/R损伤后,GFAP蛋白在模型组较正常组表达显著增高,HSYA干预使GFAP蛋白的表达明显低于模型组。免疫荧光统计分析显示,模型组和HSYA干预组GFAP蛋白表达的平均荧光强度明显高于正常组,但HSYA组较对照组显著降低(图3C,P<0.05)。Western blot检测显示,模型组和HSYA组Ast活化标志物GFAP蛋白表达明显高于正常组,但HSYA组较对照组显著降低(图3D,P<0.05)。
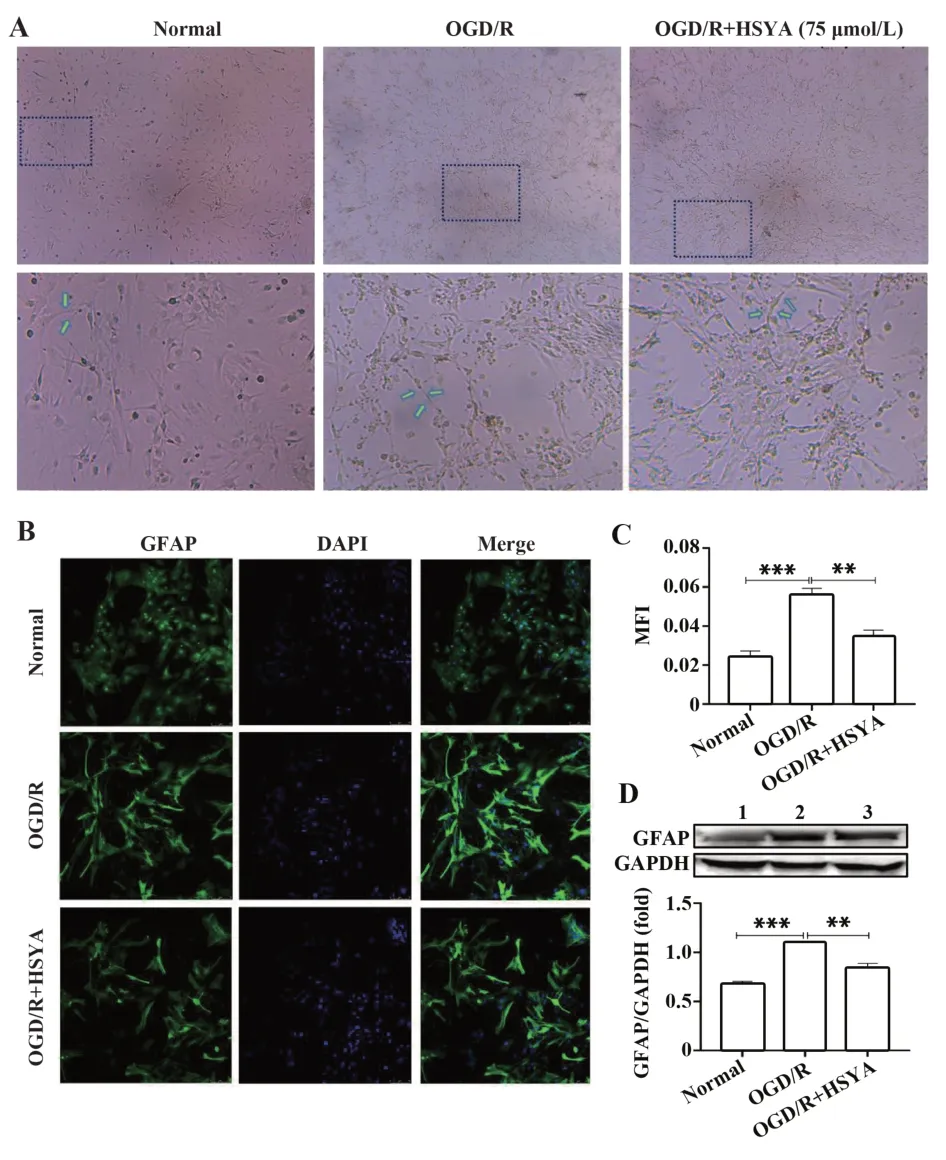
图3 HSYA对Ast活化的影响Fig.3 Effect of HSYA on activation of Ast
2.2 HSYA对OGD/R后Ast炎症反应的影响在mRNA水平上,相较于正常对照组,模型组TNF-α、IL-1β、IL-6和IL-10 mRNA水 平 均 显 著升 高(P<0.05);相较于模型组,HSYA干预使TNF-α、IL-1β、IL-6水平明显降低(P<0.05),而显著升高IL-10水平(P<0.05,图4A)。ELISA结果表明,模型组TNF-α、IL-1β、IL-6、IL-10蛋白水平显著高于正常对照组(P<0.05),HSYA干预组则明显降低TNF-α、IL-1β、IL-6水平,显著增加IL-10水平(P<0.05,图4B),与前述PCR实验结果相一致。这表明OGD/R可刺激Ast释 放 炎 症 因 子TNF-α、IL-1β、IL-6、IL-10,而HSYA可有效抑制Ast在OGD/R后促炎因子TNF-α、IL-1β、IL-6的分泌,而增加抑炎因子IL-10的分泌。
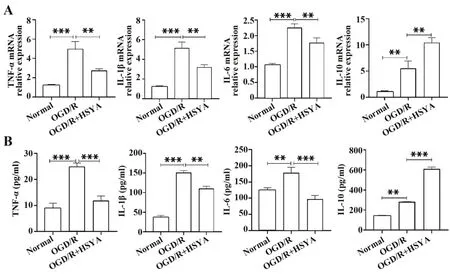
图4 HSYA对OGD/R后Ast炎症因子的影响Fig.4 Effect of HSYA on Ast inflammatory factors after OGD/R
2.3 HSYA对OGD/R后Ast极化的影响首先采用RT-PCR检测A1极化指标C3和A2极化指标S100A10以及PTX3 mRNA表达。结果显示(图5A),A1指标C3 mRNA水平模型组高于正常对照组(P<0.05),HSYA干预组低于模型组(P<0.05)。模型组A2极化指标S100A10和PTX3 mRNA水平均低于正常对照组(P<0.05),而HSYA干预组低于正常对照组,但高于模型组(P<0.05)。同样,在蛋白水平上,Western blot检测结果也表明(图5B),相比于模型组,HSYA可显著增加OGD/R后S100A10和PTX3的表达(P<0.05),降低C3的表达(P<0.05)。
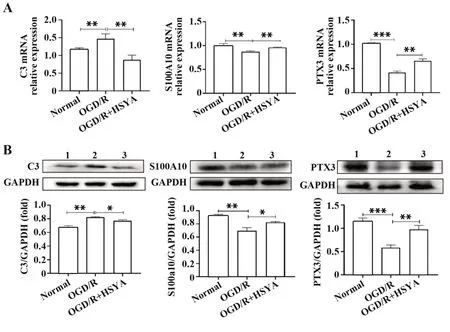
图5 HSYA对OGD/R后Ast极化的影响Fig.5 Effect of HSYA on polarization of Ast after OGD/R
2.4 HSYA对OGD/R后Ast p-NF-κB(p65)和p-STAT3蛋白水平的影响采用Western blot法检测p-NF-κB(p65)和p-STAT3蛋白表达。结果显示(图6),模型组p-NF-κB(p65)和p-STAT3蛋白明显高于正常组(P<0.05);而HSYA干预组低于模型组(P<0.05)。
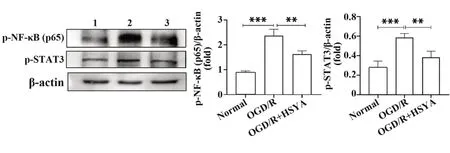
图6 HSYA对OGD/R后Ast p-NF-κB(p65)和p-STAT3蛋白水平的影响Fig.6 Effect of HSYA on protein levels of Ast p-NF-κB(p65)and p-STAT3 after OGD/R
2.5 HSYA对OGD/R后Ast氧化应激作用的影响图7显示,模型组CAT、SOD、GSH-Px的含量均显著降低,而RNS、ROS、MDA均显著升高,且与正常组比较差异有统计学意义(P<0.05)。经HSYA干预处理后,CAT、SOD、GSH-Px含量有所增加,RNS、ROS和MDA含量有所降低,与模型组比较差异有统计学意义(P<0.05)。
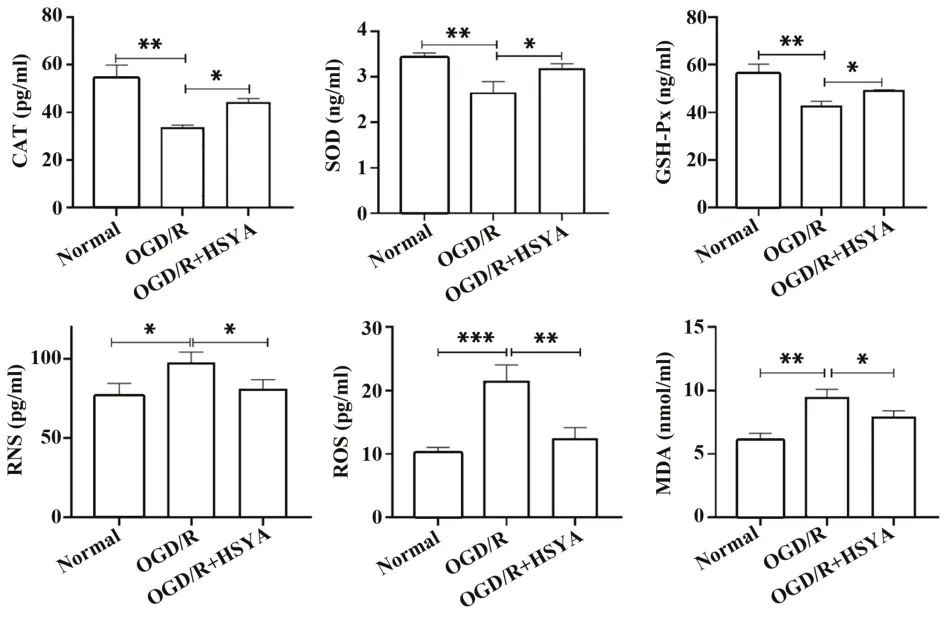
图7 HSYA对OGD/R后Ast氧化应激作用的影响Fig.7 Effect of HSYA on oxidative stress of Ast after OGD/R
2.6 HSYA对OGD/R后Ast Nrf2和HO-1蛋白 水 平的影响通过Western blot检测氧化应激相关通路Nrf2/HO-1。结果显示(图8),模型组Nrf2和HO-1蛋白明显低于正常组(P<0.05);而HSYA干预组则高于模型组(P<0.05)。
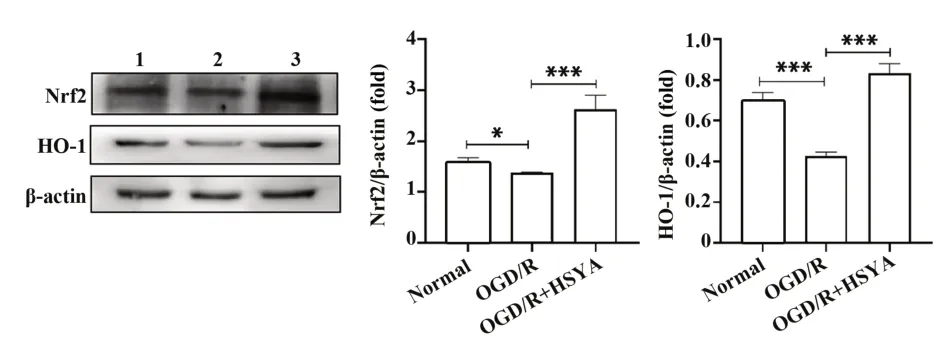
图8 HSYA对OGD/R后Ast Nrf2和HO-1蛋白水平的影响Fig.8 Effect of HSYA on protein levels of Ast Nrf2 and HO-1 after OGD/R
3 讨论
脑缺血后,Ast被激活成为RAs。Ast在脑缺血缺氧进程中同时具有保护和损伤双重作用[9]。这种双重作用可能与RAs进一步极化形成两种不同的亚型A1和A2密切相关。A1和A2动态调节免疫反应和炎症微环境。A1促进相关损伤,C3被认为是A1的特征性标记;而A2发挥着保护作用,S100A10、PTX3被认为是A2的特征性标记[10]。核因子-κB(nuclear factor kappa B,NF-κB)作为脑缺血后炎症反应中的关键转录因子[11],在Ast的激活以及神经炎症的发生过程中发挥重要作用[12]。活化的NF-κB可通过调控炎症因子TNF-α、IL-1β和IL-6的产生促进炎症反应。TSUBAKI等[13]和CAO等[14]的研究表明,抑制或阻断NF-κB活化可下调细胞中TNF-α、IL-1β和IL-6表达,减轻炎症反应。另外,信号转导和转录激活因子3(signal transducers and activators of transcription 3,STAT3)也在脑缺血后Ast中表达并且活性发生改变[15]。IL-6的高表达可以促进STAT3持续磷酸化,IL-6/STAT3也是细胞内介导炎症信号转导的重要通路,其可介导促炎细胞因子TNF-α、IL-1β和抑炎细胞因子IL-4、IL-10等多种炎症因子的产生。Ast在脑缺血期间可通过NF-κB及STAT3通路来诱导炎症细胞因子和神经毒性介质的释放,导致神经元的损伤和死亡[16]。通过PCR以及Western blot技术检测A1与A2的特异性标志和炎症因子的表达,发现Ast在OGD/R后,C3被显著诱导高表达,而S100A10、PTX3低表达,且炎症因子TNF-α、IL-1β、IL-6的分泌增加。这表明,Ast在OGD/R后确实存在着向A1极化的方向,并且促进了致炎因子的释放。且在OGD/R时,A1的表达比A2更高。此外,还对影响Ast炎症和极化的p-NF-κB(p65)以及p-STAT3也做了相应的研究,结果表明OGD/R可 以 上 调p-NF-κB(p65)以 及p-STAT3的表达。
目前,已有大量相关研究表明,HSYA具有抗缺血、抗炎和抗氧化等作用[17-18]。在体内脑缺血损伤模型中,HSYA可以增强脑缺血-再灌注大鼠缺血半暗带区Ast的活性[19]。在体外模型中,HSYA还可以抑制OGD诱导的BV2小胶质细胞的炎症反应[20]。在Aβ诱导的阿尔茨海默病模型中,HSYA可以抑制小胶质细胞和Ast的活化从而降低炎症反应[21]。本研究发现HSYA干预能够降低OGD/R损伤后Ast的活化,减少GFAP的表达并调节A1与A2的平衡。同时,经HSYA处理后,能够减少促炎因子TNF-α、IL-1β和IL-6分泌,增加IL-10分泌,从而减轻炎症反应。HSYA还可以降低p-NF-κB(p65)以及p-STAT3的表达。表明HSYA可能是通过抑制p-NF-κB(p65)以及p-STAT3来调节脑缺血后Ast炎症和极化。
同样,HSYA也在抗氧化应激方面发挥了调节作用。田京伟等[22]在MCAO模型中发现,HSYA对缺血脑细胞线粒体损伤有明显的保护作用,能明显降低脑缺血大鼠脑线粒体MDA含量,升高SOD活性。本研究表明HSYA同样可以增加OGD/R损伤后Ast CAT、SOD、GSH-Px的活性,降低RNS、ROS、MDA含量,减轻OGD/R后Ast氧化应激导致的损伤。核因子E2相关因子2(NF-E2-related factor 2,Nrf2)是细胞内抗氧化应激功能的重要转录因子,也是防治脑缺血的重要潜在靶点[23]。活化的Nrf2可启动下游信号HO-1,进而发挥抗氧化应激、清除自由基等作用[24-25]。刘莹等[26]研究表明,青蒿琥酯通过Nrf2/HO-1信号通路增强了脑缺血后的抗氧化作用,能保护脑组织。周海燕等[27]研究发现吴茱萸茨碱可能通过激活Nrf2/HO-1通路减轻局灶性脑缺血大鼠氧化应激损伤并缓解氧化-抗氧化失衡。由此可见,越来越多的研究表明,Nrf2/HO-1通路的激活可减轻脑缺血引起的氧化应激损伤。本研究表明,HSYA增加OGD/R后Nrf2/HO-1的表达,提示HSYA可能通过Nrf2/HO-1通路抑制脑缺血后氧化应激,减轻脑损伤。
综上所述,本研究发现HSYA可以降低Ast活化,抑制炎症因子的释放并影响极化水平,这可能是通过抑制p-NF-κB(p65)与p-STAT3通路实现的;同时,HSYA也可能通过Nrf2/HO-1通路减轻缺血后氧化应激损伤,表明HSYA可能在脑缺血后Ast中起着复杂的多重作用;即HSYA对OGD/R后Ast一方面能够减轻炎症反应并调节A1与A2的表型,另一方面发挥抗氧化作用降低氧化损伤,共同减轻缺血性损害,这为HSYA治疗神经系统疾病提供理论依据。但本研究只在细胞模型上做了研究,在动物体内还存在着各种复杂的反应机制,HSYA在动物体内是否具有同样的保护作用,还需要进一步研究证实。
