基于网络药理学和分子对接探讨蒙药额尔敦-乌日勒治疗癫痫的潜在作用机制
2022-02-21薛金晔
于 凯,卜 凡,李 鹏,苏 秦,夏 蕾,薛金晔,郝 雷
(1.内蒙古医科大学 第一临床医学院,内蒙古 呼和浩特 010050;2.内蒙古医科大学附属医院 儿科,内蒙古 呼和浩特 010050;3.内蒙古医科大学 内蒙古临床医学院,内蒙古 呼和浩特 010110;4.内蒙古医科大学 基础医学院病理生理学教研室,内蒙古 呼和浩特 010110)
据WHO统计,全球癫痫患者超过5 000万,而癫痫患者中有超过八成分布在发展中国家,其中我国癫痫患者超过600万,每年还有40万左右的新发癫痫患者,我国癫痫患病率为4‰~7‰,年发病率在3左右[1]。目前,抗癫痫药物治疗为目前临床最主要的治疗方案,对于癫痫短期临床发作,60%~70%的患者可以实现无癫痫症状发作[2],但对于癫痫的长期治疗尚无满意治疗方案[3]。
药物额尔敦-乌日勒,也称额尔敦-乌日勒,是蒙药中治疗和预防神经和精神系统疾病的常用药物,具有神经保护及神经再生作用[4-5]。据研究表明此药不仅能抑制癫痫的发生和发作程度,还能减轻癫痫发作后的认知及情绪方面的并发症[6]。但迄今为止,额尔敦-乌日勒治疗癫痫的作用靶点及潜在作用机制尚不明确。本研究将基于网络药理学和分子对接技术探讨额尔敦-乌日勒治疗癫痫的作用靶点及潜在作用机制,现将研究情况报道如下。
1 研究方法
1.1 额尔敦-乌日勒活性成分的靶点分析
利用药物口服利用度(oral bioavailability,OB)≥30%,且类药性(drug-likeness,DL)≥0.18为筛选条件,通过筛选中药系统药理学数据库与分析平台(TCMSP数据库)(http://tcmspw.com/tcmsp.php)、Swiss Target Prediction数据库(http://www.swisstargetprediction.ch)和HERB数据库(http://herb.ac.cn/)预测出额尔敦-乌日勒的主要有效成分靶点,在UniProt数据库(https://www.uniprot.org/)中输入有效成分对应的作用靶点,筛选条件为Human,将全部靶点统一为标准格式。
1.2 乳腺癌疾病潜在作用的靶点分析
检索TTD(http://db.idrblab.org/ttd/)、OMIM(https://omim.org/)数据库、Phenopedia数据库(https://phgkb.cdc.gov/PHGKB/startPagePhenoPedia.action),以 “epilepsy”“breast carcinoma”“Seizures”为关键词,检索与癫痫相关的靶基因,获得疾病的相关作用靶点。
1.3 数据处理
利用Venny图对药物的作用靶点与疾病相关的作用靶点进行交集,所得出的交集靶点为额尔敦-乌日勒治疗癫痫的关键靶点。
1.4 药物成分-疾病-关键靶点网络的建立
应用Cytoscape 3.7.2软件绘制并建立“药物成分-疾病-关键靶点”关系网络,网络外围节点代表疾病与药物成分的关键靶点,整个网络将展示药物成分-疾病-关键靶点之间的联系,通过构建这一网络,探究额尔敦-乌日勒抗癫痫的作用机制。
1.5 关键靶点蛋白相互作用网络的构建
利用STRING数据库在线平台(https://string-db.org/),预测关键靶点的蛋白相互作用关系。将药物与疾病交集作用靶点的文件导入到STRING数据库,将研究物种设置为人类(Homo sapiens),其他参数保持默认设置。利用Multiple proteins工具,构建蛋白-蛋白相互作用(protein-protein interaction,PPI)网络模型,获得关键靶点蛋白相互作用(PPI)网络。
1.6 GO富集分析和KEGG通路分析
利用AmiGO2平台(http://amigo.geneontology.org/amigo)和bioinformatics平台(http://www.bioinformatics.com.cn/login/),对获得的基因进行GO富集分析和KEGG通路分析,以P<0.05作为筛选条件,分别绘制出通路图和dotplot点图。
1.7 关键作用位点与额尔敦-乌日勒主要成分的分子对接
选取额尔敦-乌日勒内关键成分与潜在的作用位点,利用AutodockTools1.5.6进行分子对接,验证所预测关键靶点与药物主要活性成分之间的结合效果。其具体操作方法为:①在PubChem数据库中检索获得额尔敦-乌日勒主要活性成分的SDF结构文件,利用Chem3D软件及AutoDockTools1.5.6软件将SDF文件转化为PDBQT文件;②在Protein Data Bank数据库(http://www1.rcsb.org/)中检索出并获得关键蛋白的PDB格式,利用PYMOL 2.3.4软件去除获得蛋白中的水分子及小分子配体。利用AutoDockTools1.5.6软件对获得蛋白进行加氢、平衡电荷等操作,将其保存为PDBQT文件;③在AutoDockTools1.5.6中利用Grid Box命令打开Grid Options工具对每个受体蛋白进行处理,通过设置配体盒子的中心位点和大小,将受体蛋白转化为PDBQT文件;④利用AutoDock Vina对受体蛋白与配体小分子分别进行分子对接,结合能(affinity)打分及对接参数。结合能数值越低,代表受体-配体复合物具有越好的结合效果;⑤选取与配体分子结合效果好的靶点,输出分子对接模拟图,采用PyMOL 2.3.4软件将分子对接模拟图及可能的结合位点结果可视化。
2 结果
2.1 额尔敦-乌日勒抗乳腺癌的潜在作用靶点预测
通过TCMSP数据库和Swiss Target Prediction数据库检索,获得其中收录的额尔敦-乌日勒中主要作用靶点共246个。检索OMIM数据库、Phenopedia数据库、TTD数据库,共检索到癫痫潜在作用靶点1 250个。整合获得数据,去除重复项,共有乳腺癌潜在作用靶点1 076个。利用Venny图对药物的作用靶点与疾病相关靶点进行交集,共获得关键靶点47个,见图1。共获得关键靶点AR、NOS2、GSK3B、GRIA2、GABRA1、PTGS2、EGFR、AKT1、TNF、HIBCH、NR1I2、PRKCB、AKR1B1、MAOA、ADORA1、GLO1、APP、MMP9、CYP1B1、ABCG2、ABCC1、ACHE、ABCB1、TERT、F2、DRD4、GRM1、MTNR1B、SLC6A3、EPHX1、P2RX7、TNFRSF1B、SLC6A4、SCN5A、CHRNA7、CHRM3、CHRM1、CYP1A1、CASP8、HTR2A、PPARG、ALDH2、CASP1、MMP8、ITGA4、ITGB3、BRAF,共47个。

图1 额尔敦-乌日勒中主要作用靶点及关键靶点
2.2 药物成分-疾病-关键靶点网络的建立与分析
将额尔敦-乌日勒的主要作用靶点和癫痫疾病相关疾病靶点导入Cytoscape 3.7.2软件,构建药物成分-疾病-关键靶点网络(图2)。左侧图的中心位置为癫痫疾病,右侧图的中心位置为额尔敦-乌日勒成分,周围节点为两者共同相关基因。图中共有药物和疾病共同靶点47个,共1 275个节点,节点与节点之间的作用关系——即“边”,共有1 342条“边”。

图2 药物成分-疾病-关键靶点网络
2.3 蛋白质-蛋白质互相作用网络的构建
将47个共同靶点导入STRING数据库中,构建蛋白-蛋白相互作用(PPI)网络模型,如图3所示。在PPI网络中,“边”代表作用靶点之间的关联,其粗细用combine score表示,“边”越粗,combine score值越大,代表其结合度越大;节点代表作用靶点。由导出结果可知,该网络模型共有47个节点、207条边,平均节点度(Degree)为8.81,Degree值越大即表示该靶点处于网络的核心地位,经可视化处理后得到图3,Degree值越大具有更大的图像和更亮的颜色,如共同靶点中的丝氨酸/苏氨酸蛋白激酶(AKT1)、淀粉样前体蛋白(APP)、前列腺素G/H合酶2(PTGS2)、肿瘤坏死因子(TNF)及表皮生长因子受体(EGFR)这些蛋白在药物治疗疾病的调控过程中起关键作用。

图3 蛋白质-蛋白质互相作用网络
2.4 GO富集分析
在GO富集分析结果中,选取P值排名前5的生物功能(Biological processes,BP),可得额尔敦-乌日勒主要影响包括鞘脂易位作用、多巴胺能对突触传递的负调节、受体生物合成过程、白细胞介素1α分泌的正调控和异种运输。其细胞成分(Cellular component,CC)胶质细胞投射、转移酶复合物-转移含磷基团、轴突、整合素复合物和主轴突。其分子功能(Molecular function,MF)排名前5的分别是外源性跨膜转运ATP酶活性、G蛋白偶联的乙酰胆碱受体活性、多巴胺、钠共转运蛋白活性、乙酰胆碱结合和鞘脂转运蛋白活性,见图4。
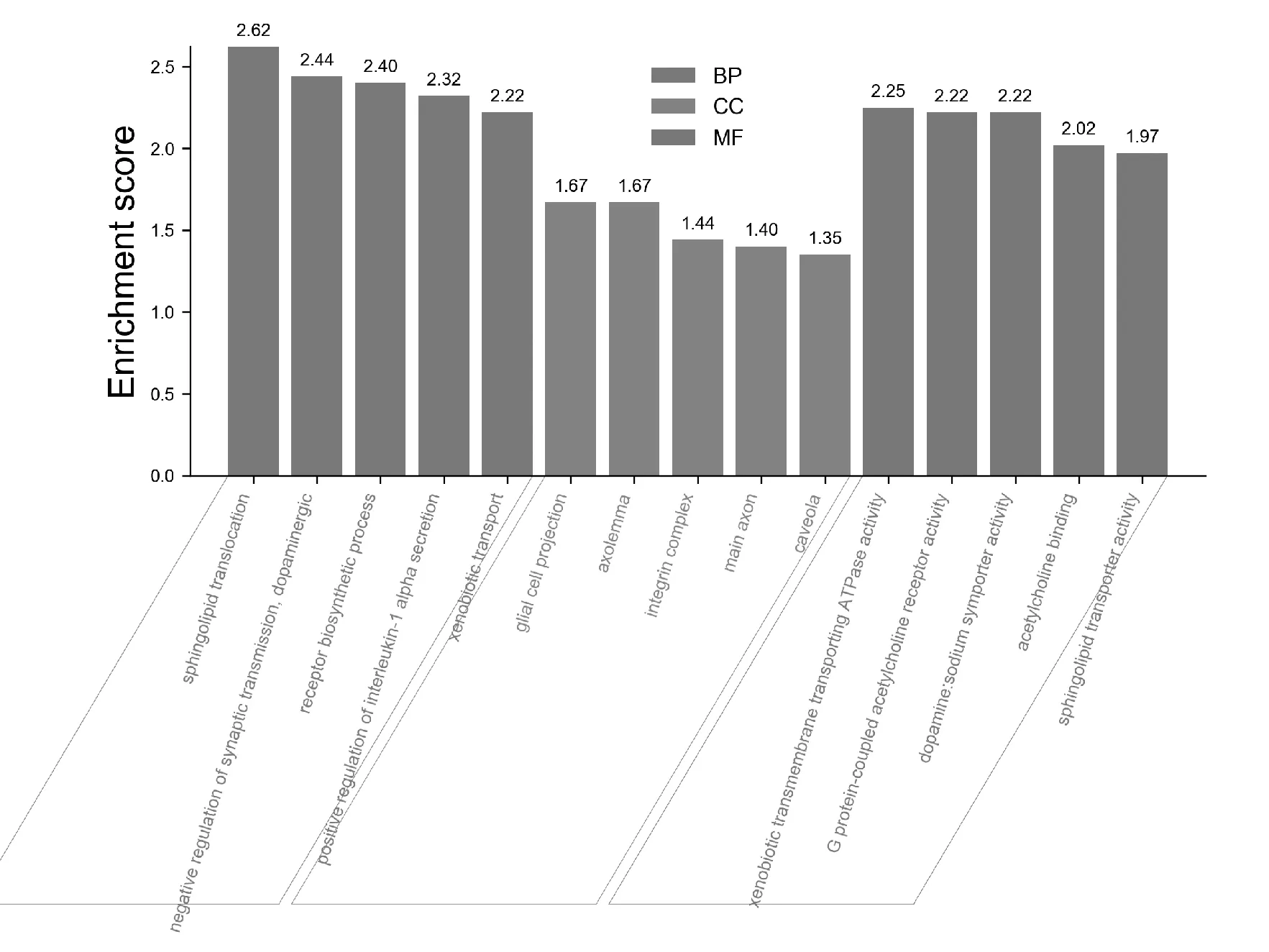
图4 GO富集分析
2.5 KEGG通路富集分析
KEGG通路富集分析结果显示,47个关键靶点显著富集在68条通路上(P<0.05),其靶点主要作用于包括色氨酸代谢通路、抗叶酸通路、组氨酸代谢通路、肌萎缩性侧索硬化症(ALS)、神经活性配体-受体相互作用和钙信号通路等通路中,提示额尔敦-乌日勒通过多种作用、多条通路发挥治疗癫痫的作用,见图5。将KEGG通路富集情况经可视化处理,通路中富集的靶点数目越多,所对应圆圈越大;颜色越深,则药物对应靶点越可能为乳腺癌治疗靶点,如图6所示;其中有关5-羟色胺能突触通路影响最为明显。
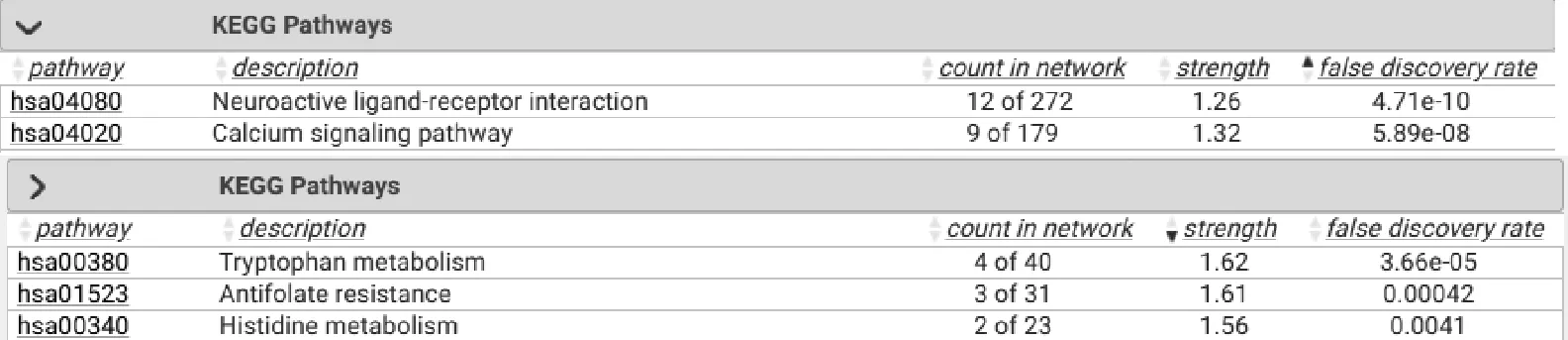
图5 KEGG通路富集分析
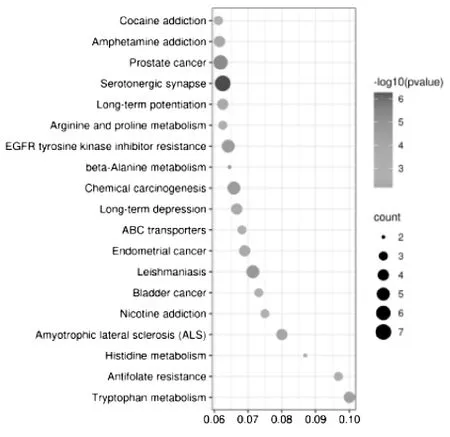
图6 KEGG通路富集情况可视化处理
选取药物成分-疾病-关键靶点网络高于平均值的靶点,选取额尔敦-乌日勒中主要成分异鼠李素(isorhamnetin)、木犀草素(luteolin)、异牧荆素(isovitexin)、牛磺胆酸钠(Deoxycholic Acid)和3-甲基环十五烷酮(3-Methyl desoxycholate)与靶点进行分子对接,结合能<-7.0 kcal·mol-1表示具有较好的结合效果,对接的效果与结合能负值大小呈正相关。分子对接情况,如表1所示。结果显示,化合物与靶蛋白的最低结合能都<0,说明配体与受体可以自发结合,其中aldh2-木犀草素、Cyp1a1-木犀草素、Casp8-3-甲基环十五烷酮结合能较低,其分子对接模式见表1和图7-图10。
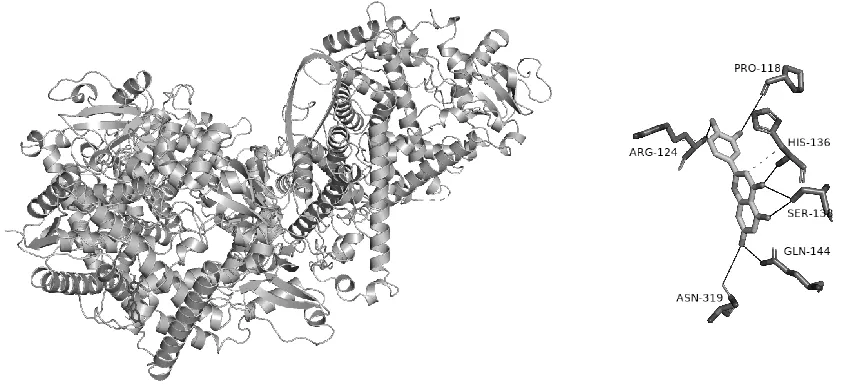
图7 Cyp1a1-木犀草素及结合位点

图8 aldh2-木犀草素及结合位点

图9 Casp8-3-甲基环十五烷酮及结合位点

图10 MAOa-甲基环十五烷酮及结合位点

表1 关键靶点与其相关化合物的结合能
3 讨论
现代研究表明,额尔敦-乌日勒具有治疗白脉病的功效,白脉病指的是神经系统疾病,一般症状是浑身抽搐、口眼歪斜等,这与临床医学中的癫痫相对应[7]。在已有研究中,额尔敦-乌日勒被证实具有减轻脑电图与肌电图在弥漫性不规则中、高波幅混合慢波上,夹杂大量杂乱多灶性棘波、尖波等癫痫特异性脑电图的效果[8],但其具体机制尚未明确,因此探索额尔敦-乌日勒的主要成分及其在治疗癫痫方面的主要作用位点,有助于进一步探讨癫痫的发生机制并为开发靶向治疗药物提供理论依据。
额尔敦-乌日勒中的黄酮类化合物具有调节炎症和细胞生存相关的microRNA表达的特性,可缓解癫痫发作时口眼歪斜和四肢抽搐等症状[9],额尔敦-乌日勒中木犀草素可通过降低表皮生长因子(Epidermal growth factor,EGF)的 mRNA 表达,从而抑制 EGF 介导氧化磷酸化、ERK 和 MARK-PI3K-Akt信号通路激活[10-11],可增强脑内神经胶质细胞稳定性,从而抵抗癫痫发生[12]。郑新元等[13]研究发现,从药物抗癫痫活性部位中提取出的总黄酮含量越高,其抗癫痫的作用也越强。因此在一定的剂量下,额尔敦-乌日勒能显著抑制大鼠癫痫的发生[14]。黄酮类化合物是导致海马环磷腺苷效应元件蛋白(CREB)磷酸化,进而导致细胞外信号调节激酶(ERK)和脑源性神经营养因子(BDNF)升高的一种多酚类化合物。类黄酮家族几个成员也可通过CREB-BDNF通路的相互作用表现出对癫痫发作的抑制[15]。在国外学者的研究中,黄酮类化合物可通过增强海马内星形胶质细胞中BDNF的表达发挥神经保护作用,可提高神经元对于癫痫发生时局部异常放电刺激的抵抗能力,从而降低癫痫的发作强度和发作时间[16-17]。
本研究中,额尔敦-乌日勒中黄酮类化合物对于caspase-8、caspase-9、MAOA等位点具有较高的亲和性。有证据表明,癫痫发作停止是由于诱导细胞程序性死亡的结果,有关的癫痫凋亡标记物caspase-1、caspase-2、caspase-8、caspase-9与全身性癫痫的发作呈正相关[18]。其中的caspase-8比caspase-9能更有效阻断癫痫诱导细胞死亡[19]。癫痫的发作多由于脑中5-HT不足引起,单胺氧化酶(MAOA)可以降解5-HT这种抑制性神经递质,5-HT浓度的降低可能导致神经调质系统的失衡[20],导致脑内神经突触异常,从而增加癫痫发生的可能性。在另一些研究中,部分学者发现针对抑制MAOA的治疗已被证实有强有力的抗惊厥能力,对于癫痫的治疗具有良好的效果[19]。
综上所述,本研究应用网络药理学的手段对额尔敦-乌日勒的主要活性成分及药理作用,以及与癫痫作用通路的关系进行了分析,阐述了额尔敦-乌日勒通过多靶点、多通路的复杂作用机制调节癫痫相关信号表达从而达到抗癫痫的作用,为进行更深入的相关实验研究奠定了基础,同时也为进一步研究一种潜在的、安全有效的癫痫辅助用药提供了新思路。
