间充质干细胞联合灯盏花素基于Galectin-3/Akt/Snail通路对肾脏纤维化的影响研究
2022-02-21张宇韦李健春汤华军
张宇韦,李健春,钟 霞,汤华军,陈 波
(1.西南医科大学附属中医医院,四川 泸州 646000;2. 西南医科大学基础医学院,四川 泸州 646000)
各种病理因素导致的慢性肾脏病(CKD)是人类心血管疾病、早衰及终末期肾病的主要风险因素。我国成年人CKD发病率为8%~12%[1],其具有发病率高、伴发心血管病率高、病死率高的特点,给医疗系统和家庭带来沉重负担。肾脏纤维化是各种慢性肾病进程中的主要病理变化,抗纤维化治疗仍是治疗重点和难点,单一方法治疗肾组织病理改变不明显,肾功能恢复不理想。中医认为纤维化形成主要由气血壅滞、经络痹阻、痰湿搏结或三者相辅作用而成,治疗主要选用活血化瘀、益气养阴、清热散结类中药,其中活血化瘀类药物抗肾纤维化作用佳[2]。活血化瘀类中药灯盏花素是从灯盏细辛中提取的黄酮类化合物,具有解毒、祛风除湿、活血化瘀、通经活络、消炎止痛及抗凝、抗血栓形成、改善血液流变性及微循环、提高机体耐缺氧能力等作用,主要用于心脑血管疾病[3]、高血压肾病[4]、糖尿病肾病[5]、肝纤维化[6]等的治疗。Jiang等[7]报道灯盏花素可通过磷酸化PKCβⅡ/Akt/JNK1/2/p38信号通路改善糖尿病肾病小鼠肾脏纤维化。但灯盏花素单独治疗CKD纤维化疗效有限。间充质干细胞(MSCs)是目前最有应用前景的干细胞之一,和肾脏发育具有中胚层同源性。文献报道MSCs无论是单独应用,还是与生长因子联用,均能延缓CKD疾病进展,有效改善肾功能[8-9]。MSCs可能是通过抑制上皮间质转分化(EMT)、自分泌或过表达各种生长因子或免疫调节作用延缓CKD病程进展达到抗纤维化作用[10]。本实验利用MSCs在体外易获得扩增、低免疫原性、具有细胞因子分泌能力和免疫调节能力等优势,观察了MSCs与灯盏花素联合抗CKD肾脏纤维化的效果和可能机制。
1 实验材料和方法
1.1实验动物 雄性健康SD大鼠50只,体重250~280 g,购自成都达硕实验动物有限公司,合格证号:SCXK(川)2019-17。大鼠饲养在恒温20~22 ℃、湿度50%~60%环境中,昼夜12 h/12 h交替,适应性饲养1周后进行实验,操作符合西南医科大学实验动物伦理委员会要求(2020773)。
1.2主要药物及试剂 灯盏花素购自湖南恒生制药股份有限公司(国药准字Z20063405)。MSCs无血清专用培养基(N6010)购自北京索莱宝科技有限公司。一抗I型胶原A1(ColIA1)(# 72026)、α-平滑肌肌动蛋白(α-SMA,#19245)、Galectin-3(# 87985)、Snail1 (#3879)、p-Akt(#4060)和Akt(#2920)抗体购自Cell Signaling Technology,基质金属蛋白酶-9(MMP-9,ab38898)抗体购自Abcam。血肌酐(Cr)、尿素氮(BUN)试剂盒购自南京建成生物工程研究所;Sirius Red染色试剂盒购自南京森贝伽生物科技有限公司;Masson染色试剂盒购自北京索莱宝科技有限公司。MSCs流式细胞表型鉴定抗体包括阳性标记CD44-PE(ab23396)、CD29-PE/Cy7 (ab95622)和阴性标记CD45-FITC (ab33916)均购自Abcam公司,CD34-FITC (11-0341-82)购自 eBioscience。油红O(G1262,北京索莱宝科技有限公司),茜素红(ZY121105,上海泽叶生物科技有限公司)。
1.3骨髓源性MSCs原代培养和鉴定 取10只健康雄性SD大鼠[西南医科大学实验动物中心,合格证号:SYXK(川)2018-065],体重120~140 g,无菌条件取出双下肢股骨和胫骨,用注射器从骨两端打孔后用无菌PBS冲出骨髓,收集骨髓,1 000 r/min离心(离心半径380 mm)3 min后去上清,用无血清MSCs专用培养基重悬细胞后,来自每只大鼠的骨髓悬液接种2瓶细胞(5×106/瓶),72 h后全量换液,体外按照1∶3比例传代。传至第3代,细胞经流式表面抗原检测,CD29、CD44和CD90呈强阳性表达,CD34和CD45呈阴性表达;油红O染色发现大小不一红色脂滴,证实MSCs有明显成脂能力;茜素红染色试剂盒检测显示橘红色钙沉积矿化结节,证实MSCs有明显成骨能力。
1.4分组、建模及干预 将50只健康雄性SD大鼠称重后随机分为正常组、模型组、灯盏花素组、MSCs组、灯盏花素+MSCs组,每组10只。除正常组外,其余组大鼠采用阿霉素5 mg/kg尾静脉一次注射加腺嘌呤150 mg/kg连续灌胃15 d方法诱导建立CKD模型。建模结束后,灯盏花素组给予灯盏花素25 mg/kg连续灌胃7 d;MSCs组在建模结束后第3天,尾静脉注射无菌生理盐水MSCs细胞悬液2×106/kg;灯盏花素+MSCs组给予灯盏花素连续灌胃7 d,同时建模结束后第3天尾静脉注射无菌生理盐水MSCs细胞悬液2×106/kg。
1.5检测指标及方法
1.5.1肾功能和肾脏指数 实验结束后第3天收集24 h尿液,检测24 h尿蛋白;经10%水合氯醛麻醉大鼠后取血,检测血肌酐(Cr)和尿素氮(BUN)水平;处死大鼠后取肾脏,计算肾脏指数(肾脏重量/鼠重×100%)。
1.5.2肾脏组织病理观察 取各组大鼠部分肾脏组织,经4%多聚甲醛固定后,石蜡包埋进行常规病理切片,分别采用HE染色、Masson染色和Sirius Red染色进行肾组织病理观察。
1.5.3肾脏组织中ColIA1、MMP-9表达情况 采用免疫组织化学SP法检测:取制备好的各组大鼠肾脏组织石蜡切片,脱蜡梯度复水,置柠檬酸缓冲液(pH 6.0)中微波抗原修复,自然冷却至室温,现配3%过氧化氢孵育10 min,PBS洗3次。滴加 5% BSA封闭30 min后甩干,滴加一抗,4 ℃湿盒孵育过夜。PBS洗涤3次,滴加辣根过氧化物酶标记的对应二抗,室温孵育1 h,PBS洗涤3次,DAB显色,镜下控制显色时间,蒸馏水冲洗终止反应。苏木素复染核后水洗,无水乙醇脱水,二甲苯透明,中性树胶封片,每个样本采图3~5张,计算ColIA1、MMP-9阳性标记面积累计光密度IOD值。
1.5.4肾脏组织中Galectin-3/Akt/Snail通路相关因子表达情况 采用Western blot法检测:取各组大鼠肾脏组织200 mg,液氮研磨后加入300 μL RIPA裂解液置冰上振摇30 min,超声后离心取上清,采用BCA蛋白定量后,加入5×Loading buffer,95 ℃煮沸10 min,小份分装置-20 ℃冰箱冻存。上样量40 μg,10%聚丙烯酰胺凝胶电泳分离蛋白,PVDF转膜后5%脱脂奶粉或5%BSA(磷酸化蛋白)封闭1 h,加一抗4 ℃孵育过夜,次日TBST洗膜3次,每次5 min。加对应二抗室温孵育1 h,TBST洗膜3次,每次5 min,用高敏ECL显色试剂孵育1~2 min后凝胶成像系统自动成像。用Gel-Pro Analyzer软件测量灰度值,GAPDH为内参蛋白。
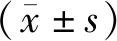
2 结 果
2.1各组大鼠肾功能和肾脏指数比较 实验结束后,模型组24 h尿蛋白、血清Cr和BUN水平及肾脏指数均明显高于正常组(P均<0.05);灯盏花素组、MSCs组和灯盏花素+MSCs组各指标均明显低于模型组(P均<0.05),各干预组间各指标比较差异均无统计学意义(P均>0.05)。见图1。

图1 正常组和慢性肾脏病各组大鼠肾脏指数和肾功能指标比较
2.2各组大鼠肾脏组织病理表现 HE、Masson和Sirius Red染色显示,模型组肾组织结构紊乱,炎性细胞浸润明显,肾小管腔内腺嘌呤结晶沉着,肾小管管腔扩张或萎缩,肾间质胶原纤维化明显增加,肾小球毛细血管扩张、系膜增厚。灯盏花素组、MSCs组和灯盏花素+MSCs组肾组织病理改变明显较模型组轻,其中灯盏花素+MSCs组最轻。见图2。

图2 正常组和慢性肾脏病各组大鼠肾脏组织HE、 Masson和Sirius Red染色表现(×200)
2.3各组大鼠肾脏组织中ColIA1、MMP-9表达情况 免疫组化染色显示,ColIA1主要表达于肾小管间质中,模型组ColIA1阳性标记面积累计光密度IOD值明显高于正常组(P<0.05),灯盏花素组、MSCs组和灯盏花素+MSCs组均明显低于模型组(P均<0.05),MSCs组和灯盏花素+MSCs组阳性标记更少;MMP-9主要表达于肾小管上皮细胞胞浆中,模型组MMP-9阳性标记面积累计光密度IOD值明显低于正常组(P<0.05),灯盏花素组、MSCs组和灯盏花素+MSCs组均明显高于模型组(P均<0.05),MSCs组和灯盏花素+MSCs组阳性标记更明显。见图3及图4。

图3 正常组和慢性肾脏病各组大鼠肾脏组织中ColIA1和MMP-9免疫组化染色表现

图4 正常组和慢性肾脏病各组大鼠肾脏组织中ColIA1和MMP-9阳性标记面积累计光密度IOD值比较
2.4各组大鼠肾脏组织中Galectin-3/Akt/Snail通路相关因子表达情况 模型组肾脏组织中p-Akt/Akt、α-SMA、Galectin-3、Snail1表达量均明显高于正常组(P均<0.05),灯盏花素组、MSCs组和灯盏花素+MSCs组均明显低于模型组(P均<0.05),灯盏花素+MSCs组p-Akt/Akt、Snail1表达量明显低于灯盏花素组和MSCs组(P均<0.05),灯盏花素组和灯盏花素+MSCs组Galectin-3表达量明显低于MSCs组(P均<0.05)。见图5。

图5 正常组和慢性肾脏病各组大鼠肾脏组织中p-Akt、α-SMA、Snail1和Galectin-3蛋白表达情况
3 讨 论
灯盏花素主要用于心脑血管疾病的治疗,尤其在高血压诱导性肾病中和抗高血压类药物联用能明显降低24 h尿蛋白,显著改善肾功能[4],但也有文献报道灯盏花素在高剂量时不仅不能起到降压作用反而有升压作用[11]。Mei等[12]报道,在经典的单侧输尿管结扎模型中,灯盏花素可通过抑制肾脏对水钠转运蛋白的下调起到肾脏保护作用。Liu等[13]研究发现,灯盏花素可以通过抑制巨噬细胞募集、减轻氧化应激以及调节血脂异常而降低尿蛋白,改善肾功能。本实验结果显示,实验结束后,灯盏花素组24 h 尿蛋白、血清Cr和BUN水平、肾脏指数及肾脏组织中ColIA1阳性标记面积累计光密度IOD值、α-SMA表达量均明显低于模型组,MMP-9阳性标记面积累计光密度IOD值明显高于模型组。提示灯盏花素单独应用可改善肾功能,能减少肾脏组织胶原成分ColIA1和肌成纤维细胞标志物α-SMA表达,可增加具有降解肾小管间质中细胞外基质作用的MMP-9表达,证明其有一定程度的抗纤维化作用。
Galectin-3是一种IgE、层黏连结合蛋白,对β-半乳糖苷有高亲和力,通过碳水化合物识别结构域的N-连接或O-连接的糖基化作用与β-半乳糖苷糖结合[14]。Galectin-3在胞外涉及细胞-细胞和细胞-细胞外基质黏附,细胞生长和分化,细胞凋亡和血管生成等功能;在细胞核中作为前mRNA剪接因子,参与急性炎症反应,包括中性粒细胞活化和黏附、单核细胞巨噬细胞的化学吸引、凋亡中性粒细胞的调理素作用、肥大细胞的活化[15]。现已经证实Galectin-3独特表达于心、肾、血管等器官以及巨噬细胞、上皮细胞、成纤维细胞、肿瘤细胞等细胞[16],其由肾、肝和心脏纤维化中活化的肌成纤维细胞分泌,且其血清水平的上升早于CKD的发生,已被提出作为评价肾脏纤维化进程以及心、肝纤维化进程新的生物学标志物[17]。本实验结果显示,模型组肾脏组织中Galectin-3表达量明显高于正常组,灯盏花素组、MSCs组和灯盏花素+MSCs组均明显低于模型组,灯盏花素组和灯盏花素+MSCs组Galectin-3表达量有明显低于MSCs组的趋势。提示灯盏花素抑制CKD后肾脏组织Galectin-3表达可能是其发挥抗纤维化作用的重要原因,MSCs单独应用虽也能减少Galectin-3表达,但抑制作用不如单用灯盏花素,这可能和MSCs自身能分泌Galectin-3有关[18]。
根据现有文献和Galectin-3功能推测,Galectin-3的促纤维化机制可能与整合素家族某些成员发生作用,一方面影响了Integrin/ILK的表达,进一步激活Akt或者GSK-3β磷酸化,使下游促纤转录因子Snail、Twist等下调,激活EMT[19-20];另一方面Integrin家族成员可能和TIMP家族成员发生作用,影响了MMPs家族成员活性,导致细胞外基质(ECM)生成和降解失衡,ECM表达增加,促进了纤维化进程。因此检测上述重点指标,结果显示模型组肾脏组织中p-Akt/Akt、Snail1表达量均明显高于正常组,灯盏花素组、MSCs组和灯盏花素+MSCs组均明显低于模型组,灯盏花素+MSCs组p-Akt/Akt、Snail1表达量明显低于灯盏花素组和MSCs组。提示灯盏花素可抑制肾脏组织Akt磷酸化,下调Snial1表达,部分说明灯盏花素可能通过Galectin-3/Akt/Snail信号通路发挥抗纤维化作用。同时MSCs可以抑制Akt磷酸化及Snial1表达而产生抗纤维化效果,在和灯盏花素联合应用时,抑制效果更明显。
综上所述,活血化瘀类中药灯盏花素和MSCs可能通过调控Galectin-3/Akt/Snail通路协同发挥更好的抗CKD肾脏纤维化作用,为临床治疗各类慢性肾病纤维化提供了新的思路,但二者抗纤维化机制还需要进一步深入研究探讨。
利益冲突:所有作者均声明不存在利益冲突。
