沉默RhoA基因对腺样囊性癌细胞迁移和侵袭的影响
2022-02-21迟增鹏周建华李文健王莹徐晓妹陈正岗
迟增鹏, 周建华, 李文健, 王莹, 徐晓妹, 陈正岗
1. 潍坊医学院口腔医学院,山东 潍坊(261021); 2. 青岛大学附属青岛市市立医院口腔医学中心,山东 青岛(266071); 3. 大连医科大学口腔医学院,辽宁 大连(116044); 4. 济南市第四人民医院口腔科,山东 济南(250031); 5.青岛大学附属青岛市市立医院肿瘤科,山东 青岛(266071)
唾液腺腺样囊性癌(salivary adenoid cystic car⁃cinoma,SACC)是唾液腺恶性肿瘤之一,占唾液腺肿瘤的10%[1⁃2]。SACC 具有生长缓慢、复发率高、嗜神经侵袭、易远处转移及能在周围正常组织中检测出癌细胞浸润等特性。目前,临床上对SACC 的治疗方式是手术切除、术后辅以放化疗的综合疗法,但治疗效果不佳[3]。因此,探寻新的靶向治疗方法对SACC 的治疗具有重要意义。RhoA 蛋白是Ras 超家族蛋白中RhoGTP 酶亚家族的成员,其在细胞内可通过鸟嘌呤核苷酸交换因子(guanine nucleotide⁃ex⁃change factor,GEF)的催化作用下由不活跃结合态形式转换为可调控细胞信号通路的活跃结合态形式[4⁃5]。近年来研究证实,RhoA 可介导下游靶点调控多种肿瘤细胞的增殖、侵袭和迁移等过程,与肿瘤发生、发展关系密切[4,6],但关于RhoA 与SACC在迁移和侵袭等恶性进展方面的研究仍然较少。本研究通过小干扰RNA 技术对高侵袭性腺样囊性癌SACC⁃LM 细胞和低侵袭性腺样囊性癌SACC⁃83细胞的RhoA 基因进行体外沉默,观察RhoA 基因对腺样囊性癌SACC⁃LM 和SACC⁃83 细胞迁移和侵袭能力的影响,为SACC 分子靶向治疗的研究提供研究基础。
1 材料和方法
1.1 主要材料和试剂
20 例SACC 及正常癌旁组织源于青岛大学附属青岛市市立医院口腔颌面外科接受手术治疗的SACC 患者的标本。人腺样囊性癌细胞株SACC⁃LM 和SACC⁃83(由青岛大学附属医院口腔科提供)。
青霉素、链霉素(Gibco 公司,美国),DMSO(Amersco 公司,美国),胎牛血清(BI 公司,以色列),RNA 提取试剂盒、反转录试剂盒、TB Green Premix Ex TadTM试剂盒(Takara 公司,日本),RPMI⁃1640 培养基(Gibco 公司,美国),riboFectTMCP 转染试剂(广州市生物科技有限公司,中国),小干扰RNA 片段构建与生成、实时定量PCR 引物RhoA、引物GAPDH 合成(上海生工生物工程有限公司,中国)。兔抗人多克隆RhoA 抗体、E⁃钙黏蛋白(E⁃cadherin)抗体、N⁃钙黏蛋白(N⁃cadherin)抗体、波形蛋白(Vimentin)抗体、GAPDH 抗体(CST 公司,美国),羊抗兔IgG 二抗(Santa Cruz 公司,美国),胰蛋白酶(Gibco 公司,美国),RIPA 裂解液(雅酶生物医药科技有限公司,中国),蛋白酶抑制剂PMSF、磷酸酶抑制剂、BCA 蛋白浓度测定试剂盒、SDS⁃PAGE配胶试剂盒(上海碧云天生物技术有限公司,中国),Transwell 小室(Corning 公司,美国),微量移液器(Eppendorf 公司,德国),CO2恒温培养箱(Ther⁃mo Forma 311,Thermo Forma 公司,美国),酶标仪(FC,Thermo Forma 公司,美国),低温高速离心机(Megafuge 1.0R,Heraeus 公司,德国),倒置相差显微镜(CKX53,Olympus 公司,日本),高速台式离心机(PrimoR,Heraeus 公司,德国),实时荧光聚合酶链反应仪(7900HT,ABI 公司,美国),流式细胞仪(CytoFLEX Beckman Coulter 公司,美国)。
1.2 方法
1.2.1 SACC 及正常癌旁组织匀浆制备 本研究通过青岛大学附属青岛市市立医院医学伦理委员会审查批准(审批号:2021 临审字第088 号)。
将液氮冻存的20 例SACC 及正常癌旁组织研磨匀浆,分别提取总RNA 和总蛋白,待qRT⁃PCR 及Western blot 检测RhoA 的表达情况。
1.2.2 细胞培养 将SACC⁃LM 和SACC⁃83 细胞接种于T25 培养瓶中,加入含10%胎牛血清、1%青霉素和链霉素的5 mL RPMI⁃1640 完全培养基并置于恒温培养箱中进行培养。待贴壁细胞长至约80%~90%后,弃原培养基,PBS 冲洗,加入1.5 mL胰蛋白酶于37 ℃环境下消化3~5 min 成细胞悬液,吸取双倍量的完全培养基终止消化,并最终以1∶4 比例传代。
1.2.3 siRNA 转染效率测定及分组 分别将处于对数生长期的SACC⁃LM 和SACC⁃83 细胞以密度为2 × 105个/孔接种于6 孔板内,待细胞密度达铺板面积的1/3~1/2 时进行转染。根据说明书在1.5 mL EP 管中加入120 μL riboFECTTMCP Buffer和5 μL 20 μmol/L 荧光基团Cy3 标记的siRNA 储存液,吹打混匀后加入12 μL riboFECTTMCP Re⁃agent。室温条件下孵育0~15 min,加入到1 863 μL无双抗完全培养基中,使转染时siRNA 终浓度为50 nmol/L。于荧光显微镜下明确RhoA⁃siRNA 转染SACC 细胞系48 h 后的转染效率。根据RhoA 基因序列构建2 条小分子干扰RNA(RhoA⁃siRNA)和1条阴性序列作为对照(表1)。实验分组为实验组(转染RhoA⁃siRNA 基因)、阴性对照组(转染NC⁃siRNA 基因)和空白对照组,各组细胞转染后继续培养,完成后续实验。
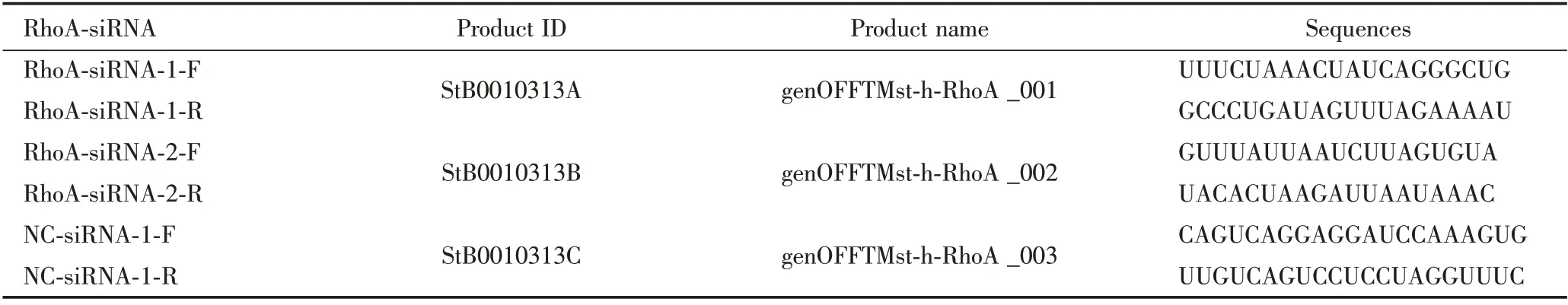
表1 RhoA siRNA 干扰序列和阴性对照序列Table 1 RhoA siRNA interference sequences and negative control sequences
1.2.4 RhoA⁃siRNA 沉默RhoA 基因 分别向6 孔板中加入处于对数生长期的SACC⁃LM 和SACC⁃83 细胞,密度为2 × 105个/孔,待细胞密度达铺板面积的1/3~1/2 时进行转染。参考试剂盒操作说明书,同上述制备的步骤,使小分子RNA 最终浓度为50 nmol/L。将制备好的转染复合物加入相应6 孔板内(每个孔的终末体积均为2 mL),混匀以后继续于孵育箱中培养。转染48 h 后进行后续实验的检测。
1.2.5 qRT⁃PCR 检测RhoA mRNA 表达 按照试剂盒说明书分别提取组织匀浆及各转染组细胞的总RNA 并用紫外分光光度计检测所提RNA 的浓度和纯度。
取适量RNA 反转录为cDNA,每组取2 μL cD⁃NA 进行实时定量PCR 实验,每组设3 个副孔。RhoA 上游引物序列:5’⁃TTCCATCGACAGCCCT⁃GATAGTTTA⁃3’,下游引物序列:5’⁃CACGTT⁃GGGACAGAAATGCTTG⁃3’;内参GAPDH 上游引物序列:5’⁃GCACCGTCAAGGCTGAGAAC⁃3’,下游引物序列:5’⁃TGGTGAAGACGCCAGTGGA⁃3’。PCR反应体系的配置及反应参数等均按TB Green Premix Ex TadTM Ⅱ试剂盒说明书进行。反应结束后,采用2⁃△△Ct计算腺样囊性癌和正常癌旁组织中RhoA mRNA 的表达,并依据实验组中RhoA mRNA 的相对定量结果选取沉默效率最高组进行后续实验的研究,实验重复3 次。
1.2.6 Western blot 检测蛋白表达 使用RIPA 裂解液裂解组织匀浆中组织细胞及各转染组细胞,分别提取总蛋白。应用BCA试剂盒进行蛋白浓度测定后制备分离胶和浓缩胶,蛋白上样量每孔约15~20 μL,蛋白Marker 3 μL。然后采用湿转法将蛋白转至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上,5%脱脂牛奶室温摇床封闭PVDF 膜1 h 后加入一抗(RhoA,1∶5 000;E⁃cadherin,1∶1 000;N⁃cadherin,1∶1 000;Vimentin,1∶1 000;GAPDH,1∶5 000),4 ℃孵育过夜。弃一抗,TBST 稀释二抗(1∶50 000),使PVDF 膜浸泡其中,室温摇床孵育2 h。然后充分洗涤PVDF 膜5 次,5 min/次。后滴加工作液于PVDF 膜上,反应数分钟待荧光带明显后,用滤纸吸去多余的底物液,覆上保鲜膜,X 线胶片压片后依次放入显影液显影、定影液定影,冲洗胶片,Im⁃age J(Image J 1.51j8,National Institute of Mental Health,美国)软件分析结果,实验重复3 次。
1.2.7 细胞划痕实验 用血球计数板调整转染48 h后各组细胞的细胞密度,使细胞隔天达到6 孔板面积的90%。将紫外线灭菌的直尺与孔板底部横线垂直,用200 μL 移液枪枪头尖端在6 孔板底部沿直尺垂直划线。PBS 冲洗2~3 次去除划下的细胞,加入无血清培养基,于0、24 h 拍照测定并用Image J 软件分析,结果取均值。实验重复3 次。
1.2.8 细胞侵袭实验 将已铺好基质胶的Tran⁃swell 小室置于24 孔板,上室与下室分别加入500 μL 无血清培养基,37 ℃培养箱水化2 h。向转染后的细胞悬液内加入无血清培养基,使细胞密度为2 × 105个/mL,Transwell 上室加入200 μL 含细胞的无血清培养基,上室下方加入650 μL 培养基(含10%胎牛血清),培养48 h 后去除上室残留的细胞,置于甲醛溶液中浸泡15~20 min,后在500 μL 含0.1%的甲紫溶液中浸泡15 min 并用蒸馏水清洗,置显微镜下观察拍照,随机选取5 个不同视野计数穿膜细胞数,取均值,每组重复3 次。
1.3 统计学分析
采用SPSS 25.0 对实验结果进行统计分析。计量资料的组间比较用t检验,多组间比较用单因素方差分析,以P<0.05 为差异有统计学意义。
2 结 果
2.1 RhoA 在正常癌旁及SACC 组织中的表达
Western blot 结果显示,与正常癌旁组织相比,RhoA 蛋白表达量在SACC 组织中的表达增高,差异具有统计学意义(t=61.92,P<0.001);qRT⁃PCR检测结果显示:与正常癌旁组织相比,RhoA 的mRNA 表达水平在SACC 组织中的表达增高,差异具有统计学意义(t=16.72,P<0.01)(图1)。
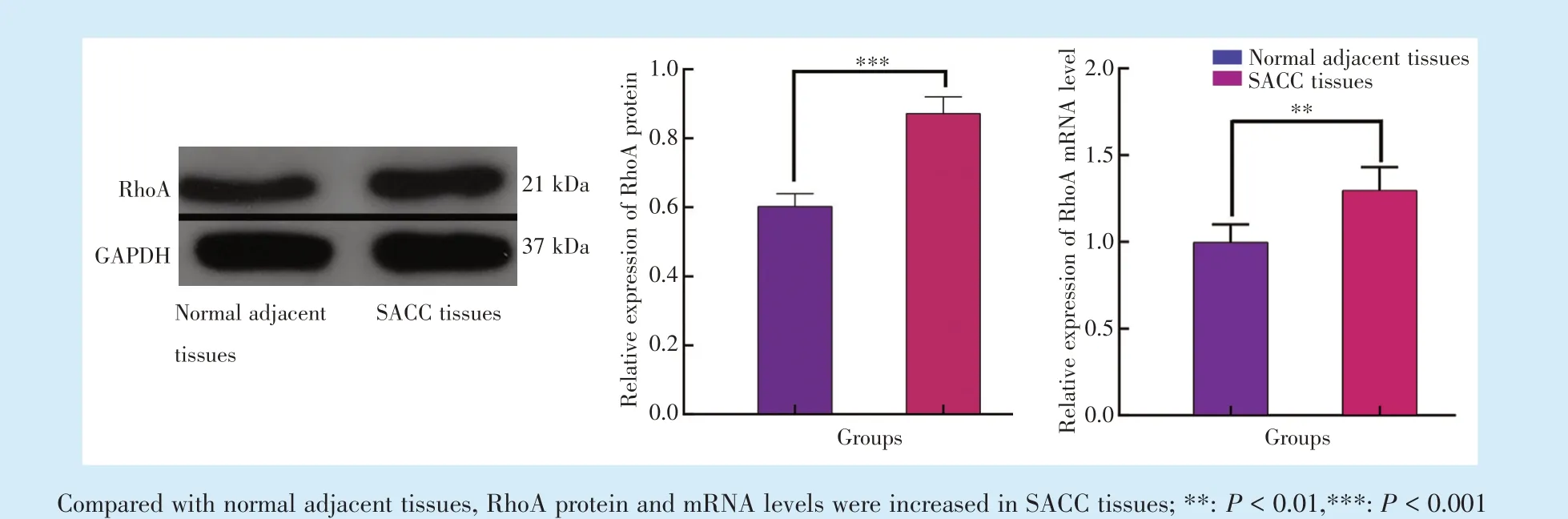
Figure 1 Expression of RhoA in normal adjacent tissues and SACC tissues图1 RhoA 在正常癌旁及SACC 组织中的表达
2.2 siRNA 转染效率
脂质体瞬时转染2 d 后,倒置荧光显微镜下可发现超过90%以上的腺样囊性癌SACC⁃LM 和SACC⁃83 细胞都有红色荧光应答,表明细胞体外转染RhoA⁃siRNA 成功(图2)。
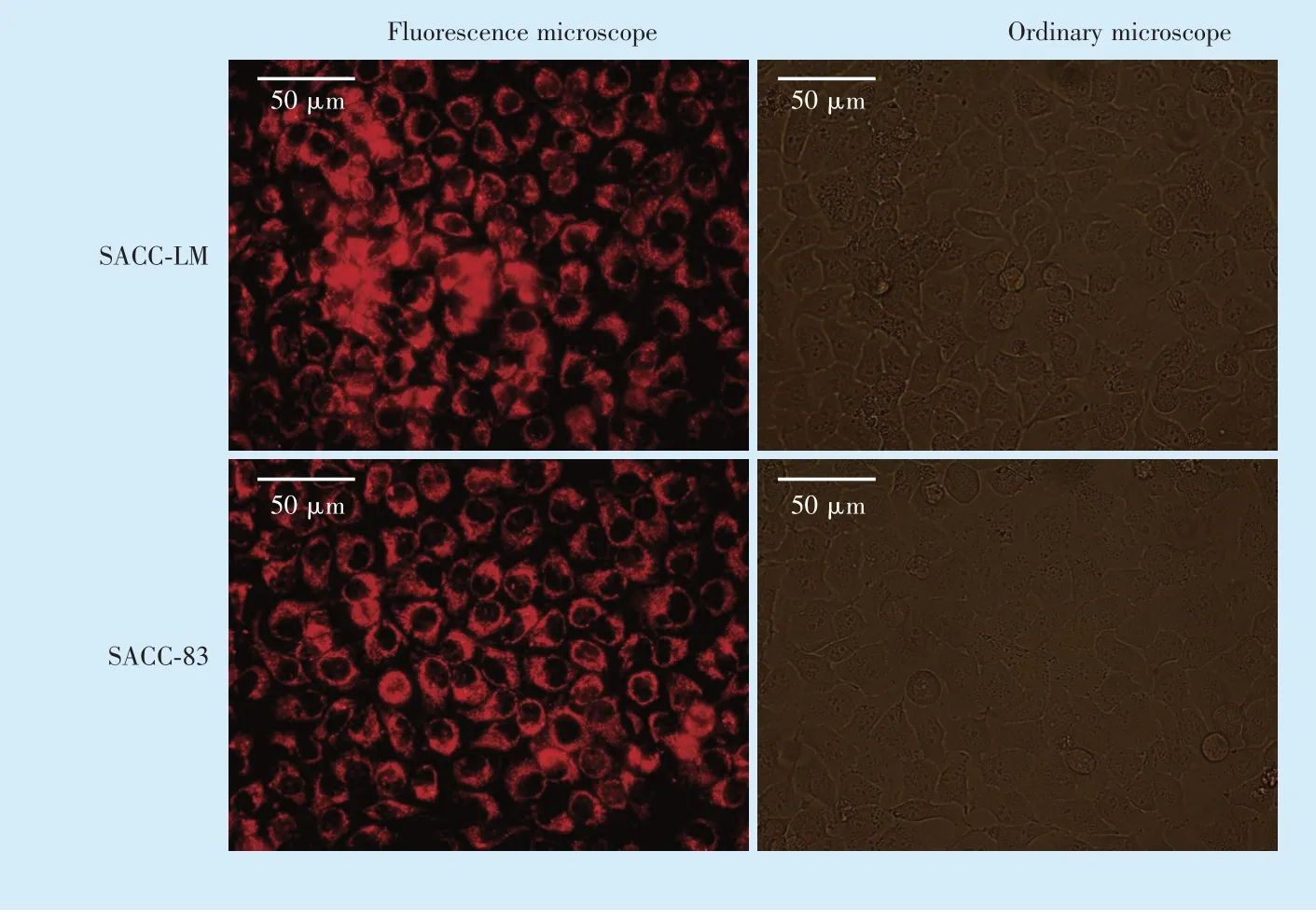
Figure 2 siRNA transfection efficiency图2 siRNA 转染效率
2.3 转染RhoA⁃siRNA 后RhoA 的mRNA 表达水平
qRT⁃PCR 检测结果显示(图3),与SACC⁃LM 细胞相比,SACC⁃83 细胞中RhoA 的mRNA 表达水平低,差异具有统计学意义(t=27.06,P<0.01)。
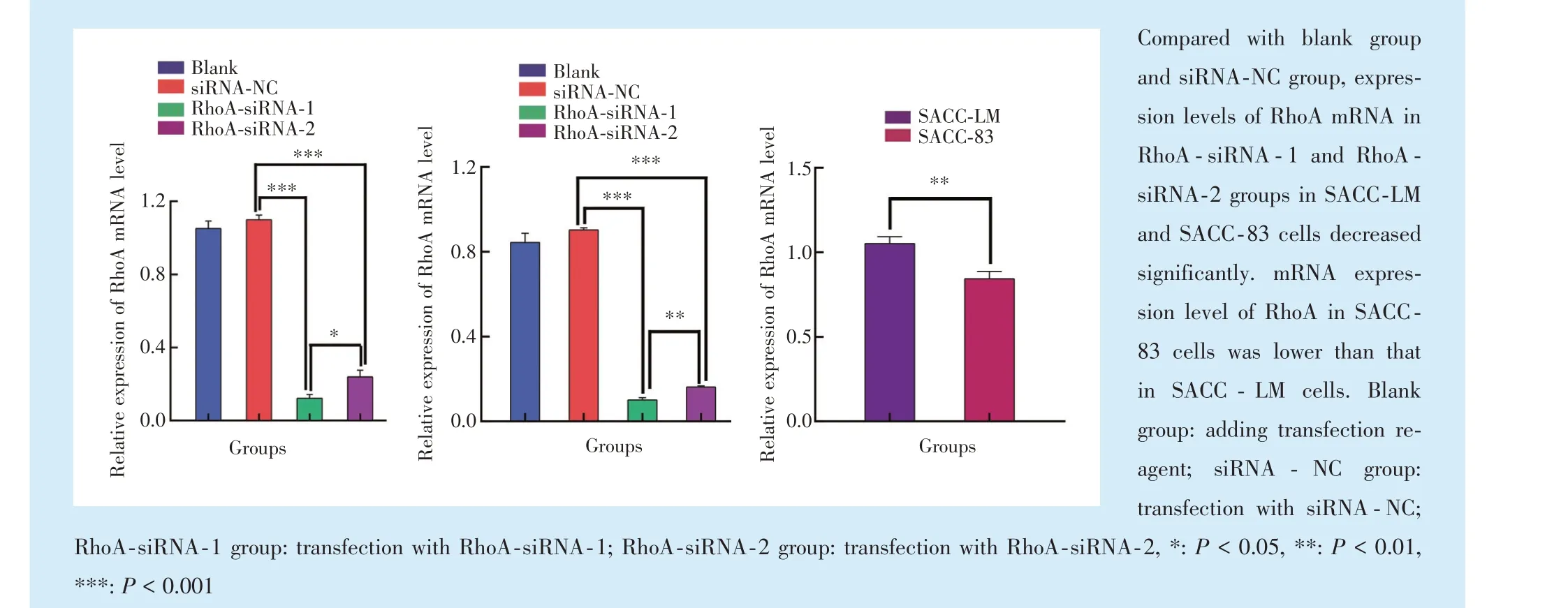
Figure 3 Expression of RhoA mRNA after RhoA⁃siRNA transfection图3 转染RhoA⁃siRNA 后RhoA mRNA 的表达
转染RhoA⁃siRNA 后,相较于空白对照组和siRNA⁃NC 组,SACC⁃LM 细胞、SACC⁃83 细胞实验组RhoA⁃siRNA⁃2 组、RhoA⁃siRNA⁃1 组RhoA mRNA 表达水平均显著下降,差异具有统计学意义(FLM=835.0,F83=3232.0,P< 0.01)。各个实验组间RhoA mRNA 表达比较,以RhoA⁃siRNA⁃1 组的沉默效率最高,选择RhoA⁃siRNA⁃1 组作为实验组干扰序列siRNA 进一步研究。
2.4 转染RhoA⁃siRNA 后RhoA 的蛋白表达水平
Western blot 结果显示(图4),与SACC⁃LM 细胞相比,SACC⁃83 细胞中RhoA 蛋白表达水平低,差异具有统计学意义(t=29.73,P<0.01)。
转染RhoA⁃siRNA 后,相较于空白对照组、siR⁃NA⁃NC 组,SACC⁃LM 细胞、SACC⁃83 细胞实验组RhoA、N⁃cadherin、Vimentin 表达量降低,E⁃cadherin表达量增加,差异具有统计学意义(FLM⁃RhoA=126.4,FLM⁃E⁃cadherin=266.4,FLM⁃N⁃cadherin=130.6,FLM⁃Vimentin=562.5,P< 0.01;F83⁃RhoA=240.1,F83⁃E⁃cadherin=266.9,F83⁃N⁃cadherin=484.3,F83⁃Vimentin=690.3,P<0.01)(图4)。
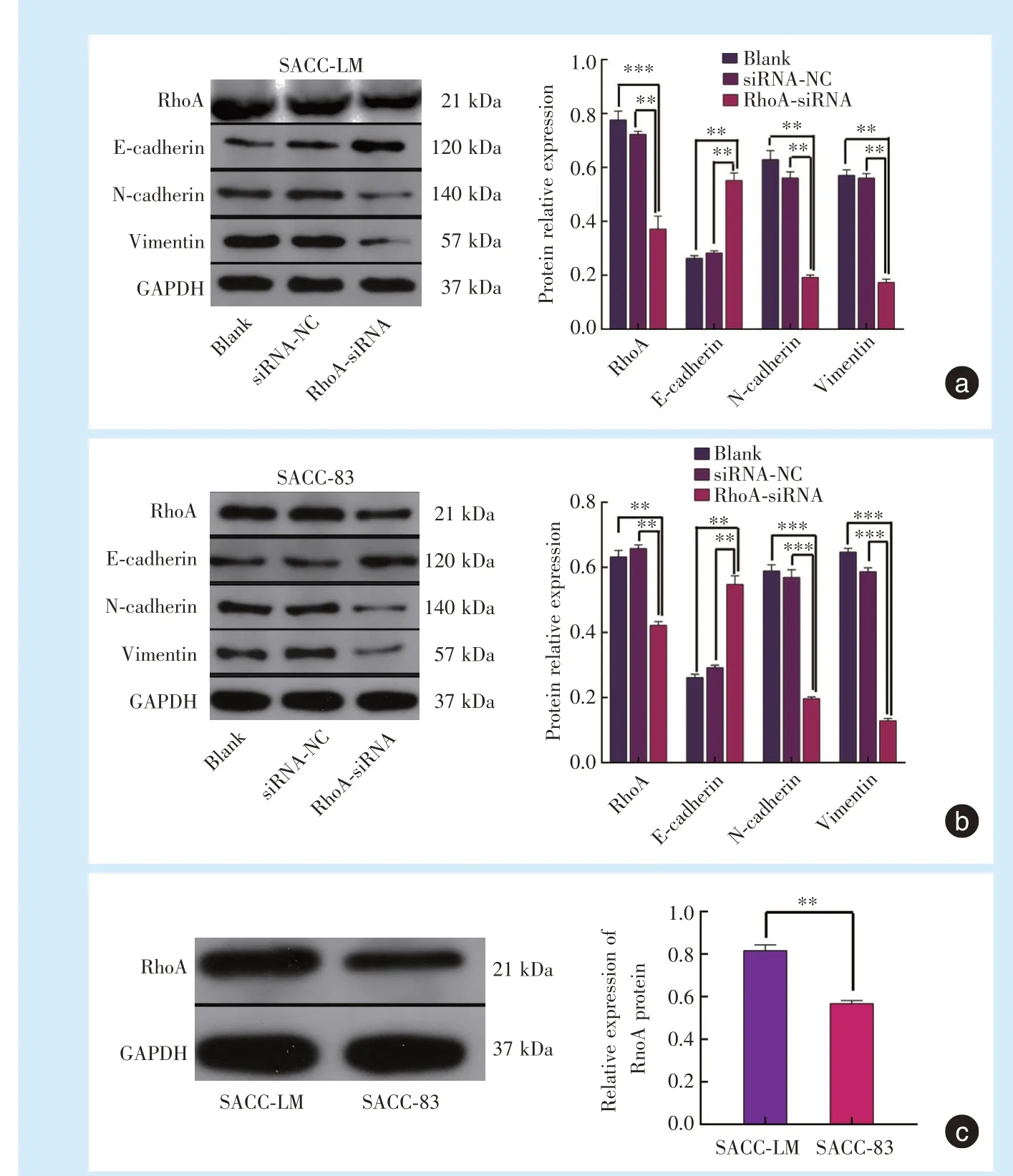
Figure 4 Expression of proteins after RhoA⁃siRNA transfection in SACC⁃LM and SACC⁃83 cells图4 转染RhoA⁃siRNA后SACC⁃LM 和SACC⁃83 细胞的蛋白表达水平
2.5 RhoA⁃siRNA 对细胞迁移能力的影响
观察0 h 和24 h 的划痕愈合情况显示,SACC⁃LM 细胞(F=611.8,P< 0.01)、SACC⁃83 细胞(F=138.8,P<0.01)实验组未愈合面积明显大于siRNA⁃NC 组、空白对照组,细胞的迁移能力显著降低,差异具有统计学意义(图5)。
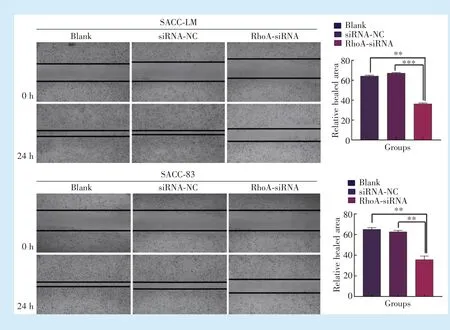
Figure 5 Results of scratch test of SACC⁃LM and SACC⁃83 cells图5 SACC⁃LM、SACC⁃83 细胞的划痕实验结果
2.6 RhoA⁃siRNA 对细胞侵袭能力的影响
Transwell 实验显示,SACC⁃LM 细胞(F=294.9,P< 0.01)、SACC⁃83 细胞(F=1 577.0,P< 0.01)实验组细胞的侵袭能力较对照组降低,差异具有统计学意义(P<0.01)(图6)。

Figure 6 Transwell invasion assay results of SACC⁃LM and SACC⁃83 cells图6 SACC⁃LM、SACC⁃83 细胞的Transwell 侵袭实验结果
3 讨 论
作为好发于唾液腺的恶性肿瘤,SACC 发病不易被发现且常伴有远处转移[7]。研究表明,SACC患者经过手术切除和放、化疗治疗后,整体复发率仍高达约50%,发生远处转移率约为31%,预后效果目前尚不理想[8]。
RhoA 是存在于细胞内的一种中间信号分子,其作为Rho 亚家族的一种异构体是目前研究较多的与癌症相关的基因[5,9]。Jansen 等[4]认为,RhoA在肺癌、胰腺癌、直肠癌等多种预后较差的肿瘤细胞中过度表达,并与其侵袭和迁移活动关联性强。而在本实验中,RhoA 在SACC 组织中也表达增高,提示RhoA 在SACC 的发生发展中可能同样起重要作用。
本实验将RhoA⁃siRNA 转染至SACC⁃LM 和SACC⁃83 细胞中对RhoA 基因进行沉默,降低了RhoA 蛋白的表达。Transwell 侵袭实验和细胞划痕实验检测结果显示SACC 细胞的迁移和侵袭能力降低,表明沉默RhoA 基因可通过影响RhoA 蛋白的表达来调控SACC 细胞的迁移和侵袭能力,表明RhoA 基因与其迁移和侵袭活动成正相关。
肿瘤的迁移和侵袭是一个极为复杂的过程,受肿瘤细胞迁移能力、上皮⁃间充质转换(epithelial⁃mesenchymal transition,EMT)水平等多种因素的影响[10]。EMT 是细胞从上皮表型退化并逐渐向间充质表型过渡转化的过程[11],被认为是肿瘤发生迁移和侵袭的早期标志事件,使肿瘤细胞的恶性程度显著增加[12]。当肿瘤细胞通过EMT 获得迁移侵袭能力时,其上皮表型标志E⁃cadherin 蛋白表达降低,间充质表型标志N⁃cadherin 和vimentin 蛋白表达升高,细胞彼此间的紧密连接程度降低,迁移和侵袭能力增强[13]。E⁃cadherin 存在于被覆上皮和腺上皮中,其在正常细胞的胞浆中生成后,逐渐从细胞膜定位于粘附带上并稳定表达,使细胞之间紧密粘附[14]。E⁃cadherin 可通过调控钙依赖性跨膜糖蛋白对粘附功能、细胞极性及细胞间连接诱导和维持起重要的作用[15⁃16]。研究表明,E⁃cad⁃herin 在肿瘤细胞内低于正常水平时,可使细胞不受限制而增殖过度,且使细胞连接不紧密而极易发生远处扩散和转移[17]。Vimentin 是一个有着中央α 螺旋结构域的蛋白,可通过调控细胞与细胞之间的黏附及迁移来发挥其生物学功能[18]。研究表明,Vimentin 在胆管癌、乳腺癌等多种上皮源性肿瘤中均过度表达,与肿瘤的迁移和侵袭活动呈正相关[19⁃20]。N⁃cadherin 集中定位于皮肤、肠道、肺、血管和肌肉内部等间质组织中,当上游信号分子激活EMT 信号通路后,可诱导肿瘤上皮表型细胞的转化,促进肿瘤细胞的侵袭和迁移活动[21⁃23]。本研究结果表明,体外沉默RhoA 基因后,EMT 信号通路标志蛋白N⁃cadherin、Vimentin 表达降低,E⁃cadherin 表达增高,提示沉默RhoA 可有效抑制腺样囊性癌SACC⁃LM 和SACC⁃83 细胞的EMT 过程。
综上所述,RhoA 基因与腺样囊性癌SACC 细胞迁移、侵袭活动关系密切,应用小分子干扰RNA 可有效影响SACC 细胞中RhoA 及EMT 信号通路标志蛋白的表达,表明RhoA 可激活EMT 来介导其迁移和侵袭活动。由此推测RhoA⁃siRNA 在一定程度上可以靶向降低SACC⁃LM 和SACC⁃83 细胞的迁移和侵袭能力。本研究为治疗SACC 提供参考策略,也为靶向治疗SACC 提供新的分子位点,下一步将深入探究RhoA 基因影响SACC 细胞迁移和侵袭活动的具体机制,并结合体内实验加以验证,为SACC的靶向治疗提供依据。
【Author contributions】Chi ZP processed the research and wrote the article,Li WJ,Wang Y,Xu XM analyzed the data. Chen ZG,Zhou JH designed the study,reviewed the article. All authors read and approved the final manuscript as submitted.
