水蛭素对TGF-β1诱导的肺成纤维细胞增殖及转分化的影响研究
2022-02-20黄文杰刘理静
王 慧,贺 彬,黄文杰,刘理静,柯 灿,向 粤
(1. 湖南医药学院,湖南 怀化 418000;2. 长沙民政职业技术学院,湖南 长沙 410000)
肺纤维化是一种慢性弥漫性肺间质疾病,是多种慢性肺部疾病的最终结局,特发性肺纤维化是其中最常见、最严重的一种,确诊后的生存中位数仅为2.9年,5年生存率<50%[1]。除肺移植外,该病尚缺乏有效的治疗措施,然而供体来源匮乏,临床上主要采用糖皮质激素和免疫抑制剂或细胞毒药物进行治疗,但疗效均不佳。目前,获得批准上市的抗肺纤维化药物只有吡非尼酮和尼达尼布,但长期服用的有效性和安全性尚不明确[2]。肺纤维化的发生机制尚未完全阐明,其主要病理特征为肺成纤维细胞过度增殖转化和细胞外基质异常沉积[3]。生理情况下,肺成纤维细胞合成和分泌细胞外基质蛋白,修复损伤和保护肺泡正常生理活性[4]。当肺组织受损时,肺成纤维细胞增殖并分化为肌成纤维细胞,其分泌细胞外基质的能力是肺成纤维细胞的4~5倍,导致细胞外基质大量沉积,加速肺纤维化的进展[5],干预肺成纤维细胞的生物学行为可以有效防治肺纤维化[6]。因此,抑制肺成纤维细胞向肌成纤维细胞转化是抑制肺纤维化发生发展的重要途径。天然水蛭素是从吸血水蛭的唾液腺中分离出来的多肽,是迄今为止自然界最为强大的天然凝血酶抑制剂[7],具有抗凝、抗炎、抗肿瘤、抗风湿、促进皮瓣存活等生物学作用[8-10]。有研究发现水蛭素能抑制博莱霉素诱导的大鼠肺纤维化[11],但其机制仍未阐明。基于此,本研究采用转化生长因子β1(TGF-β1)诱导的小鼠胚肺成纤维细胞(NIH3T3)向肌成纤维细胞转化作为体外研究模型,通过检测水蛭素干预后肌成纤维细胞转化的相关标志物,探究了水蛭素抗肺纤维化的作用机制。
1 实验材料与方法
1.1材料 NIH3T3细胞由中南大学医学遗传学重点实验室惠赠。水蛭素购自广西科康科技集团有限公司(批号:20190901)、TGF-β1购自美国Peprotech公司、DMEM高糖培养基购自美国Hyclone公司;CCK-8试剂盒购自Biosharp公司;Trizol试剂购自艾科瑞生物,反转录试剂盒购自赛默飞公司,qRT-PCR所需引物由上海生工生物工程公司合成,SYBR Green Real Time PCR Master Mix购自Promega公司;α-平滑肌肌动蛋白(α-SMA)抗体购自Abcam,Ⅰ型胶原蛋白(Collagen Ⅰ)抗体购自武汉三鹰生物技术有限公司;Syngene Gnome XQR印迹扫描仪(英国Syngene 公司),PCR仪(美国Thermo 公司),荧光定量PCR仪(美国 Bio-Rad 公司),Varioskan LUX多功能微孔板读数仪(美国Thermo公司)。
1.2水蛭素溶液的配置 在无菌操作台内,取水蛭素冻干粉1瓶,用无血清DMEM高糖培养基溶解配成浓度为50 ATU/mL的母液,用0.22 μm的微孔过滤器过滤,使用时再用无血清DMEM高糖培养基稀释成所需要的浓度,现配现用。
1.3水蛭素浓度筛选 复苏NIH3T3,培养在含10% NBS和1%青霉素链霉素混合液的DMEM高糖培养基中,置于37 ℃、5% CO2的细胞培养箱中培养,0.25%胰酶消化传代。取对数生长期的NIH3T3细胞,将细胞按3 000个/孔接种到96孔板,待细胞融合度达到70%左右,用PBS洗2遍,将培养基血清含量降至2%饥饿12 h后,分别加入浓度为0.3 ATU/mL、0.6 ATU/mL、1.2 ATU/mL、2.4 ATU/mL、4.8 ATU/mL、9.6 ATU/mL水蛭素进行干预,每个浓度设置6个复孔,每孔100 μL,37 ℃培养箱孵育。孵育24 h后,弃去培养基,PBS洗1遍,移液枪吸净PBS后每孔加入200 μL CCK-8工作液(CCK-8原液∶培养基=1∶9),同时设置空白孔(只加 CCK-8,无细胞)。放入培养箱孵育1 h,在450 nm波长下测量各孔吸光值,计算各浓度下的抑制率。
1.4细胞分组及培养 取对数生长期的NIH3T3细胞,待细胞融合度达到70%左右分为6组处理,每组设6个复孔。空白对照组细胞常规培养,水蛭素组细胞加入4.8 ATU/mL水蛭素培养,TGF-β1组细胞加入10 ng/mL TGF-β1培养,TGF-β1+水蛭素1.2 ATU/mL组、TGF-β1+水蛭素2.4 ATU/mL组、TGF-β1+水蛭素4.8 ATU/mL组分别加入相应浓度水蛭素后30 min再加入10 ng/mL TGF-β1培养。
1.5细胞活力检测 按照1.3中方法检测空白对照组、水蛭素组、TGF-β1组、TGF-β1+水蛭素1.2 ATU/mL组、TGF-β1+水蛭素2.4 ATU/mL组、TGF-β1+水蛭素4.8 ATU/mL组细胞活力。
1.6细胞中α-SMA、Collagen I mRNA表达检测采用qRT-PCR法检测。实验分组同1.4,将对数生长期的NIH3T3细胞按6×104个/孔接种到6孔板,待细胞融合度达到70%左右,将血清浓度从10%降至2%,饥饿12 h。饥饿处理后换成新的2%血清浓度的培养基,每组按照1.4中方法给予相应处理后,在培养箱中继续培养24 h,弃掉上清,用冰PBS洗涤2遍。吸净PBS后每孔加入1 mL Trizol,室温放置10 min,反复吹打培养板,尽量少残留细胞于壁上,将孔板中的Trizol转移至新的无酶EP管中,加入等量的异丙醇沉淀,乙醇洗除杂质,加入30 μL DEPC水轻柔混匀,用紫外分光光度计对每个样本总RNA的浓度、纯度进行测定,取RNA 2 μL,按照反转录试剂盒提供的步骤合成cDNA。取10 μL cDNA进行PCR反应,以β-actin为内参,计算相对表达量。以上实验重复3次。α-SMA引物序列:上游为5’-TGGCTATTCAGGCTGTGCTGTC-3’,下游为5’-CAATCTCACGC TCGGCAGTAGT-3’;Collagen I 引物序列:上游为5’-GAGCGGAGAGTACTGGATCG-3’,下游为5’-GCTTCTTTTCCTTGGGGTTC-3’;β-actin引物序列:上游为5’-GGCTGTATTCCCCTCCAT-3’,下游为5’-CCAGTTGGTAACAATGCCATGT-3’。
1.7细胞中α-SMA、Collagen I蛋白表达检测 采用Western blot法检测。细胞培养方法与分组同mRNA表达检测,培养24 h后将细胞用冰PBS洗2遍,吸净PBS,每孔加入100 μL含1%蛋白酶、磷酸酶抑制剂的RIPA裂解液,冰上裂解30 min,裂解完毕用细胞刮将壁上的细胞刮下转移至新的EP管中。使用BCA蛋白定量试剂盒测定蛋白浓度,加入等体积5%巯基乙醇的2×loading buffer,放入100 ℃金属蛋白浴中15 min使蛋白变性。制备10% SDS-聚丙烯酰胺凝胶,取30 μg蛋白上样,电泳并转膜,5%脱脂牛奶封闭2 h后分别加入稀释的山羊抗兔Collagen Ⅰ、α-SMA (1∶1 000),4 ℃孵育过夜;TBST洗膜3次,加入稀释后的二抗(1∶5 000),室温孵育1 h;用化学发光法进行显色和曝光,使用Image J软件分析得出目的蛋白灰度值(A),目的蛋白表达水平=A目的蛋白/内参GAPDH。以上实验重复3次。
1.8统计学方法 采用Graph Pad Prism 5.0软件进行统计学分析,实验结果组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1不同浓度水蛭素对NIH3T3细胞活力的影响0.3 ATU/mL、0.6 ATU/mL、1.2 ATU/ml、2.4 ATU/mL、4.8 ATU/mL水蛭素对NIH3T3细胞活力无影响,9.6 ATU/mL水蛭素显著降低了细胞活力(见图1),因此选择浓度为1.2 ATU/mL、2.4 ATU/mL、4.8 ATU/mL水蛭素进行后续实验。

图1 不同浓度水蛭素对NIH3T3细胞活力的影响
2.2各组NIH3T3细胞活力比较 空白对照组与水蛭素组NIH3T3细胞活力比较差异无统计学意义(P>0.05);TGF-β1组NIH3T3细胞活力明显高于空白对照组(P<0.05);TGF-β1+水蛭素2.4 ATU/mL组、TGF-β1+水蛭素4.8 ATU/mL组NIH3T3细胞活力均明显低于TGF-β1组(P均<0.05)。见图2。
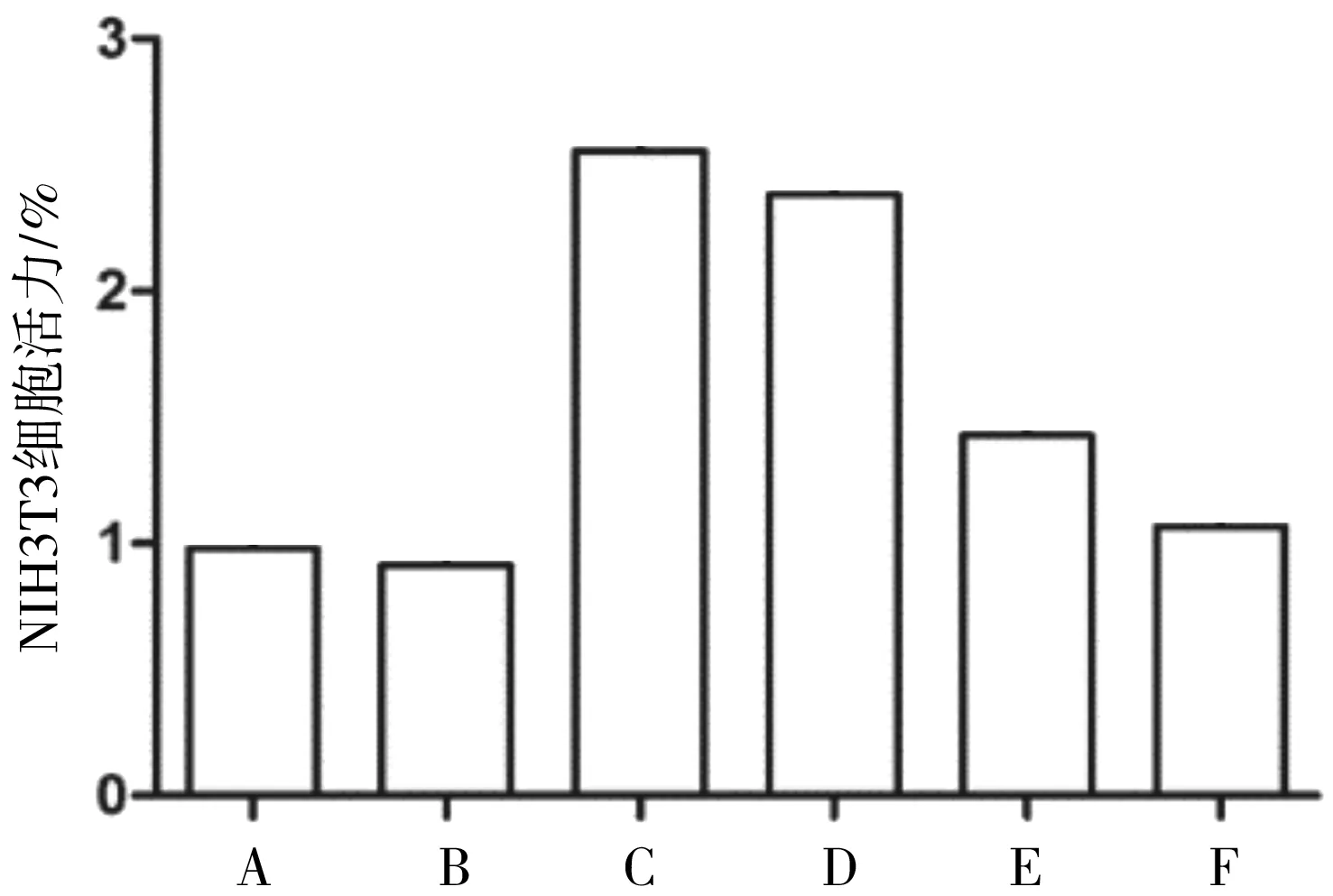
A为空白对照组;B为水蛭素组;C为TGF-β1组;D为TGF-β1+水蛭素1.2 ATU/mL组;E为TGF-β1+水蛭素2.4 ATU/mL组;F为TGF-β1+水蛭素4.8 ATU/ mL组
2.3各组 NIH3T3 细胞中Collagen I、α-SMA mRNA及蛋白表达情况 空白对照组与水蛭素组Collagen I、α-SMA mRNA 及蛋白相对表达量比较差异均无统计学意义(P均>0.05);TGF-β1组Collagen I、α-SMA mRNA及蛋白相对表达量均明显高于空白对照组(P均<0.05);TGF-β1+水蛭素2.4 ATU/mL组、TGF-β1+水蛭素4.8 ATU/mL组Collagen I、α-SMA mRNA及蛋白相对表达量均明显低于TGF-β1组(P均<0.05)。见图3及图4。

A为空白对照组;B为水蛭素组;C为TGF-β1组;D为TGF-β1+水蛭素1.2 ATU/mL组;E为TGF-β1+水蛭素2.4 ATU/mL组;F为TGF-β1+水蛭素4.8 ATU/mL组图3 各组 NIH3T3 细胞中Collagen I、α-SMA mRNA 表达情况

A为空白对照组;B为水蛭素组;C为TGF-β1组;D为TGF-β1+水蛭素1.2 ATU/mL组;E为TGF-β1+水蛭素2.4 ATU/mL组;F为TGF-β1+水蛭素4.8 ATU/mL组图4 各组 NIH3T3 细胞中Collagen I、α-SMA蛋白表达情况
3 讨 论
肺纤维化早期表现为弥漫性肺炎,后期表现为成纤维细胞增生和细胞外基质过度沉积[12],临床表现为进行性呼吸困难并伴刺激性干咳,且随着病情进展,患者呼吸功能不断恶化,最终导致呼吸衰竭甚至死亡[13]。其发病机制复杂,目前临床上缺乏有效的治疗药物,因此迫切需要研发新药来预防肺纤维化的发生与发展。水蛭最早记载于《神农本草经》,具有破血化瘀、通络的功效[7],其制剂如脑血通胶囊、疏血通注射液常用于心脑血管疾病如脑梗死、冠心病的预防及辅助治疗[14],随着中医药研发技术的不断提升,水蛭的药用价值日益凸显。
特发性肺纤维化患者和博莱霉素诱导的肺纤维化动物体外研究模型有一个共同点,即肺组织中促纤维化因子表达升高,在这些因子中,TGF-β1处于最关键的地位,其能有效诱导成纤维细胞向基质迁移,促进成纤维细胞增殖并产生细胞外基质成分,形成肉芽组织,同时获得肌成纤维细胞表型,α-SMA表达升高,并通过 Smad 经典通络或非Smad经典通路等信号通路调控胶原基因转录,促进胶原蛋白的合成与分泌,造成过量的瘢痕组织聚集,导致肺纤维化的发生[15]。因此,本研究采用TGF-β1诱导肺成纤维细胞向肌成纤维细胞转化作为体外研究的模型,浓度与诱导时间参照文献[16],通过CCK-8实验筛选1.2 ATU/mL、2.4 ATU/mL、4.8 ATU/mL水蛭素用于后续研究,结果显示水蛭素可以抑制TGF-β1诱导的NIH3T3细胞增殖,尤其中、高浓度抑制作用更显著,表明水蛭素可以抑制TGF-β1诱导的肺成纤维细胞增殖。
正常情况下,细胞外基质的合成与分解处于动态平衡,有助于维持肺组织的正常结构与功能[17]。Collagen Ⅰ、Collagen Ⅲ是细胞外基质的主要组成成分,二者由肺成纤维细胞和转分化后的肌成纤维细胞合成,当肺组织受损时,肺成纤维细胞增殖并分化为肌成纤维细胞,产生过多的细胞外基质,并在肺间质内过度蓄积,造成肺实质广泛损伤和重塑,触发肺纤维化[18]。α-SMA是肺成纤维细胞转分化为肌成纤维细胞的标志,它分泌细胞外基质的能力比肺成纤维细胞高4~5倍。因此,细胞中Collagen I、Collagen Ⅲ、α-SMA mRNA及蛋白表达量能准确反映细胞外基质合成与分解代谢情况,评价肺纤维化的严重程度。本研究结果显示,2.4 ATU/mL、4.8 ATU/mL水蛭素可以明显降低TGF-β1诱导的肺成纤维细胞中Collagen I、α-SMA mRNA及蛋白表达量。提示水蛭素可通过减少细胞外基质的分泌,抑制TGF-β1诱导的肺成纤维细胞表型转化过程。既往研究发现抑制肺成纤维细胞向肌成纤维细胞表型转化能有效减轻肺纤维化[19-20],本研究与上述研究结果一致,证实水蛭素能够直接作用于肺成纤维细胞,抑制其向肌成纤维细胞转化。
综上所述,水蛭素可显著抑制TGF-β1诱导的 NIH3T3细胞增殖及TGF-β1诱导的Collagen I、α-SMA mRNA和蛋白表达增加,说明抑制肺成纤维细胞向肌成纤维细胞表型转化是水蛭素抗肺纤维化的机制之一。
(致谢:本实验在湖南医药学院生物实验研究中心和中南大学湘雅护理学院慢性病基础研究与健康管理实验室完成,感谢各位同事和老师的指导与帮助!)
利益冲突:所有作者均声明不存在利益冲突。
