Raney Ni催化生物基糠醛还原胺化合成糠胺
2022-02-20郭珊珊魏作君刘迎新
郭珊珊,陈 娜,魏作君,刘迎新*
(1.浙江工业大学 药学院,浙江 杭州 310014;2.浙江大学 化学工程与生物工程学院 生物质化工教育部重点实验室,浙江 杭州 310027)
胺在聚合物、染料、医药、农药和生物活性化合物的生产中起着重要作用[1],其中伯胺因其广泛的衍生性近年来引起了广泛关注[2]。众多合成伯胺的方法中,由于醛酮来源广泛,价格低廉,还原胺化法成为制备伯胺应用最多的方法之一。目前,研究人员已报道了多种均相和多相催化剂用于羰基化合物的还原胺化反应的催化合成策略。其中,均相催化剂在分离和再利用方面较困难,故开展多相催化剂的还原胺化是近年来研究的热点。
近年来,随着传统化石资源的日益枯竭,开发利用可再生的生物质能替代化石资源变得尤为重要[13]。其中生物质木糖脱水制得的糠醛作为一种重要的平台化合物,是胺化学可持续发展的理想选择[14]。目前,糠醛还原胺化制备糠胺已有较多报道。为提高糠胺选择性,研究者常常使用贵金属催化剂。Nishimura等[15]使用聚(N-乙烯基-2-吡咯烷酮)稳定的Ru负载羟基磷灰石(Ru-PVP/HAP)在100 ℃、0.25 MPa H2下进行糠醛的还原胺化,糠胺产率为60%。Deng等[16]通过微调Nb2O5的表面酸度,发现在300 ℃下还原的Ru/Nb2O5催化剂在70 ℃下表现出良好的催化性能,糠胺产率为89%。结果表明,酸性位点在糠醛的活化过程中起着重要作用,进而促进糠胺的形成。Chandra等通过将Ru纳米粒子负载在Ca(NH2)2上,酸处理后除去载体,制备了Ru-NP催化剂,在90 ℃、2 MPa H2下反应2 h,获得99%的糠胺产率。Chatterjee等[18]使用Rh/Al2O3作为催化剂,在80 ℃、2 MPa H2下反应2 h,糠胺的选择性为92%。Xin等[19]制备了Pd-NPs催化剂,在室温下还原胺化糠醛,糠胺产率为97%。
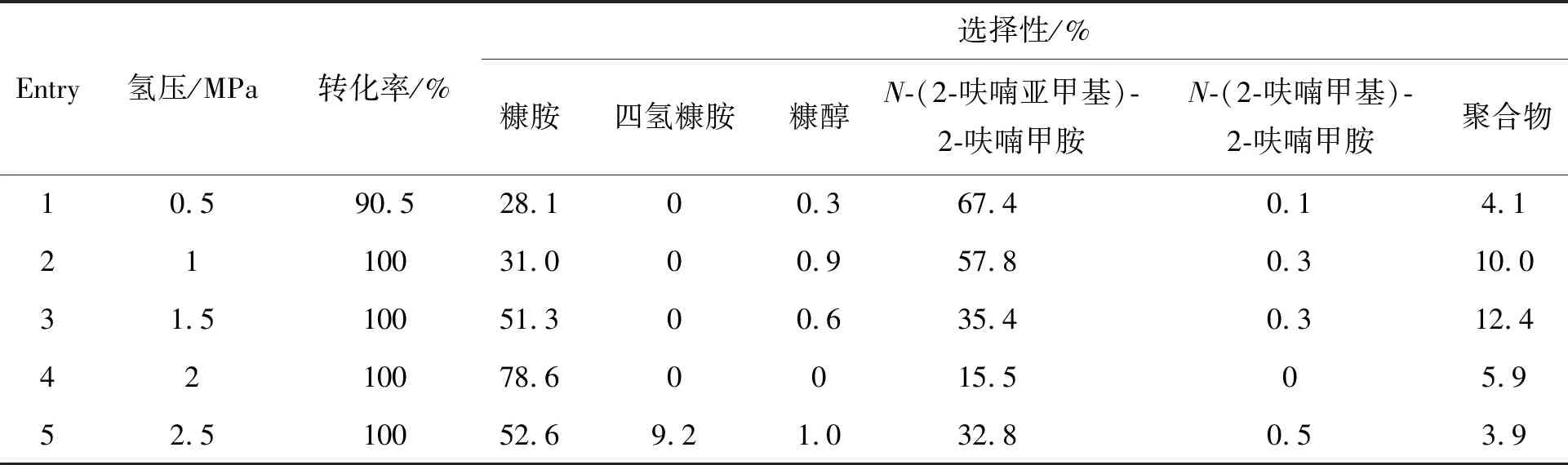
表1 氢压对糠醛还原胺化制糠胺的影响Table 1 Effect of hydrogen pressure on reductive amination of furfural to furfurylamine
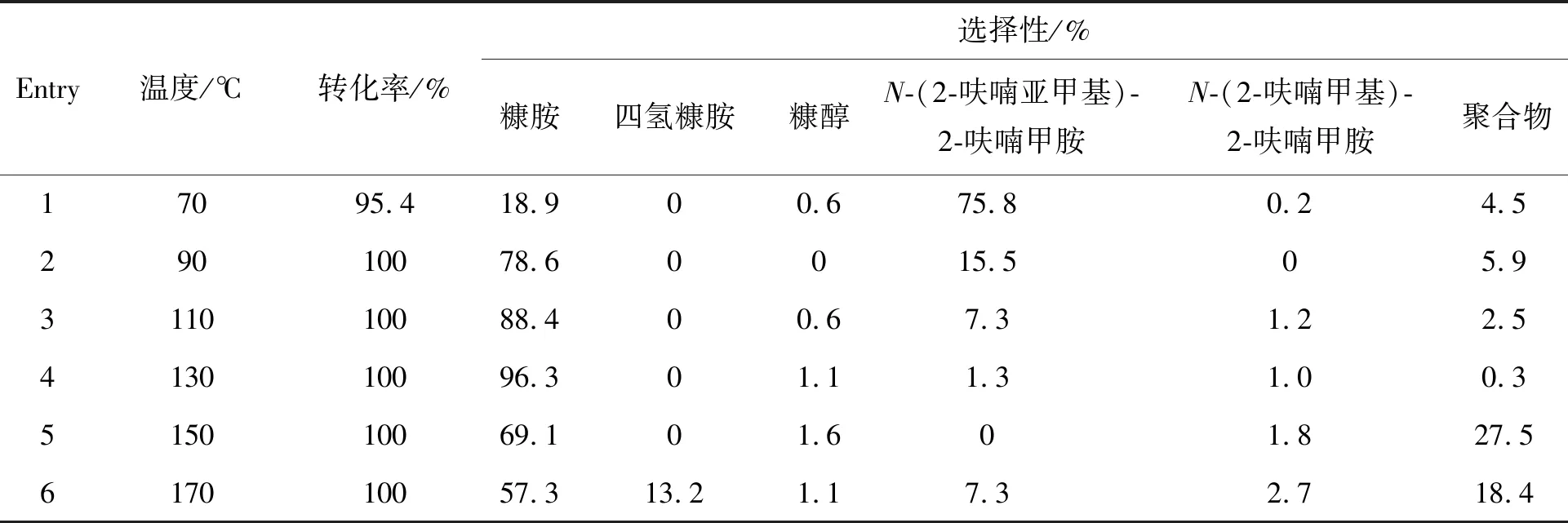
表2 反应温度对糠醛还原胺化制糠胺的影响Table 2 Effect of reaction temperature on reductive amination of furfural to furfurylamine
尽管上述贵金属基催化剂具有良好的活性,但催化剂成本较高。因此,开发价廉易得的非贵金属基催化剂作用下糠醛还原胺化制糠胺工艺具有重要意义。Zhou等[20]在120 ℃、1 MPa H2条件下使用Raney Co进行糠醛的还原胺化,糠胺产率98.9%,但催化剂使用量过高,不适宜工业生产。
糠醛还原胺化反应中,在氨源的选择方面,目前多为NH3和氨水,氨水能更稳定地控制体系中氨的浓度,在还原胺化中应用越来越广泛。Yuan等[24]用共沉淀法制备了Ni6AlOX催化剂,在100 ℃、0.4 MPa H2下反应5 h,糠胺收率为90%。最近,Manzoli等[25]以氨水为氨源,以具有核-壳结构的磁性Fe3O4@SiO2-Ni为催化剂,在115 ℃、2.0 MPa H2下微波辐射下加热3 h,糠胺收率可达100%,但催化剂制备过程繁琐,难以大规模生产。
本课题组在前期工作中发现[26],催化剂中不同金属对NH3和H2存在吸附能差异,Pt、Pd、Ru等贵金属的吸附能差大于Co和Ni等非贵金属的吸附能差,同等反应条件下,非贵金属催化剂用于还原胺化的催化效果更好。综合考虑,Ni因其固有稳定性、高活性和低成本,可作为研究的首选金属。商业Raney Ni作为一种由带有多孔结构的镍铝合金的细小晶粒组成的多相非贵金属催化剂,常用于醛酮等含有不饱和键化合物的氢化还原反应。
综上所述,本文从糠胺的产业化生产角度,以氨水为氨源,选取商业Raney Ni用于糠醛还原胺化制备糠胺,考察溶剂、时间、温度、氢气压力、催化剂用量等因素的影响,以期开发非贵金属催化剂作用下高效转化糠醛制糠胺反应工艺。
1 实验部分
1.1 仪器与试剂
仪器:多釜串联高压反应装置(型号:SLM25,生产厂家:北京世纪森朗仪器有限公司);气相色谱仪(型号:Agilent 7820A,生产厂家:安捷伦科技有限公司);电子分析天平(型号:BS224S,生产厂家:德国赛多利斯股份公司);低速离心机(型号:SC2546,生产厂家:科大创新股份有限公司中佳分公司)。
试剂:氨水(25%~28%)、糠醛(AR)、1,4-二氧六环(AR)、N-甲基吡咯烷酮(AR)、Raney Ni(W-2型,≤50 μm),均购自阿拉丁试剂有限公司。
1.2 糠胺的合成
在25 mL间歇式高压反应釜中依次加入1,4-二氧六环(10 mL)、糠醛(10 mmol)、N-甲基吡咯烷酮(NMP)(200 μL)、氨水(20 mmol)和Raney Ni(0.03 g),封釜,通入H2反复吹扫5次置换出釜内的空气,通入2 MPa H2。升温至130 ℃开启搅拌,开始反应。反应结束后,取样、离心,取上层清液采用气相色谱仪(Agilent 7820A)对反应产物进行定量分析以N-甲基吡咯烷酮为内标物,氢火焰电离检测器,DB-WAX极性石英毛细管色谱柱(30.0 m×320 μm×0.25 μm)]。
2 结果与讨论
2.1 氢压的影响
表1为90 ℃下探究氢压对Raney Ni催化剂上糠醛还原胺化制糠胺反应的影响结果。可以发现,0.5 MPa H2时,糠胺选择性较低,仅为28.1%,主要产物为席夫碱副产物(Entry 1)。随着氢压增大,席夫碱副产物含量降低,目标产物糠胺选择性增大,反映了席夫碱可以通过氢解步骤向伯胺转化。氢压为2 MPa时,糠胺选择性最高,为78.6%(Entry 4)。进一步增大氢压,糠胺选择性开始下降,呋喃环加氢产物四氢糠胺和羰基加氢副产物糠醇含量增加,表明高氢高压不利于糠胺的生成。
2.2 反应温度的影响
在70~170 ℃考察了反应温度的影响,结果如表2所示。由表2可以看出,温度对糠胺的选择性影响较大。反应温度为70 ℃时,产物主要为席夫碱,糠胺选择性不到20%(Entry 1)。升高温度可以显著提高糠胺的选择性,在130 ℃时糠胺选择性达到最大值(96.3%,Entry 4)。进一步升温对糠胺的选择性没有积极影响,相反,温度的升高会导致糠胺直接加氢生成四氢糠胺副产物,同时体系中出现聚合物。由此可以推断,反应温度低于130 ℃不足以在3 h内将糠醛转化为糠胺,但温度过高会导致过度加氢和聚合副反应发生。另外,随着温度升高,席夫碱含量降低,但没有明显的仲胺生成,说明席夫碱可以转化为糠胺。综合考虑,认为130 ℃为适宜的反应温度。
2.3 物料比[n(糠醛)/n(氨水)]的影响
表3为探究糠醛/氨水(摩尔比)对糠醛还原胺化制糠胺的影响结果。保持底物10 mmol,改变氨水用量来调整n(糠醛)/n(氨水)。整个过程中,糠醛均能完全转化,底物与氨水的摩尔比为1/1时,糠胺选择性仅41.4%,同时存在大量席夫碱和仲胺副产物(Entry 1)。增加氨水用量,糠胺选择性增大,在n(糠醛)/n(氨水)=1/2时达到最高(96.3%,Entry 3)。进一步加大氨水用量,糠胺选择性开始下降,且出现聚合物。据报道,在氨和氢存在下,席夫碱可以通过与氨反应形成仲胺,后氢解得到伯胺[27]。这可能是过量的氨水可提高伯胺选择性的原因。然而,过量的氨水会降低糠胺的选择性,这可能由于NH3在金属活性中心上的竞争性占据,抑制了金属催化剂的加氢性能,导致副产物的形成。
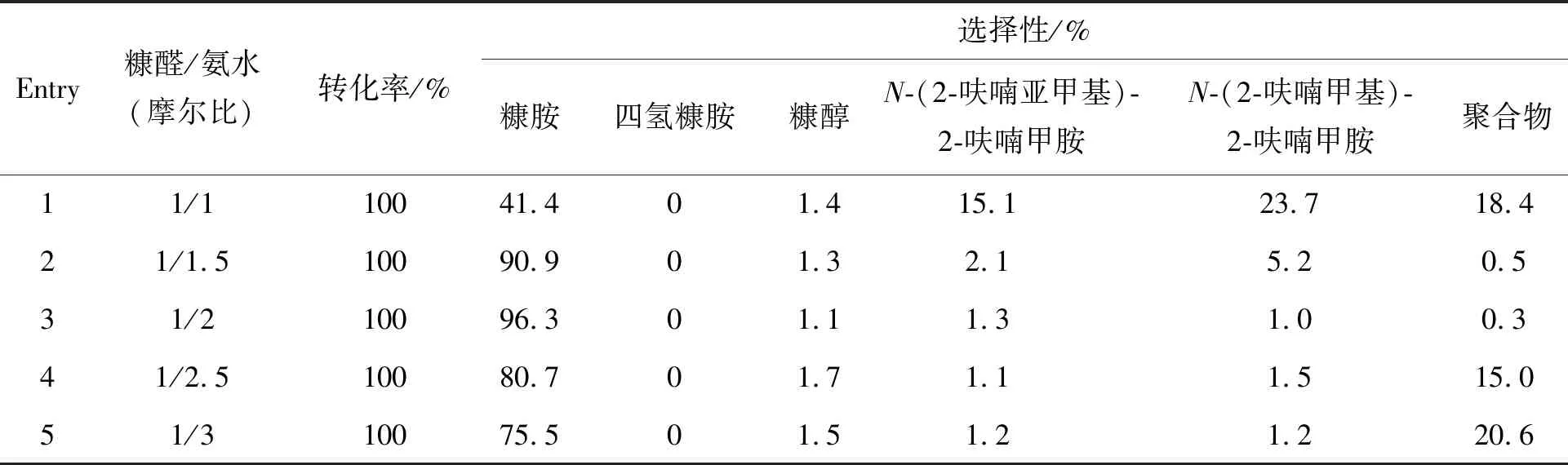
表3 糠醛/氨水(摩尔比)对糠醛还原胺化制糠胺的影响Table 3 Effect of furfural/ammonia (molar ratio)on reductive amination of furfural to furfurylamine
2.4 溶剂种类的影响
表4为3种极性溶剂甲醇、乙醇、异丙醇和3种非极性溶剂四氢呋喃、二甲基亚砜、1,4-二氧六环对糠醛还原胺化制糠胺的影响结果。3种极性溶剂中,糠胺选择性顺序为异丙醇>乙醇>甲醇(Entry 1~3);非极性溶剂中,二甲基亚砜体系几乎无糠胺生成(Entry 5)。全部反应过程中,均存在少量副产物,表明溶剂对副产物生成无显著影响,1,4-二氧六环中糠胺选择性最高,在130 ℃下反应3 h,糠胺收率96.3%(Entry 6)。
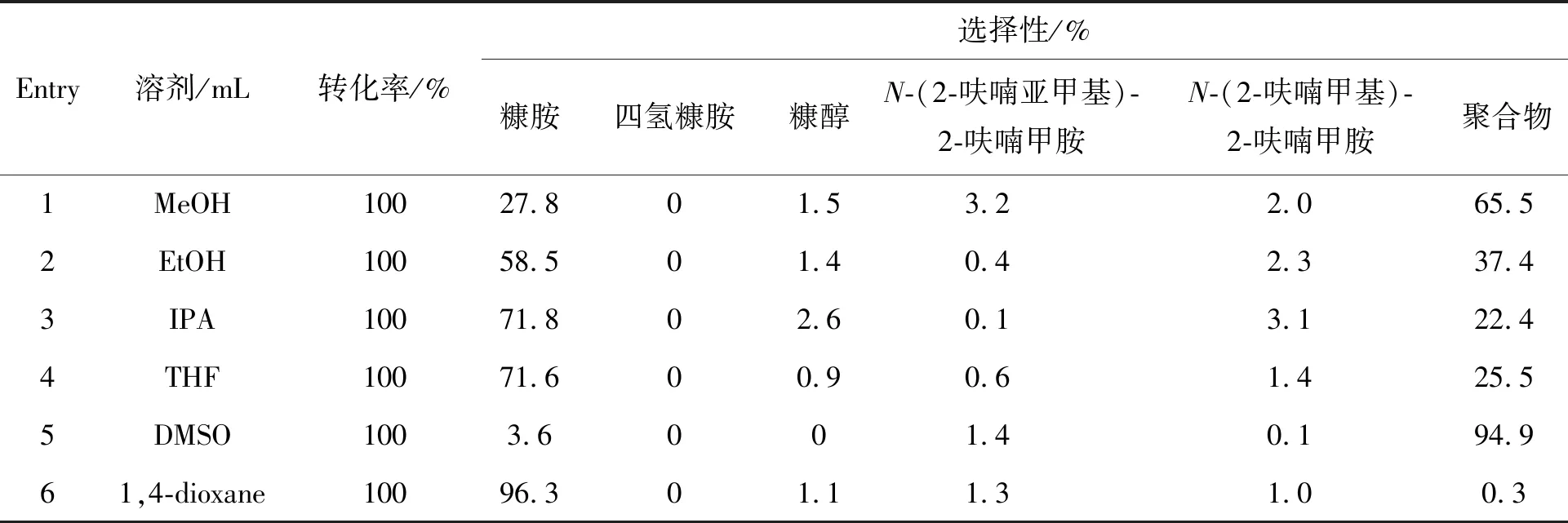
表4 溶剂对糠醛还原胺化制糠胺的影响Table 4 Effect of solvent on reductive amination of furfural to furfurylamine
2.5 反应时间的影响
为了进一步了解糠醛还原胺化反应,考察了130℃下的反应动力学,结果如表5所示。在反应开始时,糠醛以极快的速率转化,0.5 h时转化率为99.3%,此时糠胺选择性为35.9%,席夫碱选择性为54.9%(Entry 1)。这可归因于伯胺比氨具有更强的亲核性,导致反应初始形成的糠胺与剩余的糠醛立即反应形成席夫碱[27]。随着反应时间延长,席夫碱含量开始降低,糠胺含量迅速增加。反应3 h,几乎所有席夫碱均转化为糠胺,选择性为96.3%(Entry 4)。在整个过程中,副产物仲胺的含量很低。结果表明,席夫碱中间体主要是氢解生成糠胺,其次才是席夫碱中间体加氢生成仲胺,与文献报道一致[20]。此外,反应中糠醇选择性基本保持不变,表明羰基的氢化反应发生在反应的初始阶段。

表5 反应时间对糠醛还原胺化制糠胺的影响Table 5 Effect of reaction time on reductive amination of furfural to furfurylamine
综合以上结果,总结了糠醛还原胺化反应路径(Scheme 1):糠醛和氨反应预先形成亚胺中间体,随后加氢生成糠胺。此过程中,由于羰基比氨具有更高的亲核性,生成的糠胺易与糠醛反应,生成席夫碱、仲胺等副产物,高温高压下体系会生成羰基氢化反应副产物四氢糠胺[10],此外,席夫碱可以通过氢解转化为糠胺,反应初期糠醛可以被直接加氢生成糠醇。该结果与文献中描述一致。
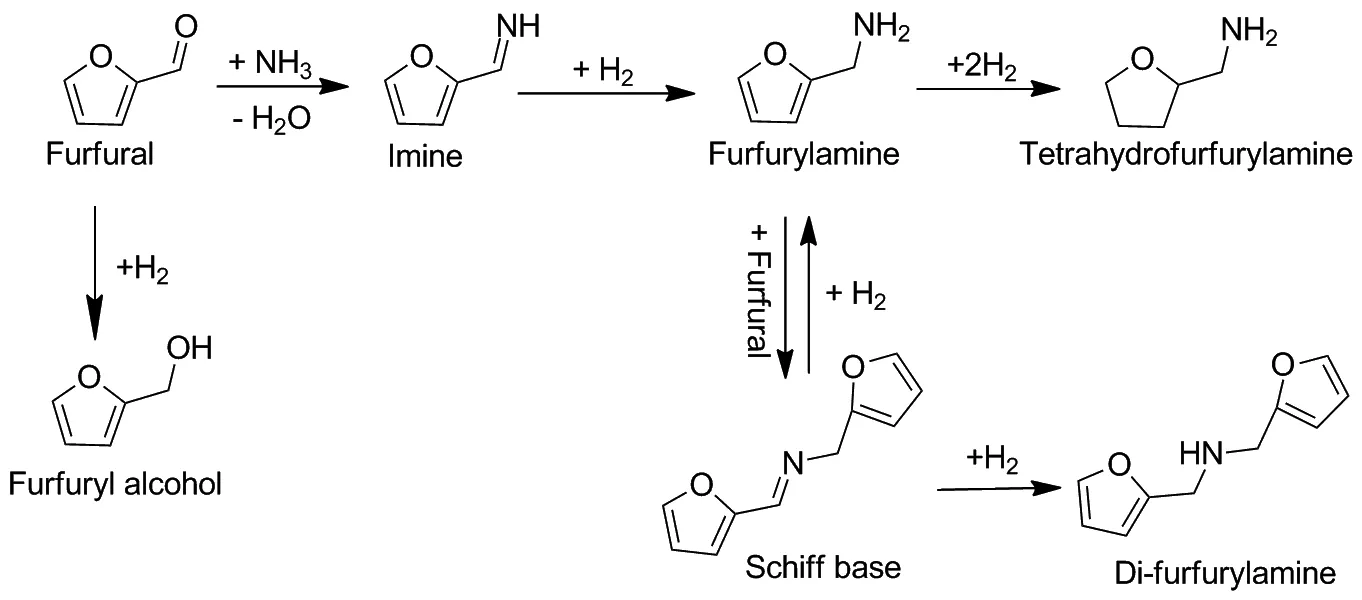
Scheme 1
2.6 催化剂用量的影响
催化剂用量对反应进程有重要影响,结果如表6所示。Raney Ni用量0.01 g时糠胺选择性仅为53.1%(Entry 1),伴随一定比例聚合物生成。催化剂增加到0.03 g,糠胺选择性明显上升,为96.3%,此时副产物含量达到最低值(Entry 2)。继续增加催化剂用量,目标产物选择性开始下降,副产物四氢糠胺含量明显增加(Entry 6~8),表明催化剂用量过多会导致活性过高发生深度加氢反应,因此,Raney Ni最佳用量为0.03 g,为反应底物糠醛质量的3%。
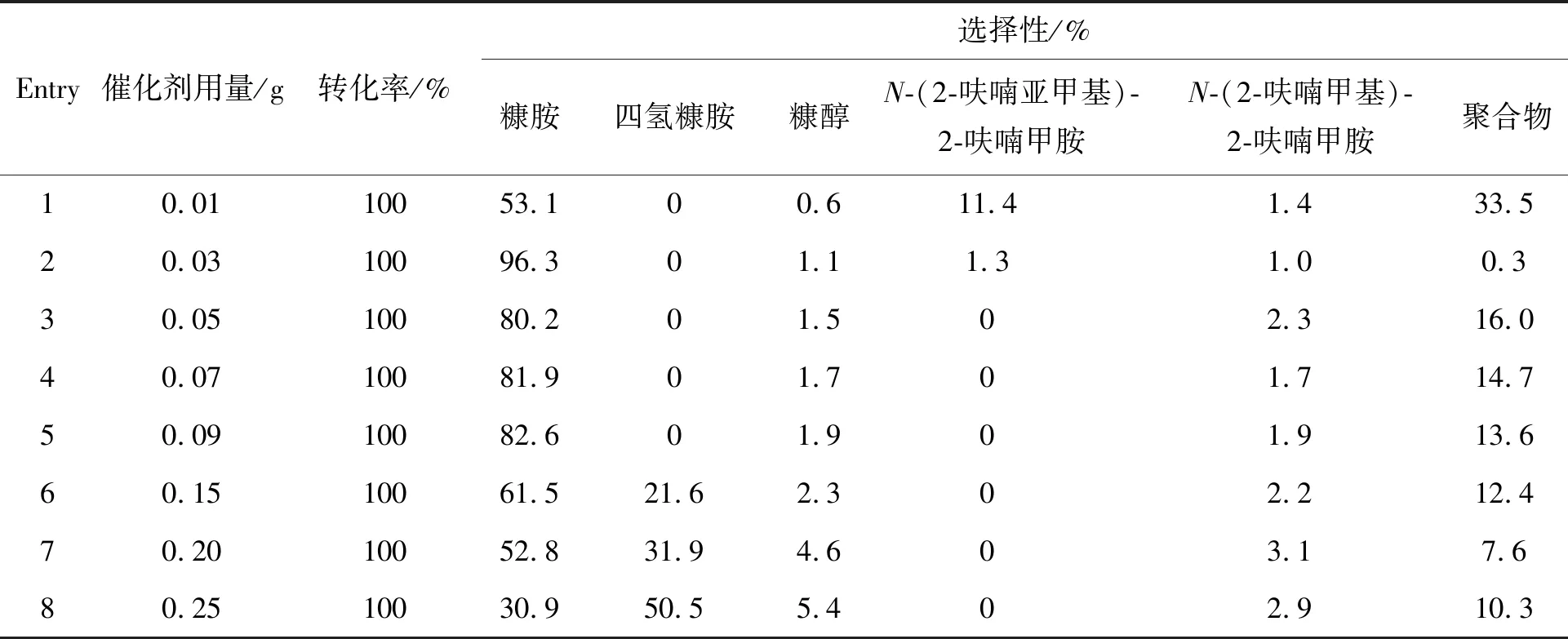
表6 催化剂用量对糠醛还原胺化制糠胺的影响
2.7 催化剂表征
W-2型商用Raney Ni由Ni/Al比为1/1的Ni-Al合金制备,活化后催化剂组成为Ni含量≥90%,Al≤8%。为进一步探索催化剂与催化性能之间的关系,用XRD对Raney Ni进行了表征,结果如图1所示。新Raney Ni和使用后的Raney Ni均在相同位置出现了3个明显的衍射峰,为2θ=44.4°,51.8°和76.4°,分别归属于Ni0的(111)、(200)和(220)晶面(PDF#01-089-7128),证明Ni0是催化反应的活性中心,与文献描述一致[29]。
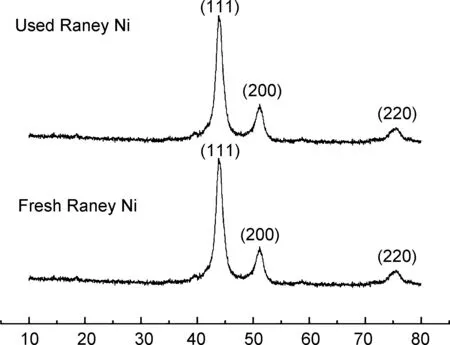
2θ/(°)
以氨水为氨源,以商业Raney Ni作为催化剂进行糠醛还原胺化反应合成糠胺。结果表明,在10 mL 1,4-二氧六环中,0.03 g Raney Ni、n(糠醛)/n(氨水)=1/2、130 ℃、2.0 MPa H2条件下反应3 h,糠醛转化率100%,糠胺选择性高达96.3%。该工艺催化剂价廉易得、催化剂用量低、目标产物糠胺收率高,具有广阔的应用前景。
