诃子不同温度炮制品的化学成分含量变化及抗溃疡性结肠炎作用比较
2022-02-20安悦言鞠成国张强郝季陈九妹王巍
安悦言 鞠成国 张强 郝季 陈九妹 王巍

中圖分类号 R283;R285.5 文献标志码 A 文章编号 1001-0408(2022)03-0332-06
DOI 10.6039/j.issn.1001-0408.2022.03.13
摘 要 目的 研究诃子不同温度炮制品的化学成分含量变化,并比较其抗溃疡性结肠炎(UC)的效果。方法 采用砂烫法制备不同温度(160、180、200、220、240、260、280、300 ℃)诃子炮制品。采用高效液相色谱法检测诃子生品和不同温度炮制品中没食子酸、诃黎勒酸、诃子酸、鞣花酸的含量。将小鼠分为空白组、模型组、美沙拉嗪肠溶片组(阳性对照,0.4 g/kg)和诃子生品及不同温度炮制品组(诃子各组给药剂量均为1.3 g/kg),每组10只。除空白组外,其余各组小鼠均从肛门一次性注入6%乙酸0.1 mL,以复制UC模型。造模成功后,空白组和模型组小鼠灌胃水,其余各组小鼠均灌胃相应药液,给药体积均为20 mL/kg,每天1次,连续 7 d。观察各组小鼠一般体征并记录体质量,检测其结直肠长度、结直肠指数及血清中炎症相关指标[超氧化物歧化酶(SOD)、丙二醛(MDA)、白细胞介素10(IL-10)、IL-1β、肿瘤坏死因子α(TNF-α)]的水平,观察结直肠病理形态学变化,并进行药效综合评分。结果 随着炮制温度的升高,诃子中诃黎勒酸、诃子酸含量逐渐降低,没食子酸含量先增加再降低,鞣花酸含量逐渐增加。与模型组比较,诃子生品和不同温度炮制品组小鼠一般体征、体质量、结直肠长度、结直肠指数及炎症相关指标水平大部分均显著改善(P<0.05或P<0.01),结直肠组织腺体隐窝结构被修复,炎症细胞浸润减少,且在260 ℃条件下制得的炮制品的药效综合评分最高。结论 诃子经不同温度炮制后化学成分含量变化显著,且抗UC的效果存在差异,其中在260 ℃条件下制得的炮制品效果最优。
关键词 诃子;炮制温度;溃疡性结肠炎;没食子酸;诃黎勒酸;诃子酸;鞣花酸
Content changes of chemical constituents and comparison of the anti-ulcerative colitis effect of processed products of Terminalia chebula at different temperatures
AN Yueyan,JU Chengguo,ZHANG Qiang,HAO Ji,CHEN Jiumei,WANG Wei(College of Pharmacy, Liaoning University of Traditional Chinese Medicine, Liaoning Dalian 116600, China)
ABSTRACT OBJECTIVE To study the content changes of chemical constituents of processed products of Terminalia chebula at different temperatures, and to compare its anti-ulcerative colitis effect. METHODS Processed products of T. chebula at different temperatures (160, 180, 200, 220, 240, 260, 280, 300 ℃) were prepared by sand scalding technology. HPLC method was adopted to determine the contents of gallic acid, chebulagic acid, chebulinic acid and ellagic acid in crude drug and processed products of T. chebula at different temperatures. The mice were divided into blank group, model group, Mesalazin enteric-coated tablets group (positive control, 0.4 g/kg), crude drug and processed products groups of T. chebula at different temperatures (1.3 g/kg), with 10 mice in each group. Except for blank group, other groups were given 6% acetic acid 0.1 mL via anus to induce ulcerative colitis model. After modeling, blank group and model group were given water intragastrically, and other groups were given relevant drug intragastrically, 20 mL/kg, once a day, for consecutive 7 days. The general physical signs of mice in each group were observed and the body weight was recorded. The colorectal length and index, serum levels of related inflammation indexes [superoxide dismutase (SOD), malondialdehyde (MDA), interleukin-10 (IL-10), IL-1β, tumor necrosis factor α (TNF-α)] were detected. The pathomorphological changes of colon and rectum were observed, and the comprehensive score of pharmacodynamics was performed. RESULTS With the increase of processing temperature, the contents of chebulagic acid and chebulinic acid decreased gradually, the content of gallic acid increased first and then decreased, and the content of ellagic acid increased. Compared with model group, the general physical signs, body weight, colorectal length, colorectal index and related inflammation indexes were all improved significantly in crude drug and processed products groups of T. chebula at different temperatures (P<0.05 or P<0.01). The glandular recess structure of colorectal tissue was repaired, the infiltration of inflammatory cells was reduced, and the comprehensive score of efficacy of processed products prepared at 260 ℃ was the highest. CONCLUSIONS The contents of chemical components in T. chebula processed at different temperatures change significantly and their anti-ulcerative colitis effects are different. The processed products of T. chebula prepared at 260 ℃ show the best anti-ulcerative colitis effect.
KEYWORDS Terminalia chebula; processing temperature; ulcerative colitis; gallic acid; chebulagic acid; chebulinic acid; ellagic acid
诃子为使君子科植物诃子Terminalia chebula Retz.或绒毛诃子T. chebula Retz. var. tomentella Kurt.的干燥成熟果实,收载于2020年版《中国药典》(一部),具有涩肠止泻、敛肺利咽的功效[1]。《本经逢原》中记载“诃子,苦涩降敛,生用清金止嗽,煨熟固肠止泻……”[2]。诃子煨后药性缓和,敛涩之性增强,可用于治疗久泻、久痢,即中医的“肠澼”[3-4],与现代临床的溃疡性结肠炎(ulcerative colitis,UC)相对应。UC是一种复发性较强的慢性消化道疾病,西医治疗UC的药物包括氨基水杨酸制剂、糖皮质激素、免疫抑制剂、微生物制剂以及生物制剂等,这些药物均具有起效迅速、近期临床缓解率高等优点,但长期服用则具有较大副作用,且药效不稳定,可对患者机体造成负面影响[5]。中医药将辨证与辨病相结合来治疗UC,具有疗效确切、不良反应少等优点[6]。有研究表明,中医药临床治疗UC的方药中,诃子的使用频率较高[7];也有研究证明,单味诃子对UC有一定治疗作用[8];但对于诃子抗UC的有效成分未见相关報道。相关研究发现,鞣质是诃子的主要成分,其含量约23.6%~37.4%,其中,没食子酸、诃黎勒酸、诃子酸、鞣花酸是鞣质中含量较高的几种成分[9-10]。因此,本实验采用砂烫法煨制诃子,制备不同温度的炮制品,并采用高效液相色谱法测定其中没食子酸、诃黎勒酸、诃子酸和鞣花酸的含量,然后通过UC模型小鼠实验比较诃子不同温度炮制品的抗UC效果,以期为临床治疗UC提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器有1100型高效液相色谱系统(美国Agilent公司)、FA1004B型分析天平(上海精密科学仪器有限公司)、Multiskan MK3型酶标仪(美国Thermo Fisher Scientific公司)、Fresco型台式高速冷冻离心机(德国Heraeus公司)。
1.2 主要药品与试剂
诃子药材购自河北安国药材市场,产地为云南,经辽宁中医药大学药学院翟延君教授鉴定为使君子科植物诃子T. chebula Retz.的干燥成熟果实。美沙拉嗪肠溶片(批号20200901,规格0.25 g)购自黑龙江天宏药业股份有限公司;超氧化物歧化酶(superoxide dismutase,SOD)酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)试剂盒、丙二醛(malondialdehyde,MDA)ELISA试剂盒、白细胞介素10(interleukin 10,IL-10)ELISA试剂盒、IL-1β ELISA试剂盒、肿瘤坏死因子α(tumor necrosis factor-alpha,TNF-α)ELISA试剂盒均购自上海科兴生物科技有限公司(批号分别为F2389-A、F9261-A、F2176-A、F2040-A、F2132-A);没食子酸、鞣花酸的对照品均购自成都曼思特生物科技有限公司(纯度均大于98%,批号分别为MUST-13040103、MUST- 14031010);诃黎勒酸、诃子酸的对照品均购自成都普瑞法科技开发有限公司(纯度均大于98%,批号分别为PRF8112302、PRF8071201);甲醇、磷酸为色谱纯,乙酸、甲醛为分析纯,水为超纯水。
1.3 动物
本研究所用动物为SPF级昆明小鼠,共120只,雌雄各半,体质量为(20±2) g,购自辽宁长生生物技术有限公司,动物生产许可证号为SCXK(辽)2020-0001。小鼠饲养于温度(23±2) ℃、相对湿度(55±10)%的动物房内,每12 h昼夜交替,期间自由进食、饮水,适应性饲养1周后进行后续实验。
2 方法与结果
2.1 诃子不同温度炮制品的制备
取诃子全果8份,每份100 g,置于加满净河砂的炒锅中,分别于160、180、200、220、240、260、280、300 ℃条件下翻埋6 min,取出放凉,即得。
2.2 供试品溶液的制备
取诃子生品及“2.1”项下所制诃子炮制品,去核,留果肉,粉碎,过65目筛。精密称取上述药材粉末0.1 g,加入70%甲醇溶液50 mL,精密称定质量,超声(功率250 W,频率40 kHz)提取20 min;放冷,以70%甲醇溶液补足损失质量,摇匀,滤过;取续滤液2 mL定容至10 mL量瓶中,再经0.22 ?m微孔滤膜滤过,取续滤液,即得。
2.3 对照品溶液的制备
分别精密称取没食子酸、诃黎勒酸、诃子酸、鞣花酸的对照品适量,置于10 mL量瓶中,加入甲醇定容,制成上述4种成分质量浓度分别为0.222 5、0.418 0、0.463 0、0.177 5 mg/mL的单一对照品溶液。取上述各单一对照品溶液适量,加甲醇稀释,制成上述4种成分质量浓度分别为0.011 1、0.135 9、0.150 5、0.037 2 mg/mL的混合对照品溶液。
2.4 色谱条件
色谱柱为Dikma Platisil(250 mm×4.6 mm,5 ?m);流动相为0.1%磷酸溶液(A)-甲醇(B)(梯度洗脱:0~5 min,5%B→10%B;5~10 min,10%B→12%B;10~15 min,12%B→20%B;15~25 min,20%B;25~27 min,20%B→32%B;27~35 min,32%B;35~37 min,32%B→35%B;37~42 min,35%B;42~45 min,35%B→42%B;45~55 min,42%B;55~57 min,42%B→45%B;57~62 min,45%B;62~70 min,45%B→100%B);进样量为10 μL;流速为1 mL/min;柱温为25 ℃;检测波长为270 nm。
2.5 方法学考察
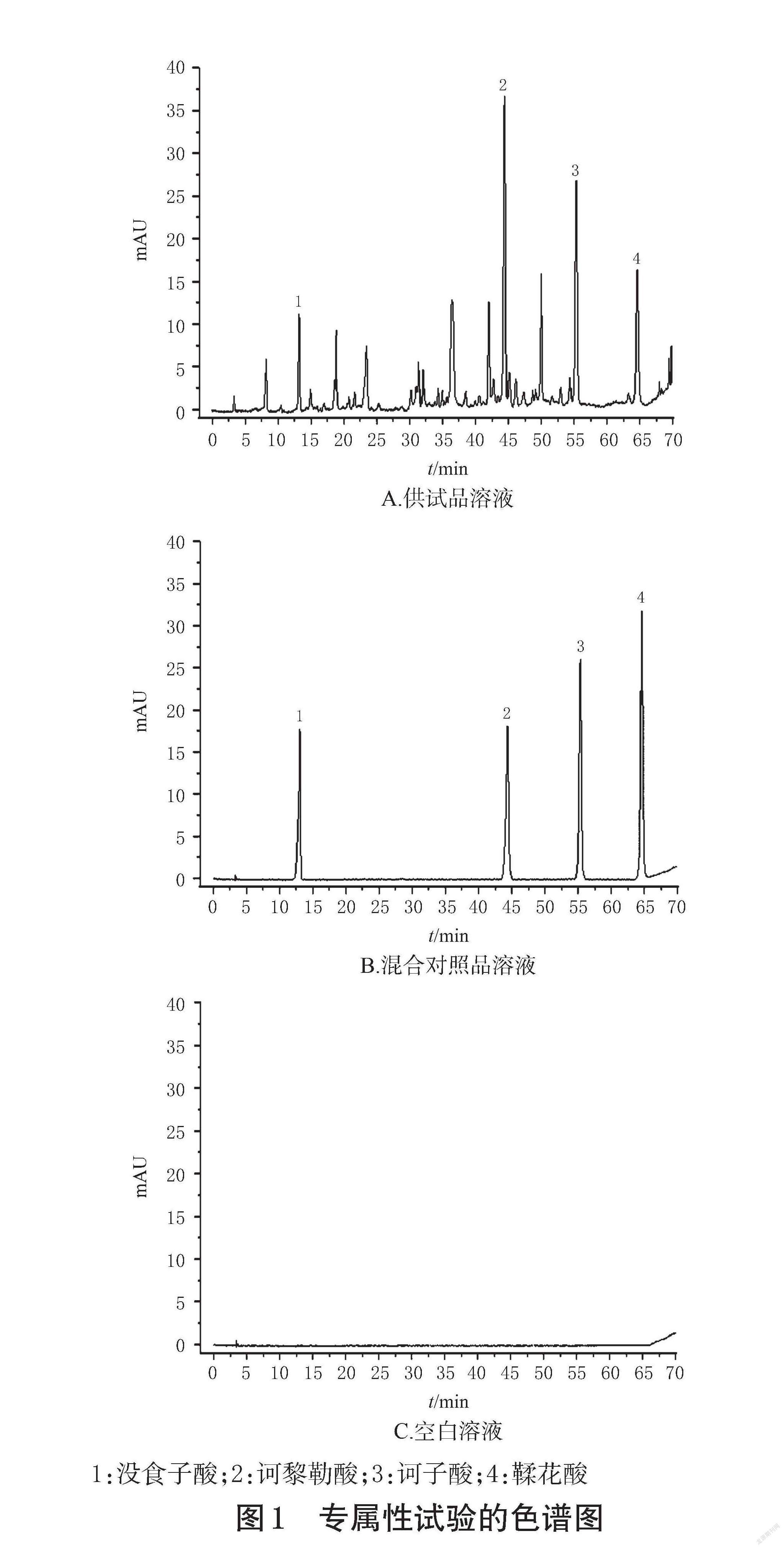
2.5.1 专属性试验 取“2.2”项下供试品溶液(以诃子生品制备)、“2.3”项下混合对照品溶液和空白溶液(70%甲醇),按“2.4”项下色谱条件进样分析,记录色谱图。结果显示,对照品溶液与供试品溶液色谱图中各待测成分的色谱峰与相邻峰分离良好,详见图1。
2.5.2 线性关系考察 取“2.3”项下混合对照品溶液适量,以甲醇溶解并逐级稀释,使得没食子酸的质量浓度分别为11.13、5.56、2.78、1.39、0.70、0.35 μg/mL,诃黎勒酸的质量浓度分别为135.85、67.93、33.96、16.98、8.49、4.25 μg/mL,诃子酸的质量浓度分别为150.48、75.24、37.62、18.81、9.40、4.70 μg/mL,鞣花酸的质量浓度分别为37.22、18.61、9.30、4.65、2.33、1.16 μg/mL;按“2.4”项下色谱条件进样分析,记录峰面积。以质量浓度(x)为横坐标、峰面积(y)为纵坐标,计算回归方程。结果显示,上述各成分在各自检测质量浓度范围内线性关系良好,详见表1。
2.5.3 精密度试验 取诃子生品,按“2.2”项下方法制备供试品溶液,再按“2.4”项下色谱条件连续进样6次,计算得没食子酸、诃黎勒酸、诃子酸、鞣花酸峰面积的RSD分别为1.54%、1.39%、1.06%、0.92%(n=6),表明儀器精密度良好。
2.5.4 稳定性试验 取诃子生品,按“2.2”项下方法制备供试品溶液,于室温放置0、2、4、8、12、24 h后,再按“2.4”项下色谱条件进样分析,计算得没食子酸、诃黎勒酸、诃子酸、鞣花酸峰面积的RSD分别为1.06%、0.81%、1.31%、1.39%(n=6),表明供试品溶液在室温放置24 h内稳定性良好。
2.5.5 重复性试验 取诃子生品6份,按“2.2”项下方法平行制备6份供试品溶液,再按“2.4”项下色谱条件进样分析,记录峰面积并根据标准曲线计算样品中各成分的含量。结果显示,没食子酸、诃黎勒酸、诃子酸、鞣花酸的含量分别为3.12、144.10、104.30、12.55 mg/g,RSD分别为1.11%、0.84%、1.10%、1.31%(n=6),表明该方法重复性良好。
2.5.6 加样回收率试验 分别精密称取6份已知没食子酸、诃黎勒酸、诃子酸和鞣花酸含量的诃子生品0.05 g,加入相当于样品中各成分含量100%的对照品,再按“2.2”项下方法制备供试品溶液,按“2.4”项下色谱条件进样分析,计算加样回收率,结果见表2。
2.6 含量测定
取“2.2”项下供试品溶液,按“2.4”项下色谱条件进样分析,并根据标准曲线计算没食子酸、诃黎勒酸、诃子酸和鞣花酸的含量,平行测定2次,结果见表3。
2.7 药效实验
2.7.1 分组、造模与给药 将小鼠按随机对照原则分为空白组、模型组、美沙拉嗪肠溶片组(阳性对照,0.4 g/kg,剂量根据临床等效剂量换算而得)和诃子生品及不同温度炮制品组[诃子各组给药剂量均为1.3 g/kg,根据2020年版《中国药典》(一部)中诃子最大服用剂量与小鼠体表系数换算而得],每组10只。模型组和诃子各组小鼠均参考文献[11]方法建立UC模型,具体方法如下:小鼠禁食不禁水24 h后,腹腔注射20%乌拉坦麻醉后,将16号钝化针头抹上甘油,缓缓插入肛门3~4 cm处,一次性注入6%乙酸0.1 mL;捏住肛门计时20 s后,同法注入生理盐水2 mL进行冲洗,然后将小鼠放回鼠笼,待其静躺至清醒。空白组小鼠肛门注入等量生理盐水,其余操作同上。以小鼠毛色晦暗、腹泻及聚堆现象明显、粪便隐血检测示阳性为标准判定造模成功[12]。造模成功后,空白组和模型组小鼠灌胃水,其余各组小鼠均灌胃相应药液,给药体积均为20 mL/kg,每天1次,连续7 d。
2.7.2 统计学方法 采用SPSS 17.0软件进行统计分析,数据以x±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD检验。检验水准α=0.05。
2.7.3 一般体征观察 每日观察各组小鼠一般体征并记录体质量的变化,计算实验7 d后的体质量相对率(体质量相对率=小鼠当日体质量/小鼠实验第1天体质量×100%);收集各组小鼠每日粪便进行隐血检测[12]:将粪便放在培养皿上,滴加邻联甲苯胺溶液2~3滴,再滴加3%过氧化氢2~3滴,立即观察显色结果,并根据表4中的粪便隐血检测结果判断标准进行判断。结果显示,各组小鼠实验前一般体征及体质量无显著差异,粪便隐血检测均为阴性。实验7 d后,与空白组比较,模型组小鼠体质量显著降低(P<0.01),粪便隐血检测结果为阳性,且隐血评分显著升高(P<0.01);与模型组比较,诃子各组小鼠体质量均显著升高(P<0.01),粪便隐血检测结果为阳性,但隐血评分均显著降低(P<0.01),详见表5。
2.7.4 结直肠长度及结直肠指数检测 末次给药后,各组小鼠禁食不禁水24 h,摘眼球取血,血样以3 000 r/min离心10 min,吸取上清液,备用。小鼠取血后,迅速脱颈处死,剖开腹腔,剥离肛门到盲肠段组织(即结直肠),用生理盐水冲洗掉血污,用吸水纸吸干生理盐水后,测量每只小鼠结直肠长度,并称定质量,计算结直肠指数(结直肠指数=结直肠质量/小鼠体质量)[13]。结果显示,与空白组比较,模型组小鼠结直肠长度显著缩短、结直肠指数显著升高(P<0.01);与模型组比较,诃子各组小鼠结直肠长度显著增加、结直肠指数显著降低(P<0.01),详见表6。
2.7.5 结直肠组织病理形态学观察 结直肠长度及质量测定完毕后,迅速剪取结直肠组织进行切片和苏木素-伊红染色,然后采用显微镜观察该组织的病理形态学改变。结果显示,模型组小鼠结直肠组织可见少量红细胞,固有层腺体隐窝结构损伤严重,并有大量炎症细胞浸润;与模型组比较,诃子各组小鼠结直肠组织腺体隐窝结构被修复,炎症细胞浸润减少,详见图2。
2.7.6 小鼠血清中炎症细胞因子水平检测 取“2.7.4”项下各组小鼠的血清适量,按ELISA法检测血清中SOD、MDA、IL-10、IL-1β、TNF-α水平。结果显示,与空白组比较,模型组小鼠血清中SOD、IL-10水平均显著降低(P<0.01),MDA、IL-1β、TNF-α水平均显著升高(P<0.05或P<0.01);与模型组比较,诃子各组小鼠血清中上述指标水平大部分显著逆转(P<0.05或P<0.01),详见表7。
2.7.7 药效综合评分计算 为进一步明确诃子生品及不同温度炮制品与其抗UC作用的关系,笔者参考文献[14-15]方法,以各组小鼠体质量相对率、粪便隐血评分、结直肠长度、结直肠指数进行疾病活动指数(disease activity index,DAI)评分,以各细胞因子进行炎症评分,再将DAI评分和炎症评分结合,得出药效综合评分。DAI评分、炎症评分和药效综合评分的计算方法如下:
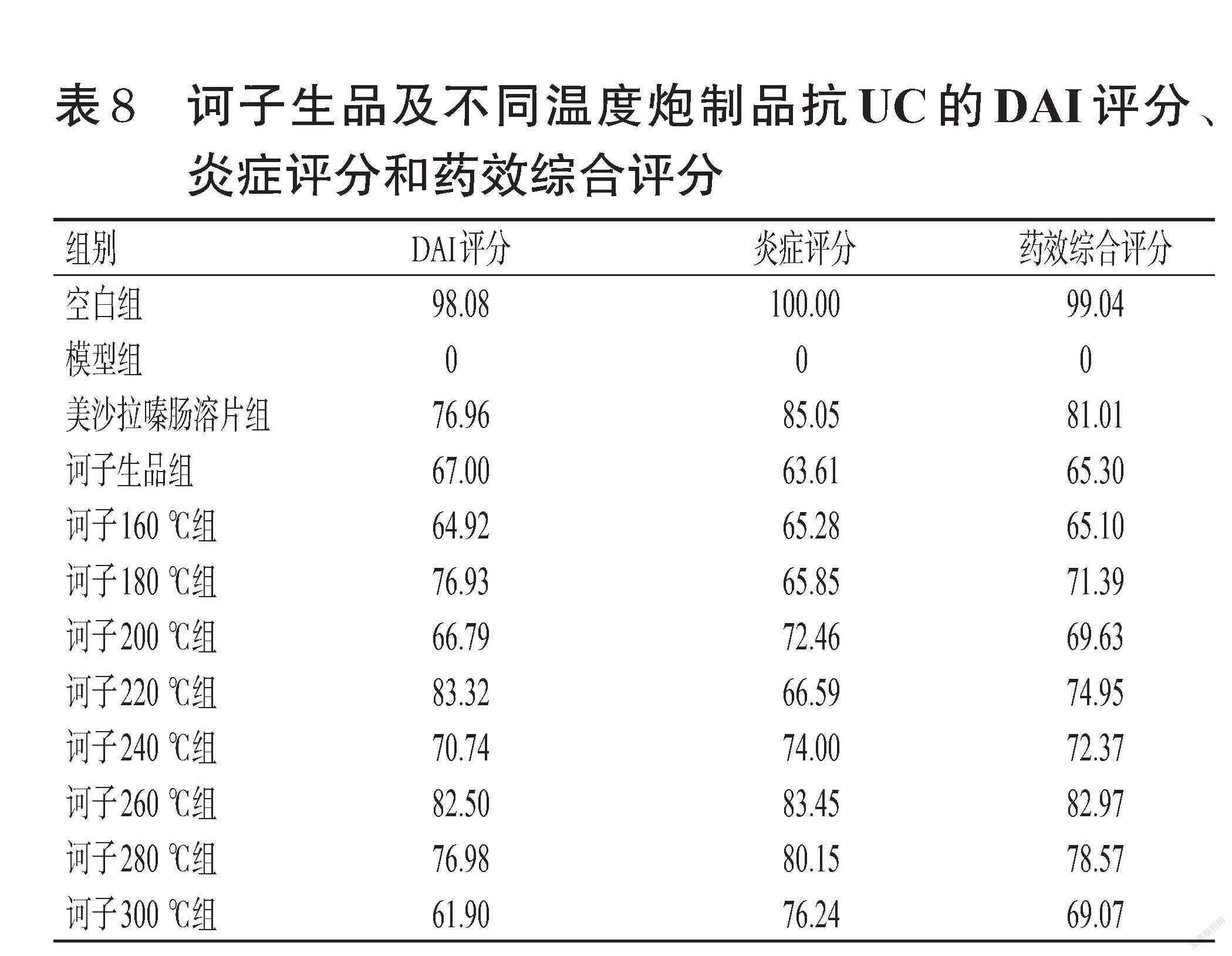
其中,i为待计算组,M为模型组,MAX为各组指标对应的最大值。结果显示,诃子生品及不同温度炮制品均具有不同程度的抗UC作用,且随着炮制温度升高,抗UC效果逐渐增强。其中,在260 ℃条件下制得的诃子炮制品药效综合评分最高,表明其具有最优抗UC效果;当炮制温度达280 ℃以上时,所制诃子炮制品的药效逐渐减弱,可能是其化学成分发生了碳化。结果见表8。
诃子现代炮制方法主要有炒法、麸煨法、砂烫法。炒法与麸煨法一般控制温度在130~150 ℃,若温度过高辅料将发生碳化;砂烫法一般控制温度在150~200 ℃,由于河砂性质稳定,根据需要可以加热至更高温度,甚至可达300 ℃。诃子古法炮制常用“面裹煻灰中煨之,令面黄熟去核”“湿纸裹煨,纸干即剥去核”等[16],其操作是用面或湿纸裹住诃子后置于煻灰中煨制。单炒法虽然能以武火达到200 ℃,但由于诃子为果实类药材,形状为类圆形,高温单炒容易受热不均出现焦斑;砂烫法可通过河砂包埋传递热量,使果实受热均匀,这与古代“煻灰火煨”的炮制方法最为接近。
本研究结果显示,诃子炮制过程中诃黎勒酸含量随着温度的升高而逐渐降低;诃子酸含量亦随温度的升高而降低,且当温度超过240 ℃时显著降低,在280 ℃时则检测不到;没食子酸含量随温度升高呈现先增加再降低的趋势,当温度达到200 ℃后其含量约增加为原有含量的3倍,并且在200~260 ℃之间时含量变化不大,当温度高于280 ℃后含量显著降低;鞣花酸含量随温度升高持续增高,且当温度到达240 ℃以后含量保持稳定,但当温度到达280 ℃时,由于碳化严重,含量开始降低。由此可见,温度的变化对诃子化学成分具有重要影响。
目前,UC发病机制尚不明确,炎症细胞因子表达失衡被认为是诱发UC的重要因素,可介导结肠黏膜的病理性损伤[17-18]。如TNF-α、IL-10可通过激活局部黏膜相关免疫组织,使肠道免疫和耐受之间的平衡遭到破坏、微生物免疫调控失常,最终导致肠道产生慢性炎症[17]。SOD与MDA为氧化应激指标,SOD可以清除自由基以减少自由基反应;而MDA为机体内自由基脂质过氧化产物,具有细胞毒性[12]。SOD水平降低或MDA水平升高会激活体内氧自由基,氧自由基使肠黏膜受损,导致肠道腺体上皮炎症损伤加重[19]。IL-1和TNF-α等促炎细胞因子是公认能介导UC发病的细胞因子[18]。本研究结果显示,与空白组比较,模型组小鼠体质量和血清中SOD、IL-10水平均显著降低(P<0.01),MDA、IL-1β、TNF-α水平均显著升高(P<0.05或P<0.01),粪便隐血检测为阳性,且结直肠组织损伤严重,并有大量炎症细胞浸润。经诃子生品及其不同炮制品干预后,小鼠上述指标水平大部分均有所改善,且诃子在260 ℃条件下制得的炮制品药效综合评分最高,表明其在改善小鼠体征和各项指标方面效果最优。
综上所述,诃子不同温度炮制品中化学成分含量变化显著,且抗UC效果存在差异,其中在260 ℃条件下制得的炮制品效果最优。后续本课题组将深入研究诃子抗UC的药效物质基础及作用机制。
参考文献
[ 1 ] 国家药典委员会.中华人民共和国药典:一部[S]. 2020年版.北京:中国医药科技出版社,2020:194-195.
[ 2 ] 苗明三,孙玉信,王晓田.中药大辞典[M].太原:山西科学技术出版社,2017:480.
[ 3 ] 李越峰.中药炮制技术[M].兰州:甘肃科学技术出版社,2016:285.
[ 4 ] 周天羽.溃疡性结肠炎(久痢)的认知与探索[M].沈阳:辽宁科学技术出版社,2017:1-2.
[ 5 ] 孫中美,胡立明,毛堂友,等.溃疡性结肠炎中西医治疗进展[J].辽宁中医药大学学报,2018,20(11):171-175.
[ 6 ] 麦尔哈巴·米吉提,王佳佳,迟莉,等.中医药治疗溃疡性结肠炎研究进展[J].时珍国医国药,2019,30(3):669-671.
[ 7 ] 李盈,王振宜,韩昌鹏,等.基于数据挖掘的溃疡性结肠炎口服方药分析[J].山东中医杂志,2020,39(11):1166-1169.
[ 8 ] 董鹏,薛洪利.诃子抗大鼠溃疡性结肠炎免疫机制实验研究[J].辽宁中医药大学学报,2014,16(6):41-44.
[ 9 ] 杨雁.诃子化学成分、生物活性及分析方法研究进展[J]. 西藏科技,2016(9):34-39.
[10] 李晗,张广平,陈腾飞,等.蒙药诃子配伍草乌的减毒增效机制研究进展[J].世界中医药,2021,16(24):3701-3707.
[11] 温聪聪,鞠成国,张强,等.麸煨诃子不同部位抗溃疡性结肠炎的谱效关系[J].中成药,2019,41(8):1910-1914.
[12] 张强,杜春洁,胡佳惠,等.基于“肺与大肠相表里”理论探讨诃子对溃疡性结肠炎模型小鼠的治疗作用[J].现代中药研究与实践,2020,34(5):34-38.
[13] 吴甜甜,刘雪珂,刘馥春,等.左金丸对DSS诱导的溃疡性结肠炎小鼠免疫记忆性T细胞水平的调节作用[J].中药新药与临床药理,2020,31(10):1158-1164.
[14] 何育佩,杜正彩,侯小涛,等.溃疡性结肠炎动物模型研究进展[J].世界科学技术(中医药现代化),2020,22(2):423-433.
[15] 王巍,张强,杜春洁,等.基于偏最小二乘回归法分析诃子对溃疡性结肠炎“肺肠同治”的谱效关系[J].中成药,2021,43(9):2590-2596.
[16] 盛书贵,蒋纪洋,孙龙宇. 诃子古今炮制研究初探[J].时珍国医国药,1998,9(6):556-557.
[17] 贾雪寒,郭元虎.溃疡性结肠炎发病机制免疫因素的研究进展[J].系统医学,2018,3(7):180-182.
[18] 解春静,庄彦华,栾雨茏.溃疡性结肠炎发病机制中免疫因素的研究进展[J].细胞与分子免疫学杂志,2013,29(8):889-892.
[19] 冯玉龙,夏俊博.康复新液治疗老年溃疡性结肠炎的疗效及对超敏C反应蛋白、丙二醛与超氧化物歧化酶的影响[J].天津药学,2020,32(3):25-27.
(收稿日期:2021-09-09 修回日期:2021-12-27)
(编辑:唐晓莲)
基金项目:辽宁省科学技术计划项目(No.2019-ZD-0951)
硕士研究生。研究方向:中药分析。E-mail:852762698@qq.com
通信作者:副教授,硕士生导师,博士。研究方向:中药质量评价及新药开发。E-mail:ww_101737@126.com
