蒙药三子散HPLC指纹图谱结合化学模式识别研究
2022-02-20刘妍妍张慧文白云霞刘宏夏慧敏久欣王焕芸
刘妍妍 张慧文 白云霞 刘宏 夏慧敏 久欣 王焕芸








中圖分类号 R917 文献标志码 A 文章编号 1001-0408(2022)03-0319-07
DOI 10.6039/j.issn.1001-0408.2022.03.11
摘 要 目的 建立蒙药三子散高效液相色谱(HPLC)指纹图谱,通过化学模式识别方法综合评价其内在质量。方法 采用HPLC法,以京尼平苷色谱峰为参照峰,采用《中药色谱指纹图谱相似度评价系统(2012版)》绘制15批三子散的HPLC指纹图谱并进行相似度评价,标定并指认共有峰。结合聚类分析、主成分分析和正交偏最小二乘法-判别分析对15批三子散的指纹图谱进行质量评价,筛选影响其质量的差异性标志物。结果 15批三子散中共有29个共有峰,相似度均不低于0.952,表明15批三子散的化学组成一致性较好;共指认了诃子次酸、没食子酸、石榴皮鞣素、安石榴苷A、安石榴苷B、jasminoside B、咖啡酸、柯里拉京、京尼平苷、诃子鞣酸、1,2,3,4,6-O-没食子酰葡萄糖、诃子林鞣酸、鞣花酸13个共有峰。聚类分析与主成分分析均可将15批三子散分为4类,且分类结果一致,表明15批三子散的质量存在一定差异;结合正交偏最小二乘法-判别分析筛选出导致批次间质量差异的14个差异性标志物(诃子次酸、没食子酸、鞣花酸等)。结论 建立的HPLC指纹图谱分析方法简便、稳定,结合化学模式识别分析可用于三子散的质量控制。
关键词 三子散;高效液相色谱法;指纹图谱;相似度评价;化学模式识别;聚类分析;主成分分析;正交偏最小二乘法-判别分析;质量控制
Study on HPLC fingerprint and chemical pattern recognition of Mongolian medicine Sanzisan
LIU Yanyan1,ZHANG Huiwen1,BAI Yunxia2,LIU Hong1,XIA Huimin1,JIU Xin1,WANG Huanyun1(1. School of Pharmacy, Inner Mongolia Medical University, Hohhot 010110, China; 2. Baotou Medical College, Inner Mongolia University of Science and Technology, Inner Mongolia Baotou 014010, China)
ABSTRACT OBJECTIVE To establish the HPLC fingerprint of Mongolian medicine Sanzisan, and to evaluate its internal quality by chemical pattern recognition technique comprehensively. METHODS HPLC method was used. Using geniposide as reference, HPLC fingerprints of 15 batches of Sanzisan were drawn with Similarity Evaluation System of TCM Chromatogram Fingerprint (2012 edition). Similarity evaluation and common peaks identification were conducted. Combined with cluster analysis (CA), principal component analysis (PCA), and orthogonal partial least squares-discriminant analysis (OPLS-DA), the quality of 15 batches of Sanzisan was evaluated, and the differential markers that affected its quality were screened. RESULTS There were 29 common peaks in 15 batches of Sanzisan, and the similarity was no less than 0.952, indicating that the chemical composition of the 15 batches of Sanzisan had good consistency. A total of 13 common peaks were identified, which were chebulic acid, gallic acid, punicalin, punicalagin A, punicalagin B, jasminoside B, caffeic acid, corilagin, geniposide, chebulagic acid, 1,2,3,4,6- O-galloylglucose, chebulinic acid, ellagic acid. Both CA and PCA could divide 15 batches of Sanzisan into four categories, and the classification results were consistent, indicating that the quality of 15 batches of Sanzisan had certain differences. Fourteen differential markers (chebulic acid, gallic acid, ellagic acid, etc) that lead to the quality difference between batches were screened out by OPLS-DA. CONCLUSIONS Established HPLC fingerprint analysis method is simple and stable. Combined with chemical pattern recognition analysis, it can be used for the quality control of Sanzisan.
KEYWORDS Sanzisan; HPLC; fingerprint; similarity evaluation; chemical pattern recognition; cluster analysis; principal component analysis; orthogonal partial least squares-discriminant analysis; quality control
三子散系2020年版《中国药典》(一部)收载的少数蒙古族验方之一,由诃子、栀子、川楝子等比例组成,具有清热凉血、解毒的功效,主治温热、血热、新久热[1]。三子散始载于《四部医典》[2],主治新旧血热、血热性目赤、正常血与病血混合、未成熟熱、搏热,希拉热等症[3]。现代药理学研究报道,三子散能够降低全血黏度,增加血流量[4-6];能治疗高脂血症,提示其对血栓形成、防治心脑血管疾病有重要参考意义[7];还能防止血小板聚集、抗凝血、提高免疫力和抗炎、抗菌[8]等。
三子散临床疗效显著,使用历史久远。现行的质控方法多以单指标测定有效成分栀子苷、没食子酸、川楝素、还原糖的含量[9-14]表征复方质量,难以体现制剂的整体特性和内在品质。本课题组前期已通过一测多评法测定三子散中活性成分,如没食子酸、羟异栀子苷、京尼平龙胆二糖苷、绿原酸、西红花苷Ⅰ、西红花苷Ⅱ和诃黎勒酸的含量,建立了三子散的多指标质量评价模式[15-16]。基于此,为了更系统地评价三子散质量,本研究采用高效液相色谱(HPLC)法建立了15批三子散指纹图谱,并对共有峰进行标定、指认与归属,同时在指纹图谱相似度评价的基础上,首次结合化学模式识别分析方法比较15批三子散的质量差异,筛选影响三子散质量的差异性标志物,旨在为其质量控制提供依据,同时为更多蒙古族验方质量控制方法的建立提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器有LC-2030C 3D型HPLC仪、AP135W型十万分之一电子天平(日本Shimadzu公司),MS205DU型十万分之一天平(瑞士Mettler Toledo公司),JJ224BC型万分之一电子天平(常熟市双杰测试仪器厂),SB25-12DTD型超声波清洗机(宁波新芝生物科技股份有限公司),WK-1000A型小型高速粉碎机(潍坊市北方制药设备制造有限公司)等。
1.2 主要药品与试剂
对照品诃子次酸(批号M30GB150105,纯度≥95%)、石榴皮鞣素(批号M23J11S119104,纯度≥98%)、安石榴苷(批号Y11S11Y124050,纯度≥98%)、柯里拉京(批号P25A11S122217,纯度≥98%)、诃子鞣酸(批号M29GB143373,纯度≥98%)、1,2,3,4,6-O-没食子酰葡萄糖(批号P16M11F113433,纯度≥99%)、诃子林鞣酸(批号P24J9F53640,纯度≥98%)均购自上海源叶生物科技有限公司;对照品没食子酸(批号D2016091,纯度99%)、咖啡酸(批号I2002097,纯度98%)、京尼平苷(批号J2027132,纯度≥98%)、鞣花酸(批号K1813148,纯度96%)均购自阿拉丁试剂有限公司;对照品jasminoside B(批号P16A9F58571,纯度≥98%)购自北京谱析科技有限公司。乙腈、甲醇为色谱纯,甲酸、磷酸为分析纯,水为纯净水。
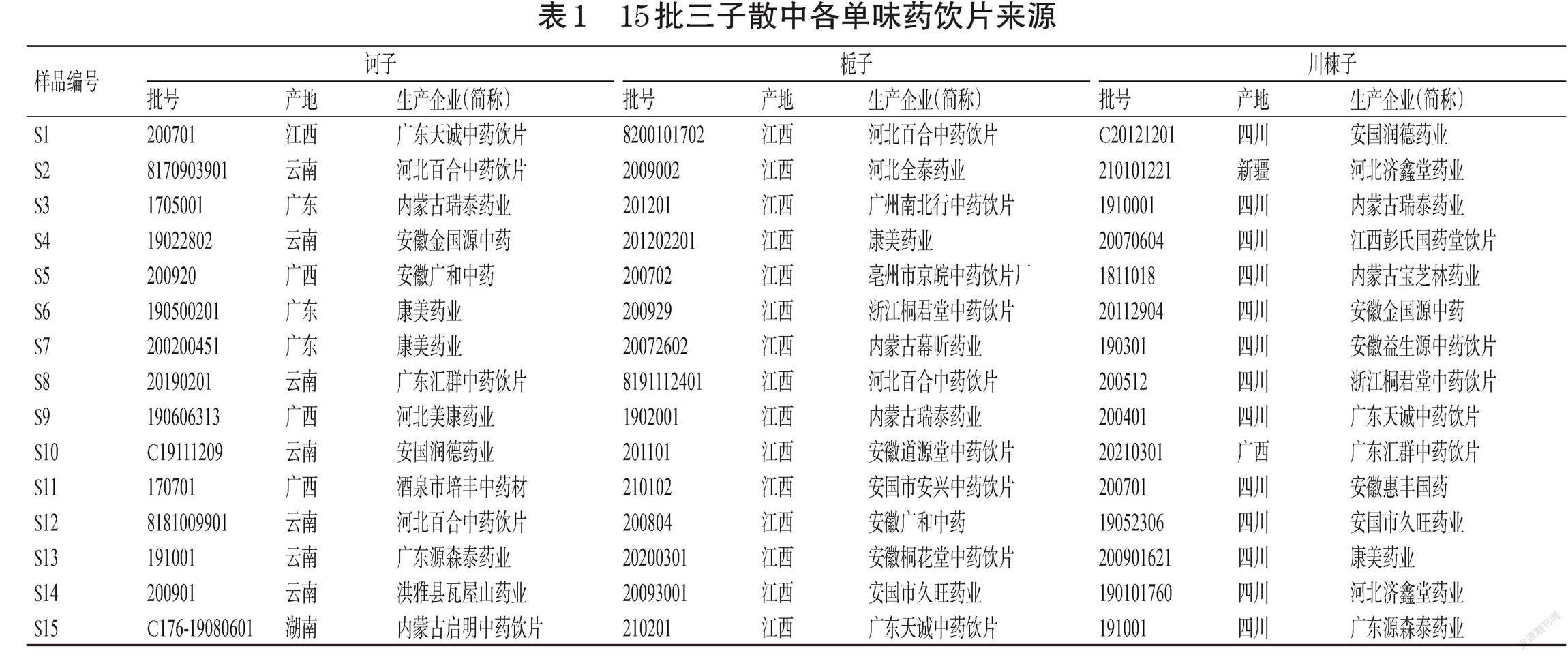
购买诃子、栀子、川楝子单味药饮片各15批,经内蒙古医科大学生药教研室张慧文博士鉴定,诃子为使君子科植物诃子Terminalia chebula Retz.的干燥成熟果实,栀子为茜草科植物栀子Gardenia jasminoides Ellis的干燥成熟果实,川楝子为楝科植物川楝Melia toosendan Sieb.et Zucc.的干燥成熟果实,均符合2020年版《中国药典》(一部)标准。将各批次单味药饮片随机取样组合得15批三子散样品(编号S1~S15),各单味药饮片来源见表1。
2 方法与结果
2.1 色谱条件
色谱柱为Ultimate® LP-C18(4.6 mm×250 mm,5 μm);流动相为0.1%甲酸溶液(A)-甲醇(B),梯度洗脱(0~5 min,1%B→5%B;5~10 min,5%B→13%B;10~24 min,13%B→23%B;24~56 min,23%B→35%B;56~78 min,35%B→47%B;78~90 min,47%B→85%B;90~100 min,85%B→90%B;100~105 min,90%B→100%B);流速为1.0 mL/min;柱温为30 ℃;进样量为10 μL;检测波长为254 nm。
2.2 溶液的制备
2.2.1 混合对照品溶液 精密称取诃子次酸、没食子酸、石榴皮鞣素、安石榴苷、jasminoside B、咖啡酸、柯里拉京、京尼平苷、诃子鞣酸、1,2,3,4,6-O-没食子酰葡萄糖、诃子林鞣酸、鞣花酸对照品适量,置于同一量瓶中,加甲醇溶解并定容,混匀,制备成混合对照品贮备液。取混合对照品贮备液逐级稀释成质量浓度分别为诃子次酸0.094 mg/mL、没食子酸0.050 mg/mL、石榴皮鞣素0.019 mg/mL、安石榴苷0.206 mg/mL、Jasminoside B 0.264 mg/mL、咖啡酸0.031 mg/mL、柯里拉京0.108 mg/mL、京尼平苷0.360 mg/mL、诃子鞣酸0.574 mg/mL、1,2,3,4,6-O-没食子酰葡萄糖0.090 mg/mL、诃子林鞣酸0.522 mg/mL、鞣花酸0.110 mg/mL的混合对照品溶液,摇匀,即得。
2.2.2 供试品溶液 称取各单味药饮片适量,分别粉碎成粗粉,过40目筛。按2020年版《中国药典》(一部)中规定的三子散验方比例(等比),精密称取各单味药饮片粉末10.0 g,混匀,即得三子散样品。精密称取上述三子散样品1.0 g,置于具塞锥形瓶中,精密加入甲醇25 mL,称定质量,超声(40 kHz,500 W)提取30 min,放至室温后再次称定质量,用甲醇补足减失的质量,摇匀,4 ℃条件避光保存;进样前经0.22 μm针式过滤器过滤,取续滤液,即得。
2.2.3 缺味阴性对照溶液 按2020年版《中国药典》(一部)中规定的三子散验方比例,以1.2 g为处方总量,分别配制不含川楝子或栀子或诃子的缺味阴性样品处方,并按“2.2.2”项下方法处理,即得各缺味阴性对照溶液。
2.2.4 单味药饮片溶液 按2020年版《中国药典》(一部)中规定的三子散验方比例,以1.2 g为处方总量,计算各单味药饮片的质量,分别按“2.2.2”项下方法处理,即得各单味药饮片溶液。
2.3 方法学考察
2.3.1 精密度试验 取三子散(S14)样品适量,按“2.2.2”项下方法制备供试品溶液,按“2.1”项下色谱条件连续进样6次,记录色谱图。以京尼平苷色谱峰(其色譜峰较稳定、分离度良好且保留时间、峰面积适中)为参照峰(S),计算各共有峰的相对保留时间和相对峰面积。结果显示,各共有峰相对保留时间的RSD均小于2.00%,相对峰面积的RSD均小于3.00%,表明所用仪器精密度良好。
2.3.2 重复性试验 取三子散(S14)样品适量,按“2.2.2”项下方法平行制备6份供试品溶液,按“2.1”项下色谱条件进样测定。以京尼平苷色谱峰为参照峰(S),计算各共有峰的相对保留时间和相对峰面积。结果显示,各共有峰相对保留时间的RSD均小于2.00%,相对峰面积的RSD均小于3.00%,表明本方法重复性良好。
2.3.3 稳定性试验 取三子散(S14)样品适量,按“2.2.2”项下方法制备供试品溶液,分别于室温下放置0、3、6、9、12、24、48 h时按“2.1”项下色谱条件进样测定。以京尼平苷色谱峰为参照峰(S),计算各共有峰的相对保留时间和相对峰面积。结果显示,各共有峰相对保留时间的RSD均小于2.00%,相对峰面积的RSD均小于3.00%,表明供试品溶液于室温下放置48 h内稳定性良好。
2.4 指纹图谱的建立及相似度评价
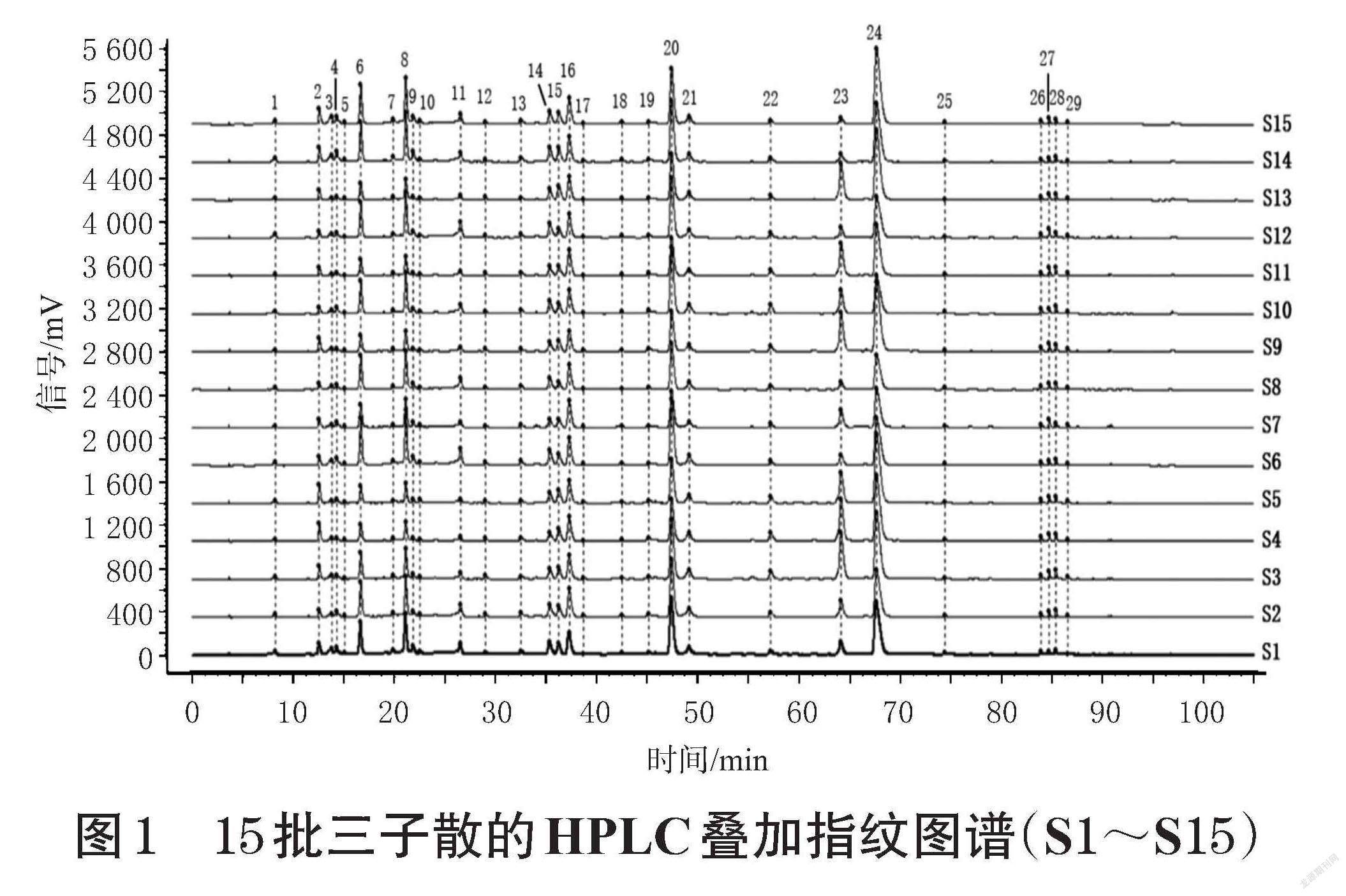
2.4.1 指纹图谱的建立 按“2.2.2”项下方法,分别制备S1~S15三子散样品的供试品溶液,按“2.1”项下色谱条件进样测定,记录色谱图。采用《中药色谱指纹图谱相似度评价系统(2012版)》处理色谱图,设定S1样品色谱图为参照图谱,设置时间窗宽度0.1 min,采用中位数法,经多点校正后Mark峰匹配生成15批三子散的HPLC叠加指纹图谱和对照指纹图谱(R),共标定了29个共有峰,详见图1、图2。
2.4.2 共有峰的指认 按“2.1”项下色谱条件,分别对混合对照品溶液和三子散(S1)供试品溶液进样分析。通过将混合对照品溶液和三子散(S1)供试品溶液HPLC图进行比对,指认出13个共有峰,分别为:峰1(诃子次酸)、峰2(没食子酸)、峰3(石榴皮鞣素)、峰6(安石榴苷A)、峰8(安石榴苷B)、峰11(jasminoside B)、峰13(咖啡酸)、峰14(柯里拉京)、峰16(京尼平苷)、峰20(诃子鞣酸)、峰22(1,2,3,4,6-O-没食子酰葡萄糖)、峰23(诃子林鞣酸)、峰24(鞣花酸),详见图3。以峰16(京尼平苷)为参照峰(S),计算各共有峰的相对保留时间和相对峰面积,详见表2、表3。
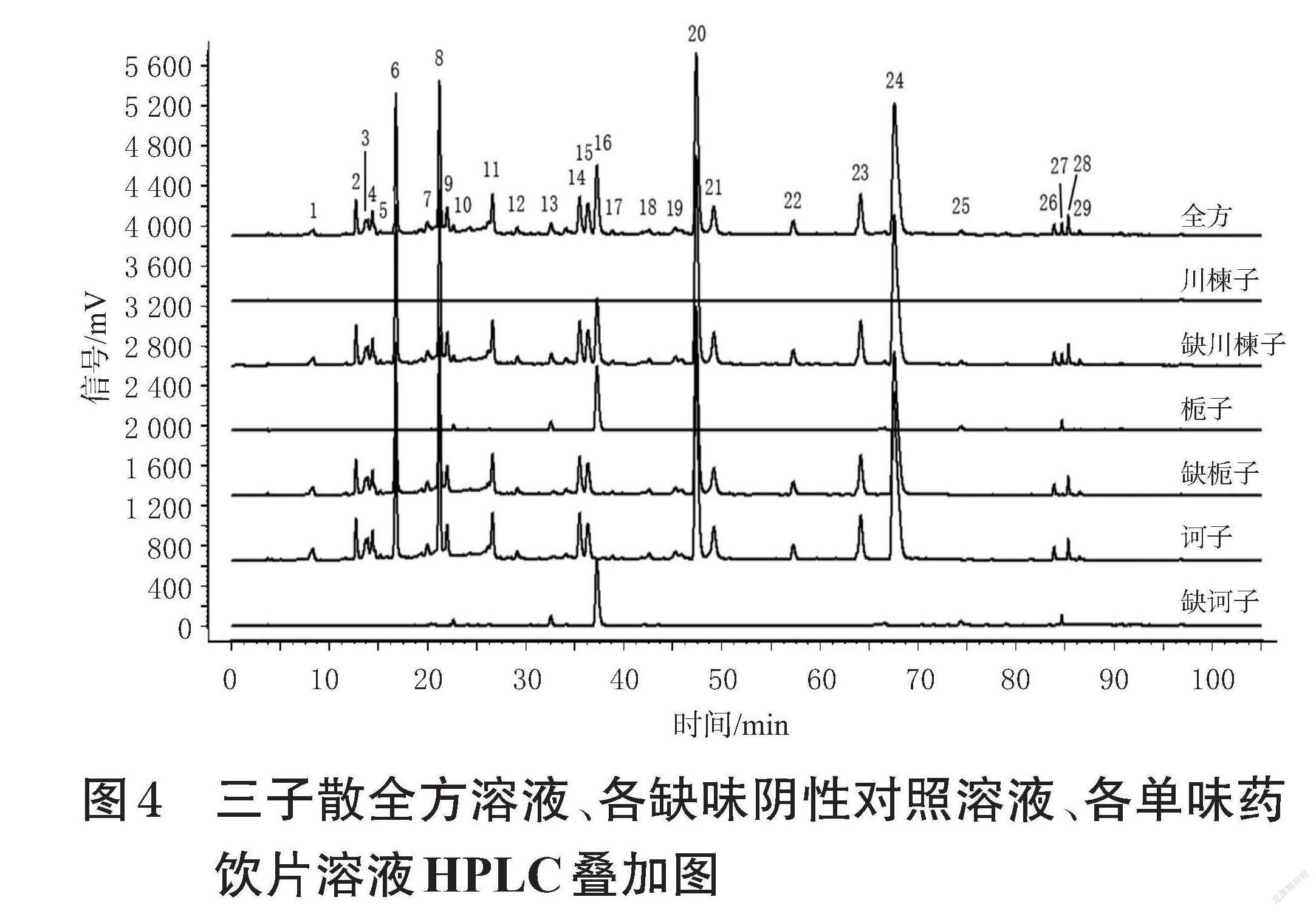
2.4.3 共有峰的归属 分别按“2.2.2” “2.2.3” “2.2.4”项下方法制备三子散全方溶液、缺味阴性对照溶液和单味药饮片溶液,并按“2.1”项下色谱条件进样测定,记录色谱图,详见图4。将三子散全方、缺味阴性对照、单味药饮片的HPLC图进行比较,对29个共有峰进行药材归属。其中,峰1~峰9、峰11、峰12、峰14、峰15、峰17~峰24、峰26、峰28、峰29为诃子专属峰,峰10、峰13、峰16、峰25、峰27为栀子专属峰;川楝子主要成分紫外吸收较弱,在当前检测条件下响应较低,未贡献峰。
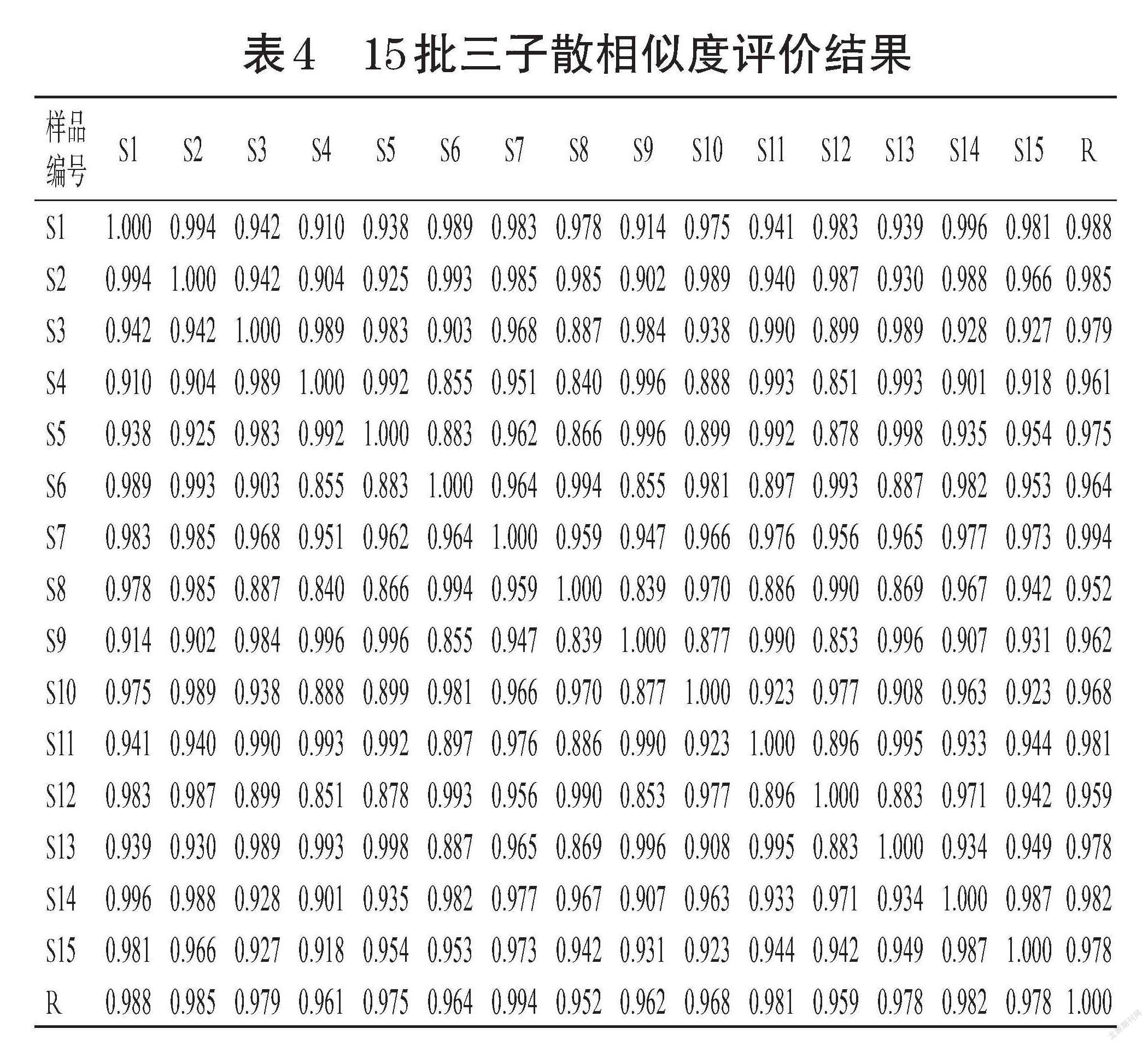
2.4.4 指纹图谱相似度评价 采用《中药色谱指纹图谱相似度评价系统(2012版)》对15批三子散的HPLC指纹图谱与对照指纹图谱(R)进行相似度评价,结果显示相似度为0.952~0.994,可见15批三子散相似度较高,详见表4。
2.5 化学模式识别分析
为了进一步区分差异性样品,寻找差异性标志物,在该指纹图谱分析结果基础上,本研究引入化学模式识别分析方法,结合两种分析方法,以求更加客观全面地评价药品质量。
2.5.1 聚类分析 将15批三子散HPLC指纹图谱在254 nm波长下的29个共有峰峰面积进行标准化处理后,导入MeV-4.9.0软件,进行聚类分析(cluster analysis,CA)与热图绘制,详见图5。由图5可知,15批三子散聚为4类:S7样品单独聚为一类,S3~S5、S9、S13样品聚为一类,S1、S2、S6、S8、S10~S12样品聚为一类,S14、S15样品聚为一类。
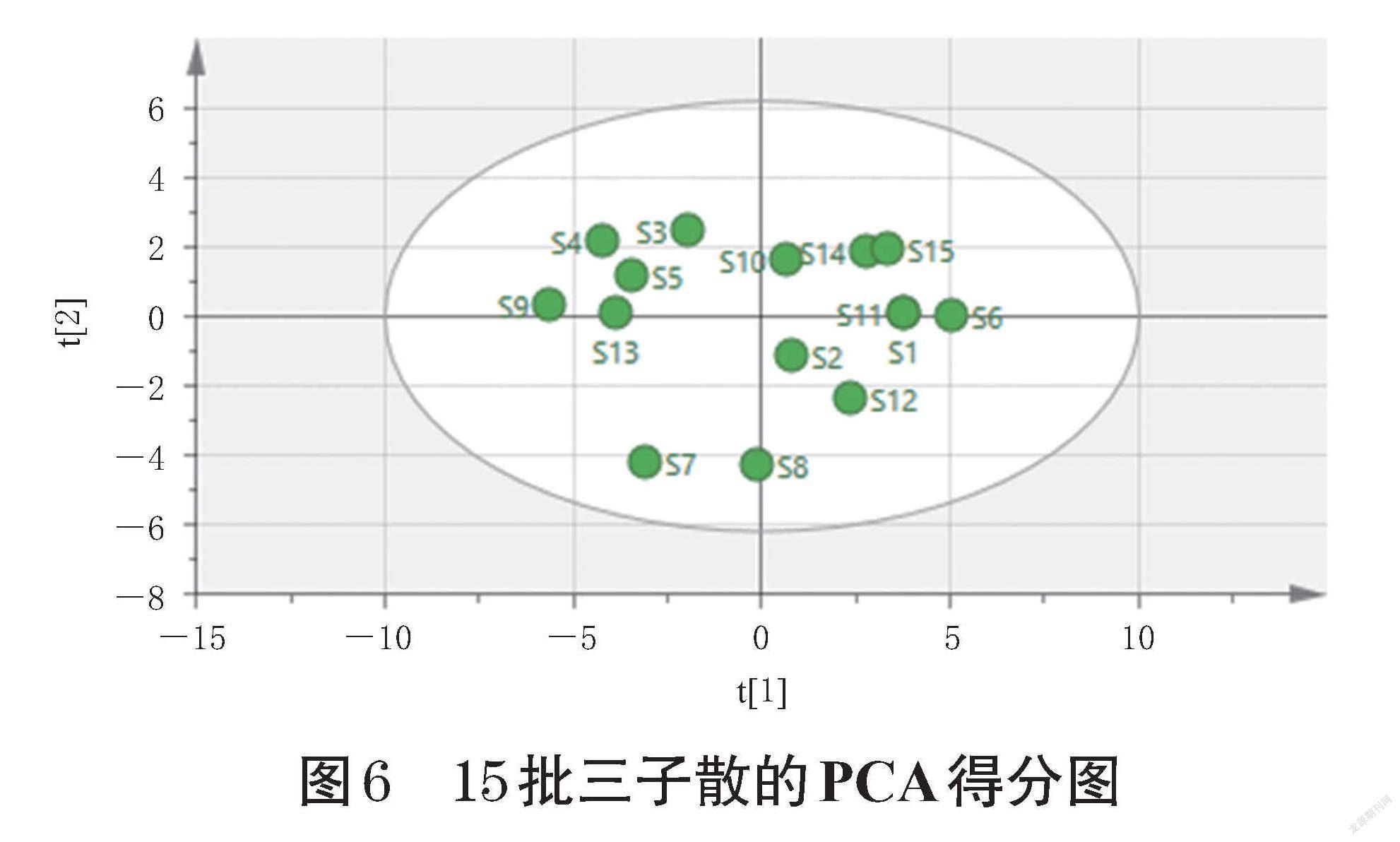
2.5.2 主成分分析 将15批三子散HPLC指纹图谱在254 nm波长下的29个共有峰峰面积进行标准化处理后,导入SIMCA 14.1软件,进行主成分分析(principal component analysis,PCA)。从29个变量中提取出6个变量,累计方差贡献率为89.03%,提示该模型的预测能力较好[17]。提取前2个主成分作PCA得分图,详见图6。结果表明,15批三子散聚为4类:S7样品单独聚为一类,S3~S5、S9、S13样品聚为一类,S1、S2、S6、S8、S10~S12样品聚为一类,S14、S15样品聚为一类。该结果与CA结果相互印证。
PCA载荷图中的点代表各共有峰,其距离原点越远,表明其权重越大,对样品质量差异影响越大[18],结果见图7。由图7可知,对第1主成分影响较大的有峰11(jasminoside B)、峰24(鞣花酸)、峰2(没食子酸)、峰15、峰23(诃子林鞣酸)、峰29,对第2主成分影响较大的有峰8(安石榴苷B)、峰9、峰18、峰14(柯里拉京)、峰6(安石榴苷A)、峰1(诃子次酸)、峰5。
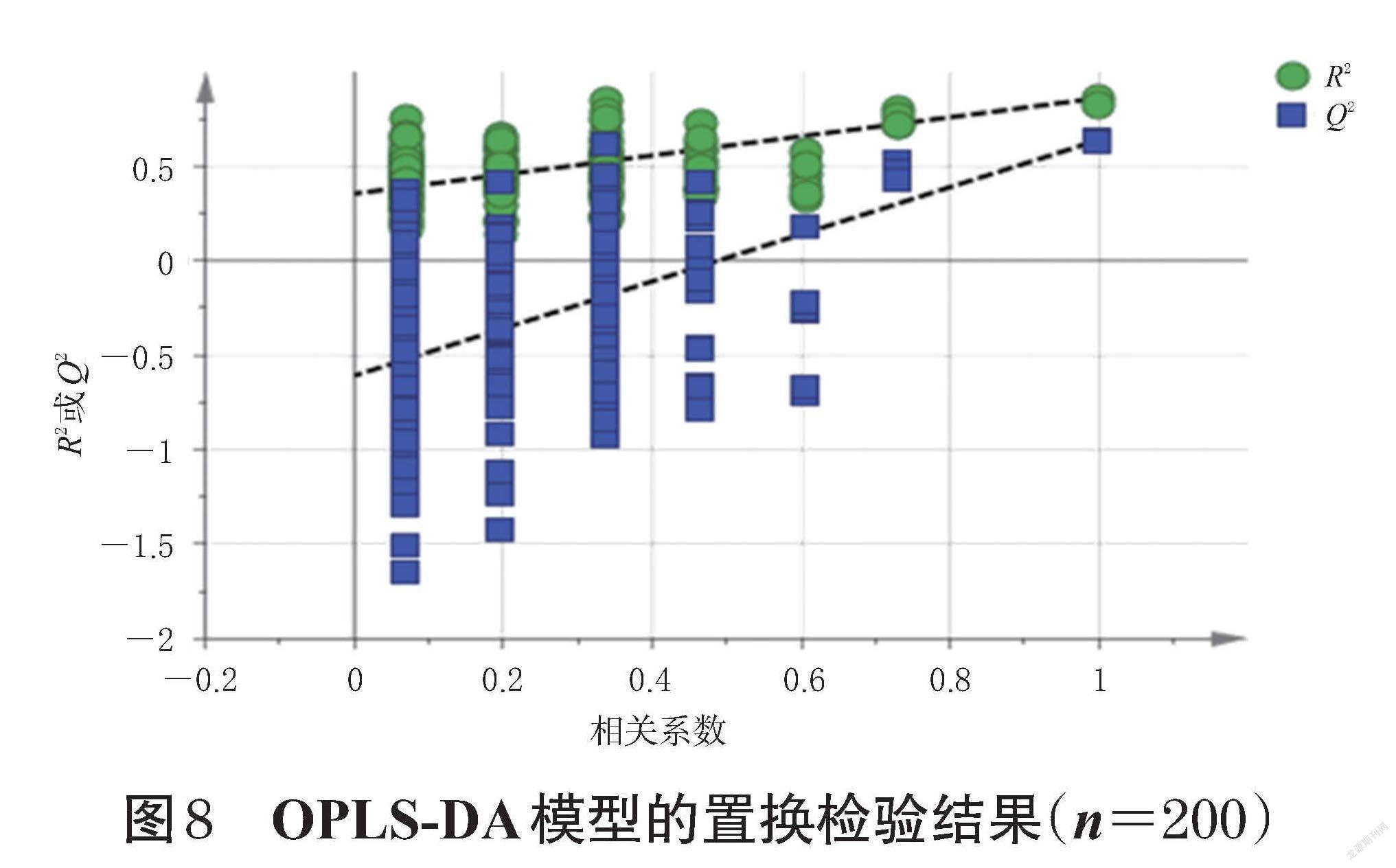
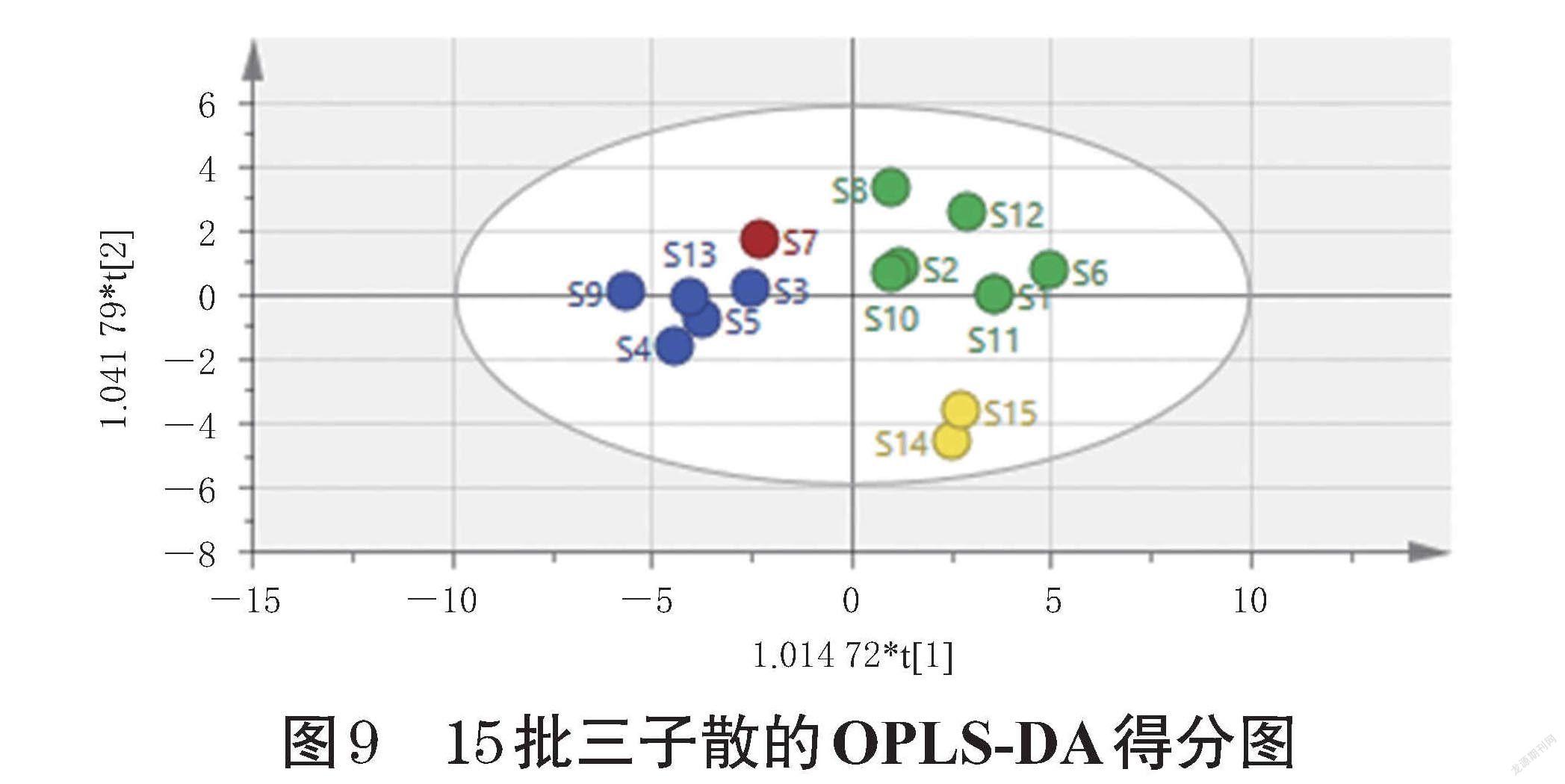
2.5.3 正交偏最小二乘法-判别分析 为进一步分析样品的批间差异性,在CA和PCA聚类的情况下,将15批三子散HPLC指纹图谱在254 nm波长下的29个共有峰峰面积进行标准化处理后,导入SIMCA 14.1软件,进行正交偏最小二乘法-判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA)。分析结果显示,OPLS-DA模型参数R2X为0.863,R2Y为0.936,Q2为0.332,说明该模型稳定性及预测能力较好[19-20]。为进一步验证该模型的有效性,利用SIMCA 14.1软件对其进行200次置换检验,检验结果见图8,所有Q2均在R2之下,且Q2的回归直线与y轴的交点在负半轴,说明该模型有效。由OPLS-DA得分图可以看出,15批样品被很好地区分为4类,详见图9。
OPLS-DA载荷图中的点离原点越远,表明对应变量权重值越大[21]。OPLS-DA载荷图见图10,可知对第1主成分影响较大的有峰2(没食子酸)、峰24(鞣花酸)、峰23(诃子林鞣酸)、峰29、峰27,对第2主成分影响较大的有峰1(诃子次酸)、峰8(安石榴苷B)、峰9、峰6(安石榴苷A)、峰3(石榴皮鞣素)、峰11(jasminoside B)、峰4、峰18、峰14(柯里拉京)。提取的29个变量中,变量投影重要性(variable importance in the projection,VIP)值大于1,说明该变量对整体模型的贡献度高于平均水平,可作为筛选具有显著贡献变量的标准[22]。OPLS-DA VIP值图见图11,可知VIP值>1且误差线不超过原点的变量有14个,排列顺序为峰1(诃子次酸)>峰2(没食子酸)>峰8(安石榴苷B)>峰9>峰6(安石榴苷A)>峰24(鞣花酸)>峰3(石榴皮鞣素)>峰11(jasminoside B)>峰4>峰18>峰23(诃子林鞣酸)>峰29>峰14(柯里拉京)>峰27。两种方法的结果结合,可作为判定标准筛选差异性标志物。
3 讨论
3.1 提取条件的考察
在供试品溶液制备过程中,分别考察了超声、加热回流2种提取方法,甲醇、70%甲醇、50%甲醇、30%甲醇、水5种不同提取溶剂,15、30、45 min 3种不同提取时间对三子散有效成分提取的影响。综合色谱峰数量、响应值和实验经济性等因素考虑,确定采用甲醇为提取溶剂、超声提取30 min作为供试品溶液的处理方法。
3.2 色谱条件的优化
在指纹图谱方法研究过程中,分别对甲醇-水、乙腈-水、甲醇-0.1%磷酸溶液、甲醇-0.1%甲酸溶液等流动相进行考察。综合实验经济性、色谱图基线平稳水平和基线分离程度,最终确定甲醇-0.1%甲酸溶液为流动相,并对洗脱梯度条件进行优化。依次考察了25、30、35、40 ℃柱温,结果表明柱温变化对色谱峰的峰形、保留时间影响较小,根据本课题组前期实验基础[23],最终选择柱温为30 ℃。
采用全波长扫描,通过色谱峰数目和响应值大小进行筛选,分析发现,在254 nm波长条件下,三子散HPLC指纹图谱基线较平稳,共有峰数量较多且具有较高的响应值,故选择254 nm為HPLC指纹图谱的检测波长。
3.3 指纹图谱研究
中药材成分复杂,受不同生长环境、生长期、采收期以及加工、炮制方法等多方面的影响,其内在质量会有很大差异。本实验在生成对照指纹图谱时采用中位数法,可弥补用平均数法易受个别超常样本影响的缺点,使生成的对照图谱更具代表性[24]。
本实验在前期实验基础及刘昌孝院士等[25]提出的“中药质量标志物”概念基础上,从化学成分特有性、传统功效和化学成分可测性等方面对三子散质量标志物进行预测分析,选择与中药质量特性密切相关的标志物,建立三子散HPLC指纹图谱,确定29个共有峰,并指认出其中的诃子次酸、没食子酸、石榴皮鞣素、安石榴苷A、安石榴苷B、jasminoside B、咖啡酸、柯里拉京、京尼平苷、诃子鞣酸、1,2,3,4,6-O-没食子酰葡萄糖、诃子林鞣酸、鞣花酸13个化学成分。15批三子散各共有峰相对保留时间的RSD为0.021%~0.680%,表明其化学组成一致性较好;各共有峰相对峰面积的RSD为15.793%~70.853%,提示15批三子散的某些共有化学成分含量有所差异。各批次样品图谱与对照图谱的相似度结果均不低于0.952,表明各批次三子散化学组成一致性较好。
经与各缺味阴性对照、单味药饮片HPLC图比对,诃子、栀子的色谱峰得到较充分表征,但川楝子并未贡献色谱峰。这是由于三子散为各单味药饮片等比配比的复方制剂,在现有实验条件下,相比于诃子、栀子,川楝子主要成分为柠檬苦素型三萜类化合物,多为弱紫外吸收或无紫外吸收,响应低、干扰大,很难达到理想的基线分离[26]。当前实验条件下,本研究对于三子散的质量控制仍存在不足,本课题组后期将在此研究基础上兼顾质量标志物,通过液质联用或其他多种检测器串联的测定方法建立相对全面的三子散指纹图谱或其他质控方法,不断完善三子散质量控制研究。
3.4 化学模式识别
CA与PCA结果一致,均可将15批三子散聚为4类,即S7样品单独聚为一类,S3~S5、S9、S13样品聚为一类,S1、S2、S6、S8、S10~S12样品聚为一类,S14、S15样品聚为一类,表明15批三子散的质量存在差异。OPLS-DA结果筛选出14个导致批次间质量差异的差异性标志物,现已指认出酚酸类化合物没食子酸(峰2),鞣质类化合物诃子次酸(峰1)、安石榴苷A(峰6)、安石榴苷B(峰8)、鞣花酸(峰24)、石榴皮鞣素(峰3)、诃子林鞣酸(峰23)、柯里拉京(峰14)与单萜苷类化合物jasminoside B(峰11)。现代研究发现,酚酸类化合物如没食子酸具有抗氧化、抗炎及降糖调脂等作用[27];鞣质类化合物具有抗炎、降血糖、抗氧化、抗肿瘤等药理作用[28];同时,相关诃子研究报道也从诃子化学成分、药理作用、植物亲缘学及化学成分特有性、传统功效、药性、新临床用途和药动学等方面分析论证,预测没食子酸、鞣花酸和诃子酸可能是诃子质量标志物[29]。相关栀子研究基于化学成分的可测性,预测单萜苷类成分是栀子质量标志物的重要选择[30]。以上研究报道皆与本实验结果相印证,提示在三子散生产过程中应着重关注以上差异性标志物的变化,从而控制药品质量。然而峰4、峰5、峰7、峰9、峰10、峰12、峰15、峰17~峰19、峰21、峰25~峰29暂未指认,后期研究拟采用液质联用等技术对未识别的成分进行鉴定,以期更系统、全面地对三子散进行质量控制。
综上所述,本研究所建立的三子散HPLC指纹图谱分析方法高效、稳定,结合化学模式识别技术可用于三子散的质量控制,同时为更多蒙古族验方质量控制方法的建立提供参考。
参考文献
[ 1 ] 国家药典委员会.中华人民共和国药典:一部[S]. 2020年版.北京:中国医药科技出版社,2020:512-513.
[ 2 ] 宇妥·元丹贡布.四部医典:蒙古文版[M].呼和浩特:内蒙古人民出版社,1978:1005.
[ 3 ] 《蒙古学百科全书》编辑委员会.蒙古学百科全书:医学[M].呼和浩特:内蒙古人民出版社,2012:287-288.
[ 4 ] 都格尔,瑞图雅.三籽汤对微型白细胞比例和数量的影响[J].中国蒙医药(蒙),2008,3(2):59-60.
[ 5 ] 都格尔,金花.三子汤对平均红细胞体积的影响[J].中国蒙医药(蒙),2008,3(3):68-69.
[ 6 ] 吴哈达,都格尔,金花.蒙药三子汤的研究进展与展望[J].中国民族医药杂志,2015,21(9):49-51.
[ 7 ] 陈呼格吉勒图,金花.蒙药-三子汤治疗高脂血症的研究概况[J].中国蒙医药杂志,2010,5(12):17-20.
[ 8 ] 金花,都格尔.放血疗法前服三子汤对血液流变学影响的临床研究[J].内蒙古医科大学学报,2012,7(2):124-131.
[ 9 ] 李艳春,胡志忠,罗素琴,等.蒙药三子散中还原糖的含量测定[J].内蒙古医学院学报,2010,32(6):551-553.
[10] 刘素梅,方忠意,韩立,等.三子散中川楝子的鉴别及栀子苷的含量测定[J].中国兽药杂志,2013,47(3):38-40.
[11] 那顺白乙拉,孟和,王苏宁. HPLC-MS法测定三子散中川楝素的含量[J].中国民族民间医药,2017,26(6):23-24.
[12] 王思文,娜仁图雅,籍学伟. HPLC法测定蒙成药三子散中没食子酸的含量[J].北方药学,2021,18(1):21-24.
[13] 张建平,王栋,周雪梅,等.高效液相色谱法测定蒙成药三子散中川楝素含量[J].中国民族医药杂志,2021,27(2):38-42.
[14] 杜文亚,云冠群,张建平. HPLC-ELSD法测定蒙成药“三子散”中川楝素含量[J].中国民族医药杂志,2021,27(5):38-41.
[15] 何春龙,白玉琴,雷露静,等.一测多评法测定蒙成药三子散中4种成分的含量[J].天然产物研究与开发,2017,29(5):805-809.
[16] 刘宏,雷露静,白玉琴,等.一测多评法同时测定蒙药三子散中7种指标成分[J].中国实验方剂学杂志,2017,23(18):58-63.
[17] 徐锋,杨澜,成婷婷,等.地瓜藤的UPLC指纹图谱建立及聚类分析、主成分分析[J].中國药房,2019,30(24):3388-3392.
[18] 张欣舒,董金香,杨净尧,等.经典名方保元汤物质基准指纹图谱及多指标量值传递研究[J].药物分析杂志,2021,41(2):345-358.
[19] 闫凯莉,尹程程,刘梦瑶,等.芩连润肺汤的HPLC指纹图谱建立、含量测定及多元统计分析[J].中国药房,2021,32(16):1956-1963.
[20] 陈朴,于燕波,黄贱英,等.运动员与体力劳动者代谢组学判别模型的建立[J].波谱学杂志,2016,33(3):395-405.
[21] 管咏梅,万鑫浩,吴文婷,等.经典名方桂枝加葛根汤标准汤剂HPLC指纹图谱研究[J].中草药,2021,52(18):5535-5542.
[22] 贾小舟,杨小龙,卢晓莹,等.基于超高效液相色谱-质谱联用技术和化学计量学方法比较白芥子炒制前后的化学成分[J].中国药房,2021,32(22):2731-2735.
[23] 夏慧敏,张慧文,白云霞,等. HPLC指纹图谱技术结合灰色关联度法评价不同批次诃子质量[J].中国现代应用药学,2020,37(12):1448-1453.
[24] 肖蓉,张志斐,袁志芳,等.河北道地药材黄芩指纹图谱的研究[J].药物分析杂志,2007,27(7):1018-1023.
[25] 刘昌孝,陈士林,肖小河,等.中药质量标志物(Q-Marker):中药产品质量控制的新概念[J].中草药,2016,47(9):1443-1457.
[26] 张春泥,王英姿,孙欣光,等. HPLC-CAD结合化学计量学的川楝子饮片指纹图谱研究[J].药学学报,2017,52(3):456-461.
[27] 王晨晓.基于高内涵分析技术的绒毛诃子肝毒性及毒性物质研究[D].北京:北京中医药大学,2020.
[28] 朱萱萱,白璐,刘晓谦,等.近十年来中药鞣质的研究进展[J].中国中药杂志,2021,46(24):6353-6365.
[29] 赵鹿,廖翠萍,杨秀娟,等.诃子的研究进展及质量标志物的预测[J].中草药,2020,51(10):2732-2744.
[30] 史永平,孔浩天,李昊楠,等.栀子的化学成分、药理作用研究进展及质量标志物预测分析[J].中草药,2019,50(2):281-289.
(收稿日期:2021-09-21 修回日期:2021-12-07)
(编辑:曾海蓉)
基金项目:内蒙古自治区科技计划项目(No.2021GG0176);内蒙古自治区自然科学基金项目(No.2019MS08157);内蒙古自治区高等学校科学研究项目(No.NJZZ19089)
硕士研究生。研究方向:中蒙药质量控制与药效物质基础。E-mail:lyyybyq@qq.com
通信作者:教授,硕士生导师。研究方向:中蒙药质量控制与药效物质基础。电话:0471-6653169。E-mail:whuanyun999@163.com
