血清CD4+/CD8+、PCT及KL-6水平与局部晚期NSCLC放疗后放射性肺炎严重程度的相关性研究
2022-02-19崔晶娴董业峰葛仁美
崔晶娴,董业峰,陈 烨,黄 霞,刘 颖,葛仁美
肺癌为我国发病率较高的恶性肿瘤,每年新增病例超过70万[1]。非小细胞肺癌(non-small cell lung cancer,NSCLC)为肺癌发病的主要类型,多数患者确诊时已处于局部晚期,错失手术最佳治疗时机,放射治疗为局部晚期NSCLC 主要治疗方式[2]。放射性肺炎为放疗严重并发症,重症放射性肺炎会导致患者发生不可逆性肺功能变化,临床尚无有效防治方法[3]。早期识别重症放射性肺炎并对其进行干预,对有效改善患者治疗结局具有重要价值。T淋巴细胞为构成免疫系统重要组成,参与炎症反应与细胞免疫过程;降钙素原(Procalcitonin,PCT)是与机体感染密切相关的炎性标志物;涎液化糖链抗原(Krebs Von den Lungen-6,KL-6)对肺泡上皮与肺间质损伤程度具有较高的敏感性,为诊断间质性肺炎特异性标志物。有研究指出,放射性肺炎患者放疗后分化决定族抗原4+(Cluster of Differentiation 4+,CD4+)/分化决定族抗原8+(Cluster of Differentiation 8+,CD8+)降低,PCT 与KL-6 水平升高[4-5],但与重症放射性肺炎发病关系尚不明确。本研究通过比较不同程度放射性肺炎患者放疗前后的血清CD4+/CD8+、PCT、KL-6 水平,分析其含量对局部晚期NSCLC患者放疗后重症放射性肺炎的价值。
1 资料与方法
1.1 一般资料 选取2019 年5 月-2021 年3 月海安市人民医院收治的103 例局部晚期NSCLC 患者。纳入标准:①符合《非小细胞肺癌术后辅助治疗中国胸外科专家共识(2018 版)》标准[6],且经病理检查判断为局部晚期;②接受放疗治疗;③患者知情同意且随访时间超过半年。排除标准:①血液系统疾病患者;②IV期广泛转移患者;③胸部放疗史患者;④急慢性轧染疾病及骨髓抑制患者;⑤精神疾病患者;⑥预生存期不足3 个月患者。患者病理资料显示:腺癌61 例,鳞癌36 例,其他类型6 例;接受同步放疗14例,序贯放疗89例;照射剂量<60Gy 40例,≥60Gy 63 例。根据放疗后放射性肺炎评估结果分组:未发生放射性肺炎作为对照组,共54例;发生放射性肺炎且分级在1~2 级作为轻症组,共31 例;分级≥3 级患者作为重症组,共18 例。本研究经我院伦理委员会批准,全部患者均知情同意。
1.2 方法 血清检测方法:于患者放疗前后分别抽取其静脉血离心处理,取血清冷冻保存;采用流式细胞仪检测CD4+、CD8+含量并计算CD4+/CD8+比值,全自动电化学发光分析仪(罗氏,型号e602)电化学夹心发光法检测PCT水平,全自动免疫分析仪测定KL-6水平;操作均严格参照说明书。
放疗前后对患者进行卡氏行为状态(Karnofsky,KPS)检查;采用肺功能仪(Sensormedi cs 公司,型号2200)检测第一秒用力呼气容积(Forced expiratory volume in one second,FEV1)、用力肺活量(Forced vital capacity,FVC),并计算FEV1/FVC比值。
1.3 放射性肺炎判断标准[7]参考美国肿瘤放疗与欧洲治疗研究协作组诊断分级,将放射性肺炎分为0~5级:放疗后症状体征无变化为0级;患者表现为轻度干咳、劳累时有呼吸困难为1 级;持续咳嗽需要麻醉止咳药治疗或稍作活动即出现呼吸困难,休息时无症状为2 级;重度咳嗽,使用麻醉止咳药无效果或休息时也表现呼吸困难,或影像学检查证实放射性肺炎,或需要间断吸氧或类固醇治疗为3级;患者表现严重呼吸功能不全或需持续吸氧、辅助通气等治疗为4级;严重威胁生命为5级。
1.4 统计学处理 采用SPSS 20.0软件分析数据,计量资料以均数±标准差()表示,两组间比较采用t检验,多组间比较采用方差分析,组间两两比较使用SNK-q 检验;计数资料用[n(%)]表示,χ2检验;采用Logistic 回归模型进行多因素分析,P<0.05 有统计学意义。
2 结果
2.1 三组患者一般资料比较 三组患者的性别、年龄等一般资料对比,差异无统计学意义(P>0.05)。见表1。
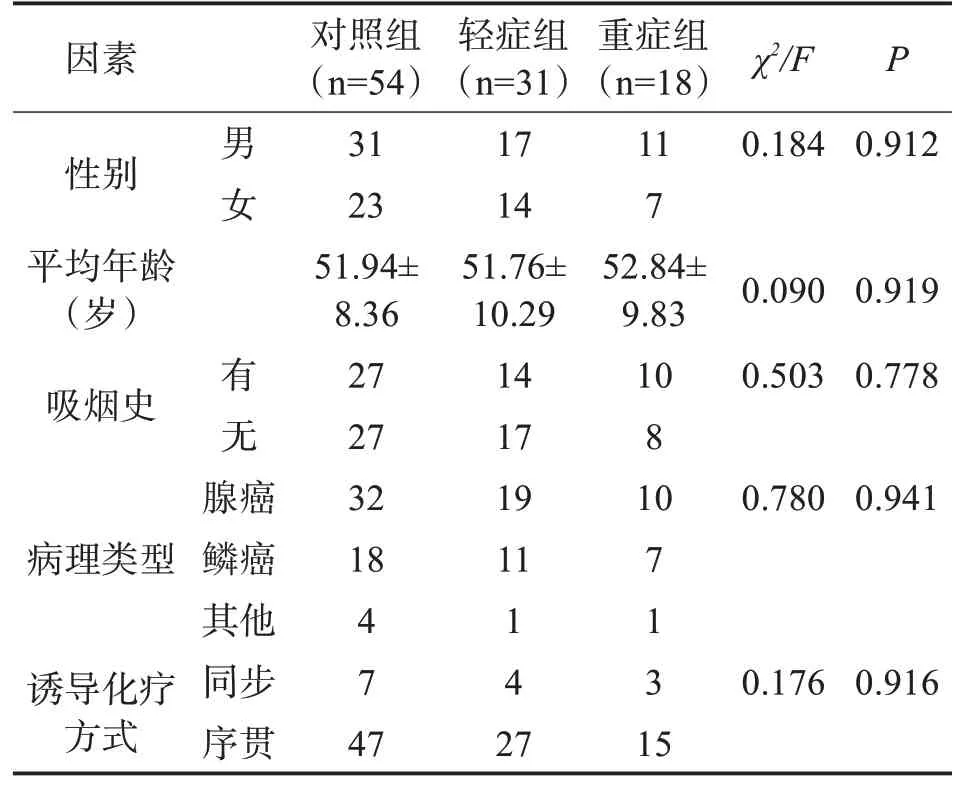
表1 三组患者一般资料比较
2.2 影响重症放射性肺炎的单因素分析 三组放疗前KPS 评分、FEV1/FVC、照射剂量<60Gy 比例、放疗后CD4+/CD8+、放疗后PCT、放疗后KL-6比较,差异具有统计学意义(P<0.05);其中重症组放疗前KPS评分、FEV1/FVC、照射剂量<60Gy比例及放疗后CD4+/CD8+低于对照组与轻症组;且轻症组放疗前KPS评分、FEV1/FVC、照射剂量<60Gy比例及放疗后CD4+/CD8+低于对照组;而重症组放疗后PCT、放疗后KL-6高于对照组与轻症组,且轻症组放疗后PCT,放疗后KL-6高于对照组(P<0.05)。单因素分析提示,放疗后血清CD4+/CD8+、PCT、KL-6 水平、放疗前KPS评分、FEV1/FVC、照射剂量连续变量为重症放射性肺炎的可疑危险因素。见表2。
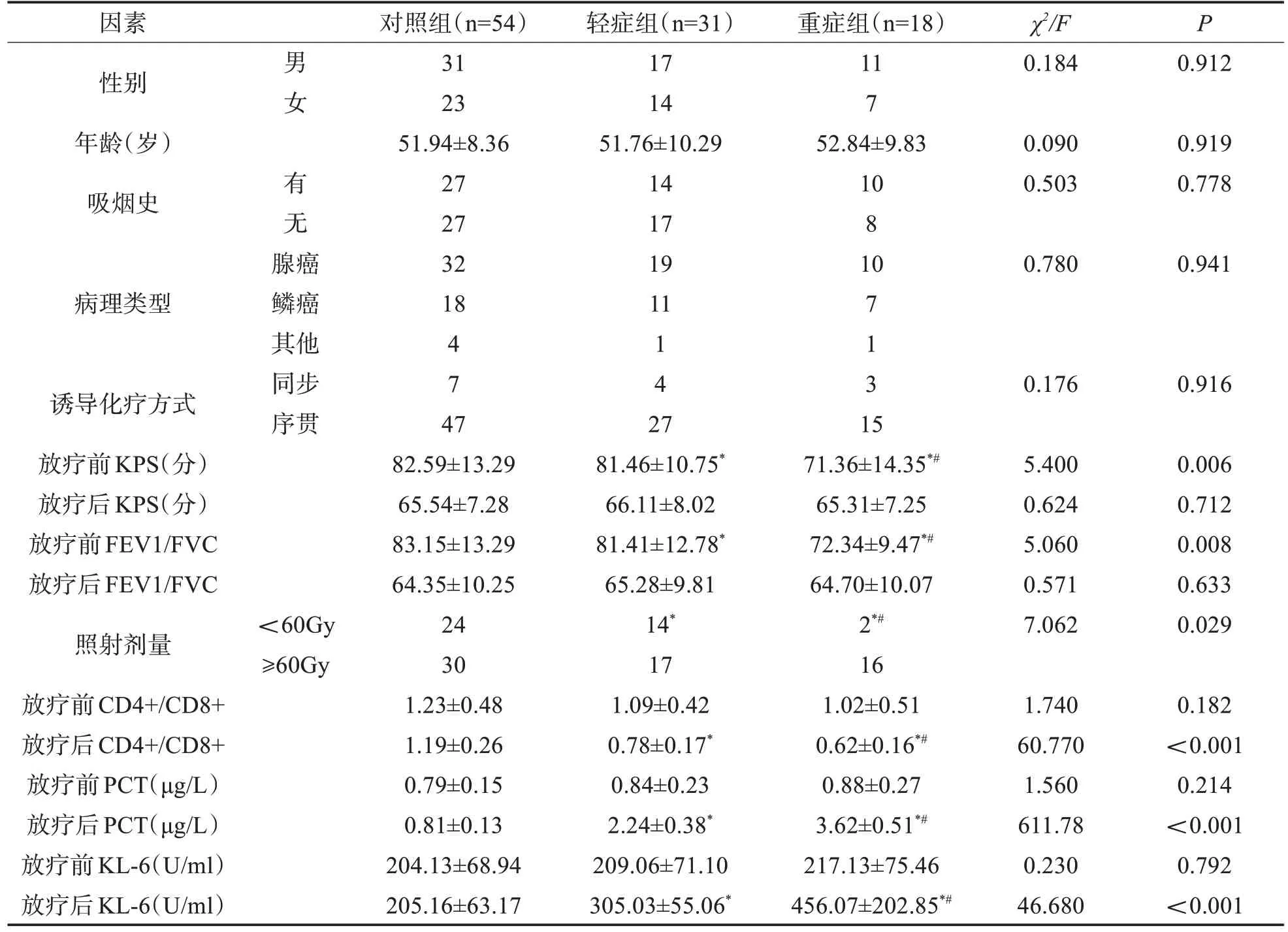
表2 重症放射性肺炎单因素分析
2.3 重症放射性肺炎的多因素分析 将重症放射性肺炎作为自变量,放疗后血清CD4+/CD8+、PCT、KL-6 水平、放疗前KPS 评分、FEV1/FVC、照射剂量连续变量根据其中位数值转变为二分类变量,经Logistic 分析显示,放疗后血清CD4+/CD8+下降、PCT、KL-6 水平升高、照射剂量≥60Gy 为重症放射性肺炎的独立危险因素(P<0.05)。见表3。
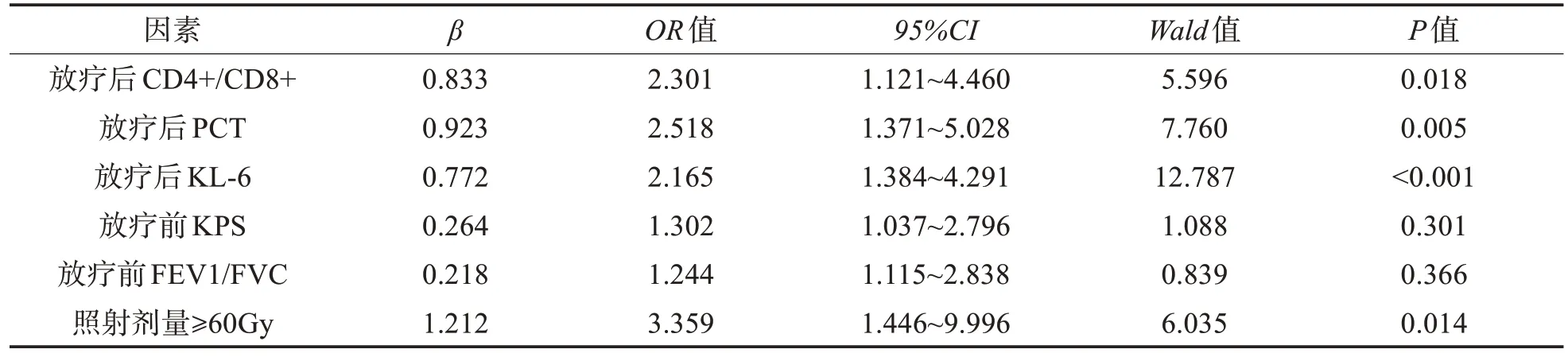
表3 重症放射性肺炎的多因素分析
3 讨论
局部晚期NSCLC 发病率目前呈上升趋势,放疗为其常见治疗手段。随着放疗发展而广泛应用于临床,目前放疗为恶性肿瘤有效治疗方式,其中放射性肺炎为放疗期间较为严重并发症,多发生于放疗后6 个月内,其中放疗后2~3 个月为发病高峰期,加重病情而降低治疗效果[8-9]。放射性肺炎与放射线损伤密切相关,1 级患者无需处理,2 级症状相对较轻,较小影响NSCLC 治疗效果;3 级及以上的患者可对肺功能造成无法逆转的损伤,延误治疗且影响患者预后[10]。故放疗期间早期发现重症放射性肺炎并及时采取干预手段能有效预防疾病发生并改善患者治疗结局。放射性肺炎发病机制较为复杂,且目前临床尚未明确其机制,患者自身病情、放射物理与生物学因素等为该病发生影响因素。生物学因素与放射线肺炎间的发病关系得到证实,是放射线作用于肺组织引发细胞因子分泌与基因表达等而激活机体炎症反应、免疫应答等改变放射线肺炎有关的病理。临床较多文献指出,胸部放疗期间会大量生成促炎细胞与促纤维化因子,且持续生成该类因子对肺脏组织有急性或迟发性损伤[11]。
T淋巴细胞参与免疫反应,正常状态下,CD4+、CD8+含量处于正常范围。CD4+可发挥抗感染免疫功效,CD8+参与细胞毒反应,T 淋巴细胞指标含量随免疫功能变化,检测其指标含量能有效反映患者预后状况[12]。CD4+/CD8+可很好反映宿主细胞调节平衡,比值上升能辅助诱导T 细胞增加,抑制细胞毒性T 细胞减少,提高机体对突变细胞识别与消灭力,减缓癌细胞恶化。比值下降说明免疫能力下降,机体发生恶性肿瘤可引起CD4+、CD8+T细胞紊乱。PCT 为降钙素的前肽,是由116 个氨基酸残基组成的糖蛋白,在外界环境中的稳定性较好,不易降解;当机体未发生炎症感染情况,血清PCT 水平较低,当发生炎症感染,PCT 水平显著上升,并于感染1 周时间内达到峰值[13]。研究指出,PCT 为感染特异性指标,机体感染后肝脏巨噬细胞、肺肠淋巴与内分泌细胞可分泌PCT 而升高其水平。自身免疫炎症或发生病毒感染时,机体PCT水平并未升高,故PCT 被认定为具有一定价值的炎症标志物,与感染程度、预后有关。KL-6 为高分子量糖蛋白,在多种上皮细胞表面表达,尤其是再生II型肺泡上皮细胞表面[14]。血清KL-6 被证实为诊断间质性肺病的敏感标记物,该蛋白是一种肺成纤维细胞潜在物质,可促进增殖、抗凋亡,其作用与成纤维细胞、血小板源性生长因子类似[15]。KL-6 对成纤维细胞产生胶原蛋白I 和III、诱导其分化为肌成纤维细胞有促进作用,进而转变为上皮间质,诱导产生细胞外基质成分;且KL-6 能抑制成纤维细胞表达,使细胞外基质过度重塑沉积而出现肺纤维化。本研究显示,放疗后重症组血清CD4+/CD8+低于对照组与轻症组,PCT、KL-6水平高于对照组与轻症组,说明重症放射性肺炎患者体内免疫功能下降,炎症加重。近年来国内外多项关于放射线肺炎因素的研究显示,KSP 评分、治疗方式、放射剂量等与重症放射性肺炎密切相关[16],放射剂量与放疗前肺功能变化也与放射线肺炎有关。本研究中,重症组患者放疗前KPS评分、FEV1/FVC低于对照组和轻症组,照射剂量更高,与姚元虎[17]等人研究结果一致。基于单因素结果进一步行Logistic 分析,放疗后血清CD4+/CD8+下降、PCT、KL-6 水平升高及照射剂量≥60Gy 为影响重症放射性肺炎的独立危险因素,说明血清血清CD4+/CD8+下降,PCT、KL-6水平升高,照射剂量≥60Gy 患者发生重症放射性肺炎的几率越高。对于照射剂量≥60Gy 的局部晚期NSCLC 患者需警惕发生重症放射性肺炎,经检测放疗前后血清CD4+/CD8+、PCT、KL-6 水平对预测重症放射性肺炎有重要临床价值[18]。
综上所述,放疗结束后局部晚期NSCLC 患者血清CD4+/CD8+下降,PCT、KL-6水平上升,照射剂量≥60Gy 极易发生重症放射性肺炎,对预测重症放射性肺炎发生具有重要价值。
