妊娠中晚期患者在体外循环下行心血管手术的麻醉管理*
2022-02-19钟河江蒋学涛杜智勇
陈 芳,钟河江,蒋学涛,李 洪,杜智勇
(陆军军医大学新桥医院麻醉科,重庆 400037)
妊娠期合并心血管疾病的发病率为1.0%~2.0%,占孕产妇死亡的15%[1],是孕产妇非产科因素死亡的首要原因,即使在发达国家,总体死亡人数也无明显下降[2]。由于孕产妇行心脏手术的发病率和死亡率高,大多数合并心血管疾病的孕产妇首选内科保守治疗,但治疗无效或不合适时,孕产妇需接受心脏外科手术干预[1,3]。对于这类高风险患者的围术期麻醉管理,在确保母体安全的情况下,还应充分考虑麻醉药物及体外循环等因素对胎儿的影响,这对围术期管理提出了更高的要求。本文回顾了近年来本院7例妊娠中晚期合并心血管疾病患者在体外循环下进行心血管手术的临床资料,探讨孕产妇在体外循环下行心血管手术的麻醉管理策略及对胎儿术后转归的影响。
1 资料与方法
1.1 一般资料
选取2016年1月至2019年9月本院妊娠期合并心血管疾病患者在体外循环下行心血管手术7例,年龄21~32岁,平均(27±4)岁;初产妇4例,经产妇3例;入院孕周25~37周,孕中期1例,孕晚期6例。所有患者术前均常规产检。7例患者中,3例先行心脏瓣膜置换术,术后继续妊娠,待胎儿成熟后再终止妊娠,其余4例为剖宫产术与心血管手术同期进行。患者的基本临床资料见表1。本研究经医院伦理委员会批准(2020-研第101-01),患者及家属均知情同意。
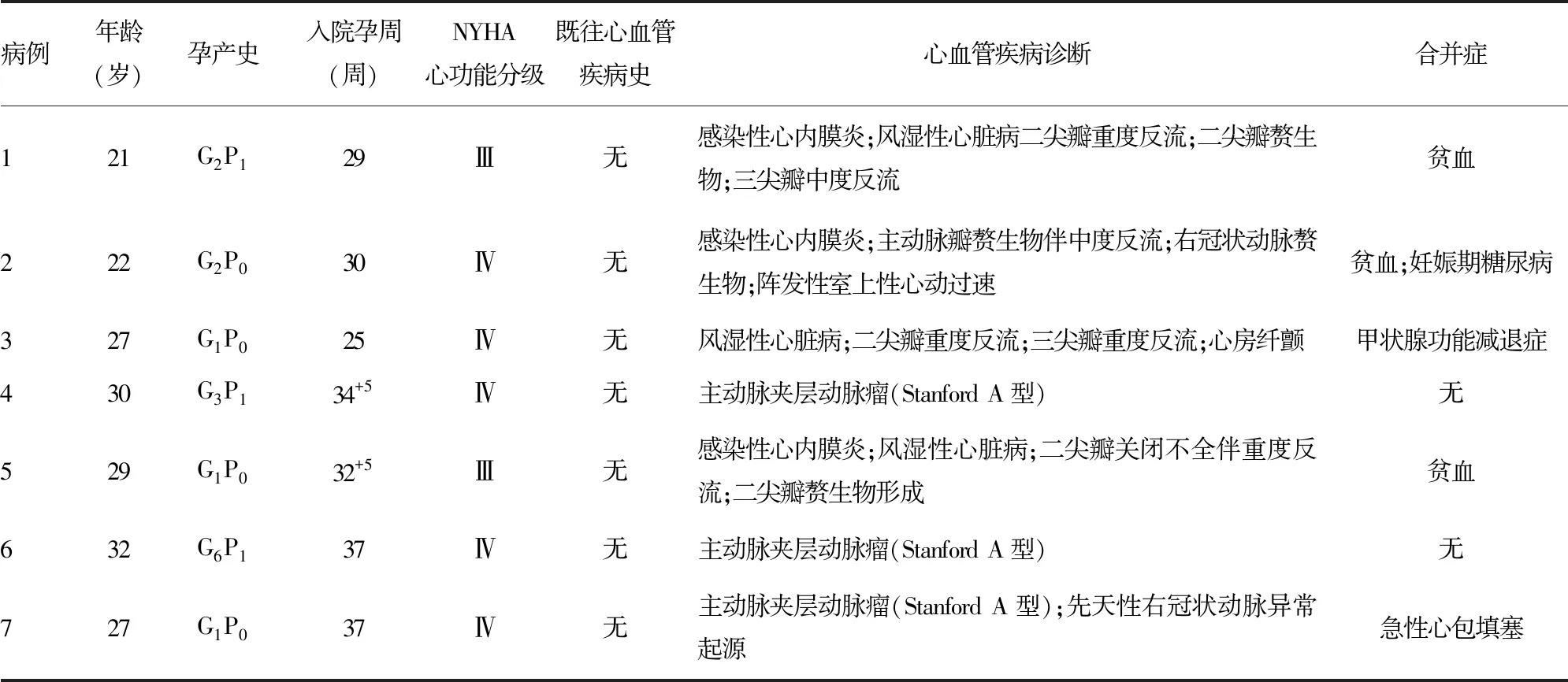
表1 患者的一般临床资料
1.2 方法
1.2.1麻醉管理
对于继续妊娠患者,入室后采用仰卧位并抬高右侧髋部或左倾斜15°,在局部麻醉下行桡动脉与右颈内静脉穿刺置管。根据患者病情,必要时经中心静脉泵注多巴胺3~5 μg·kg-1·min-1以维持血流动力学的稳定。所有患者均采用静吸复合全身麻醉。静脉注射咪达唑仑0.04 mg/kg、依托咪酯0.2 mg/kg及瑞芬太尼1.0~1.5 μg/kg进行麻醉诱导,静脉给予维库溴铵0.10~0.15 mg/kg后进行气管插管,以潮气量6~8 mL/kg、呼吸频率13~15次/分,I∶E=1∶1.5进行机械控制通气,根据动脉血气分析结果调整呼吸参数。术中持续静脉泵注瑞芬太尼、咪达唑仑、维库溴铵并复合吸入七氟烷1%~2%维持麻醉。根据患者血流动力学变化,静脉泵注多巴胺、去氧肾上腺素及硝酸甘油等血管活性药物维持循环稳定。术毕采用0.5%罗哌卡因20 mL切口局部浸润注射进行术后镇痛。手术全程进行胎心监测,产科医师在手术室随时待命,若胎儿出现异常情况,能及时进行剖宫产术终止妊娠。
对于剖宫产术与心血管手术同期进行的患者,产科与心外科医师需同时到场。患者入室后先在局部麻醉下分别进行桡动脉与右颈内静脉穿刺置管,体外循环管路预充,产科及心外科手术区域均消毒铺巾,待剖宫产术开始前即进行全身麻醉诱导,麻醉诱导为持续吸入七氟烷3%~5%及静脉泵注瑞芬太尼0.25 μg·kg-1·min-1,静脉给予罗库溴铵0.8~1.0 mg/kg后进行气管插管。首先进行剖宫产术,待胎儿断脐后静脉给予舒芬太尼0.5~1.0 μg/kg加深麻醉,并停用瑞芬太尼,采用静脉泵注舒芬太尼0.5~0.8 μg·kg-1·h-1、丙泊酚2~4 mg·kg-1·h-1,同时吸入七氟烷1%~2%维持麻醉。为避免剖宫产术后子宫出血,在使用缩宫素后,采用宫腔内水囊压迫止血。剖宫产术结束后再次对心脏手术区域进行消毒铺单,随后在体外循环下进行心血管手术。术中根据患者血流动力学变化使用多巴胺、去氧肾上腺素、肾上腺素及硝酸甘油等维持循环稳定。新生儿均送入新生儿重症监护病房(neonatal intensive care unit,NICU)做进一步评估与治疗。
1.2.2术中体外循环管理
所有患者心血管手术均在体外循环下进行。对于继续妊娠患者,在预冲液中加入黄体酮注射液20 mg,并持续静脉泵注硫酸镁0.5~0.8 g/h抑制宫缩。体外循环开始前,静脉推注肝素3 mg/kg进行全身肝素化,维持激活全血凝固时间>480 s。体外循环采用常温高流量灌注技术,最低灌注温度(鼻咽温度)维持在34.3~35.0 ℃,转流期间平均动脉压(mean arterial pressure,MAP)维持在40~85 mm Hg,转流量2.4~3.2 L·min-1·m-2。对于主动脉夹层动脉瘤患者采用深低温(鼻咽温度20.1~22.4 ℃)停循环及选择性脑灌注技术。
2 结 果
在7例患者中,3例先行心血管手术,术后继续妊娠,心血管手术均为心脏瓣膜置换术;其余4例为剖宫产术与心血管手术同期进行,其中1例为剖宫产术+二尖瓣置换术,2例为剖宫产术+Bentall术+主动脉全弓替换术+降主动脉支架象鼻术,1例为剖宫产术+Bentall术+右冠状动脉旁路移植术,此4例患者均先进行剖宫产术,宫腔内水囊填塞及腹部包扎后再进行心血管手术,于术后2~3 d后取出宫腔内水囊,均未出现失血过多或子宫切除等不良事件,见表2。
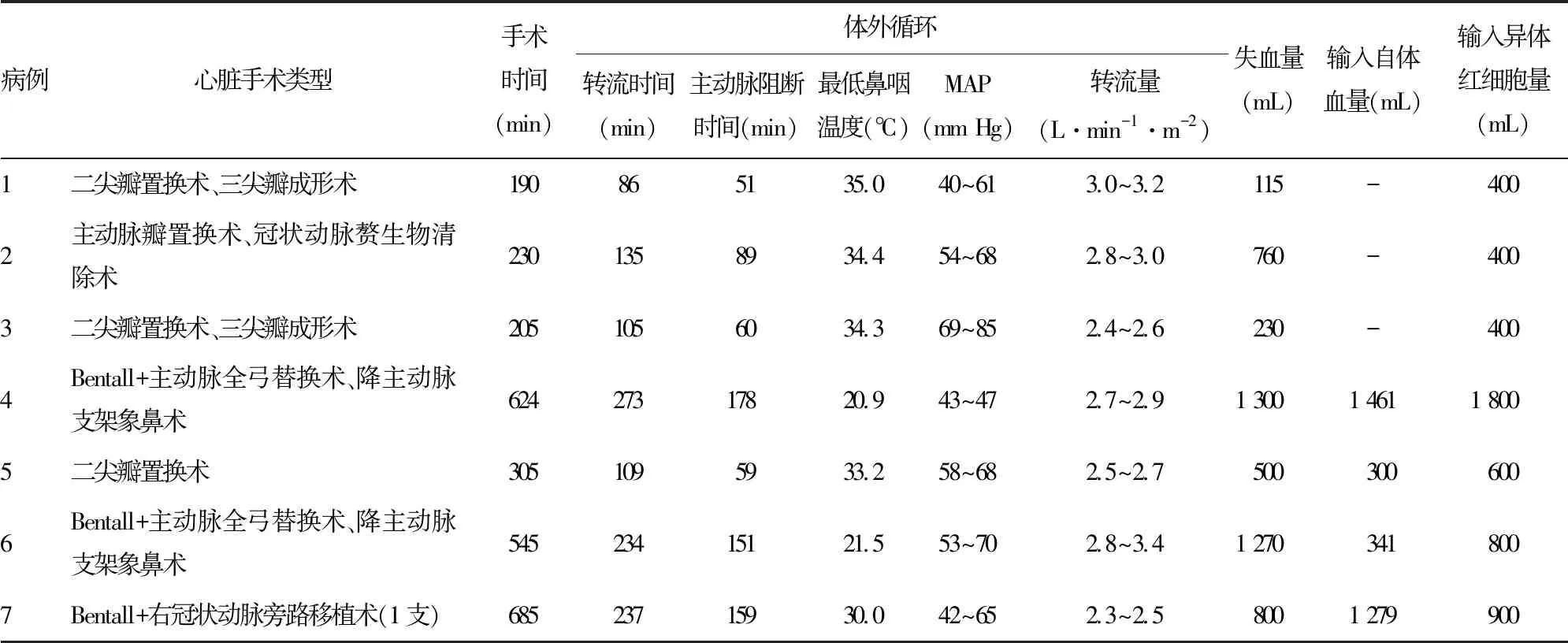
表2 母体心血管手术与体外循环情况
所有胎儿全部存活,终止妊娠方式均为剖宫产术,终止妊娠孕周为33~37+5周,除4例与心血管手术同期进行外,另外3例为心血管手术后继续妊娠,于术后4~12周在腰麻或全身麻醉下行择期剖宫产术。继续妊娠的3例患者在手术过程中,病例2的胎儿心率出现短暂下降,最低降至70次/分钟,通过增加体外循环转流量等措施胎儿心率恢复正常,其余2例胎儿术中心率均维持在110~160次/分钟。母体心脏手术后气管导管拔除时间为13~43 h,ICU留滞时间为2~6 d,5例在心血管手术后出现肺部感染。除病例5胎儿出生后1 min时Apgar评分为6分外,其余胎儿出生时均顺利。有3例胎儿在剖宫产术后并发新生儿肺炎,在NICU留滞时间为13~26 d,其余4例均无相关并发症。所有母体及新生儿均顺利出院,母婴术后转归见表3。
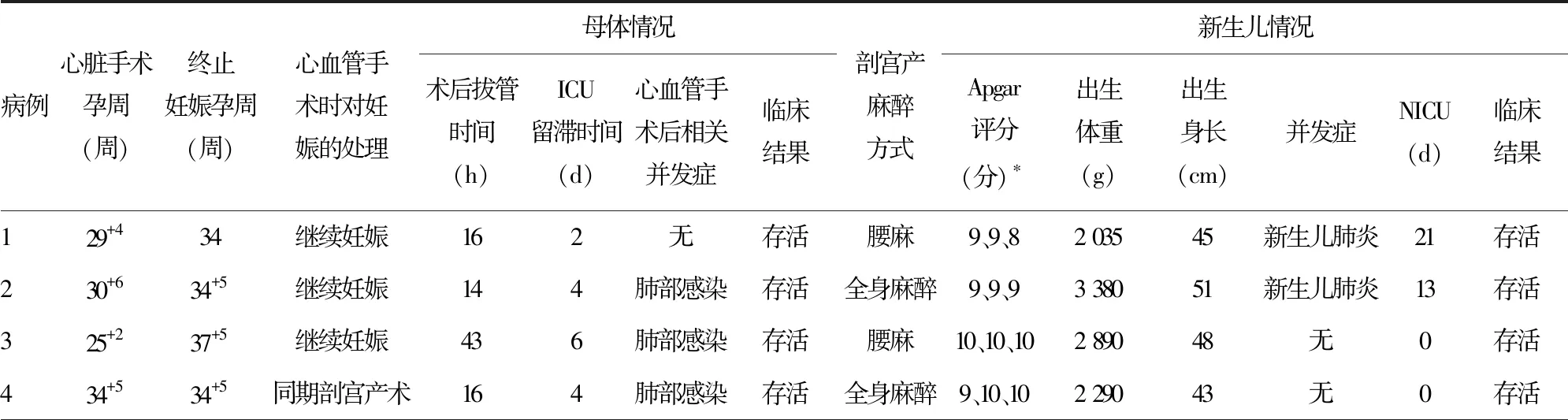
表3 母婴手术孕周及术后转归

续表3 母婴手术孕周及术后转归
3 讨 论
妊娠期患者在体外循环下行心血管手术危险性高,孕产妇总体死亡率约为11.2%,胎儿死亡率为33.1%,孕产妇并发症发生率8.8%,新生儿并发症发生率为10.8%,早产和剖宫产的风险分别为28%和33.8%[4]。本组7例妊娠中晚期患者中,3例先行心血管手术,术后继续妊娠,待胎儿成熟后再行剖宫产术;另外4例为剖宫产术与心血管手术同期进行。所有孕产妇和胎儿均存活,围术期未发生相关的严重并发症。
对于妊娠期合并心血管疾病的患者,术前评估的重点是确定心血管手术的干预时机和终止妊娠的时机。一般认为,孕妇在妊娠早期接受心血管手术有增加胎儿流产的风险;妊娠中期胎儿器官发育基本完成并且母体的血流动力学负荷也不是最大[5-6],接受心血管手术的风险相对较小;妊娠晚期接受心血管手术胎儿早产的风险增加[7];若将心血管手术推迟到分娩后,则增加孕产妇死亡的风险。因此,对于不同病理生理状态的患者,心血管手术的干预时机需要个体化决策。在本组患者中,3例接受了继续妊娠的心血管手术,其中1例为妊娠中期,另外2例虽然是妊娠晚期,但考虑患者为感染性心内膜炎,瓣膜附着赘生物,剖宫产术中赘生物脱落概率高,孕妇风险大,经多学科会诊后采取先行心血管手术,后期再终止妊娠的手术方式。其余4例为妊娠晚期患者,先行剖宫产术,同期在体外循环下进行心血管手术。
对于继续妊娠的患者,在麻醉药物的选择上存在一定争议。一般以常规的麻醉考虑作为依据[7],但仍然存在超说明书用药的情况。有研究者认为,妊娠期心血管手术对母体和胎儿造成的不良后果,与体外循环和母体的心血管功能状态密切相关,而与麻醉药物的使用相对较少[3]。事实上,根据药物使用说明书或文献报道,选择妊娠期相对安全的麻醉药物是可行的。临床上常用的麻醉药物(如丙泊酚、氯胺酮、依托咪酯等)均未证实对人类有致畸性。常用的心血管活性药物(包括血管收缩药、正性肌力药及血管扩张药等),在妊娠期使用是相对安全的,没有明确的证据表明禁止使用[8]。因此,有研究者提出术中单次短时间(<3 h)使用麻醉药物是安全的[9]。然而,妊娠期体外循环心血管手术通常超过3 h,在麻醉药物选择上尽量使用高效、半衰期短的药物,以减少药物对胎儿的影响。继续妊娠的患者中,病例3因术前心力衰竭诱发肺水肿,术后并发肺部感染导致气管导管留置时间长达43 h。美国药物和食品管理局(FDA)将青霉素及头孢菌素类对胎儿的危害划分为B类,对孕妇及胎儿基本无害。病例3围术期使用头孢呋辛钠进行抗感染,效果确切。继续妊娠至37+5周时,行剖宫产术终止妊娠,胎儿存活,无畸形。
体外循环期间胎儿的灌注与氧合成了特殊的挑战,据报道胎儿的死亡率可高达30%[3,10]。为了减少体外循环期间胎儿的风险,可采取一些预防措施,如减少术中失血、使用常温或轻度低温体外循环、缩短体外循环时间、维持较高转流量(>2.4 L·min-1·m-2)及维持MAP>70 mm Hg等[11]。对于孕期>20周的患者,妊娠子宫可能压迫下腔静脉或腹主动脉,患者平卧位时可以引起静脉回心血量下降或子宫胎盘灌注压下降,因此采取左侧卧位(如左倾斜15°)维持子宫移位,以避免子宫胎盘血流受损[3]。体外循环转流期间由于使用心脏停搏液,引起血钾浓度升高,术中应密切监测,维持血清钾浓度<5 mmol/L。此外,优化母体氧合和避免母体低血糖对预防胎儿心动过缓具有重要意义。若妊娠>24周,建议在体外循环期间监测胎儿心率,以调整心率、MAP和母体温度,使胎儿心率保持在110~160次/分钟。在病例2中,当母体鼻咽温度降至34.4 ℃时,胎心监测提示胎儿心率减慢,最低降至70次/分钟,立即增加转流量、维持母体鼻咽温度至35 ℃以上,胎儿心率逐渐恢复正常。由于体外循环下容易诱发子宫收缩,在预冲液中加入黄体酮注射液并静脉持续泵注硫酸镁以抑制宫缩。术中亦可使用超声技术持续监测胎心、脐带血流及胎儿在宫内的情况,及时发现异常状况,通过调整体外循环转流参数,防止胎儿宫内缺氧,并随时做好剖宫产术的准备。在体外循环后,利用多普勒超声监测胎儿脐部和大脑中动脉的血流,可以评估胎儿的脑氧合情况。
此外,术中肝素化可能导致剖宫产术后大出血,对于同期进行手术的患者,在剖宫产术后与全身肝素化之前,可以在宫腔内放置水囊进行压迫止血,同时做好子宫动脉介入栓塞的准备。本组4例患者剖宫产术后24 h阴道引流量小于300 mL,止血效果满意。
总之,妊娠中晚期心血管疾病患者在体外循环下进行心血管手术虽然风险极高,但通过多学科协作,选择合理的手术时机与方式,制订个体化围术期麻醉管理策略,仍能确保母体和胎儿的最佳临床结局。
