帕金森病15型基因突变携带者行胚胎植入前单基因遗传学检测助孕成功一例
2022-02-19王志强倪亚莉安锦霞王同光张风霞
王志强,倪亚莉,安锦霞,王同光,张风霞
帕金森病(Parkinson's disease)是一种常见的神经系统变性疾病,其中遗传性帕金森病的发生率为5%~10%[1]。目前已有20多个基因明确定位,其中帕金森病15型的致病基因是FBXO7(F-box only protein 7)基因,其基因突变呈常染色体隐性遗传。引起单基因遗传性帕金森病的临床表现复杂多变。常染色体隐性遗传性帕金森病多为青少年起病。一般父母双方都是致病基因携带者,生育患儿的概率理论上达25%,但实际发生率可能更高。本文报告1例具有FBXO7基因突变并通过胚胎植入前单基因遗传学检测(Preimplantation Genetic Testing for Monogenic Disorders,PGT-M)技术助孕成功妊娠的病例。
1 对象与方法
1.1 研究对象夫妇双方因生育2个男孩且2孩均于5个月时出现相似疾病症状,怀疑遗传学相关疾病,于2018年9月19日带大男就诊于甘肃省妇幼保健院(我院)。就诊时女方28岁,男方28岁,双方均为初婚,女方既往孕4产2,2013年和2017年均于孕40~50 d药物流产1次,终止妊娠原因不详。分娩史如下:2012年足月顺产一男孩(大男,先证者),在其5个月大时出现肌肉张力和肢体僵硬程度增加,无法独立坐下。现6岁不能独立行走,不能正常说话,并且智力发育迟缓。该患儿2015年4月于外院被诊断为脑瘫并进行相关康复治疗,但未取得令人满意的结果。女方于2016年12月31日再次足月顺产第2个男孩(小男),小男于5个月龄时出现了和哥哥同样的症状,肌肉张力增强,认知能力下降,2017年6月7日于外院就诊时对小男行全外显子测序(whole exome sequencing,WES)未发现异常,最终于2017年6月20日因严重的肺部感染夭折。经相关诊治后初步推断,小男与先证者大男相关症状与体征均可能与帕金森-锥体束综合征(Parkinsonianpyramidal syndrome,PPS)发作有关。就诊于我院时经患者及家属知情同意后,对夫妇双方及二子前次行WES的剩余扩增样本再次行WES重新寻找遗传病因,发现先证者大男和小男均为FBXO7基因的复合杂合突变携带者(NM_012179.3):c.402G>A和c.872-1G>A。c.402G>A遗传自父亲,而c.872-1G>A来自母亲。对患者夫妇进行充分遗传咨询和知情同意后,为患者制定了详细的PGT-M助孕方案。该研究得到我院伦理委员会的批准。
1.2 研究方法
1.2.1 家系预实验分析采集夫妻双方及先证者肘正中静脉血5 mL,对先证者FBXO7基因的突变位点c.402G>A和c.872-1G>A进行Sanger测序验证。结果如图1和图2所示:FBXO7基因(OMIM:605648)存在错义突变,确定了先证者和弟弟均为FBXO7基因的复合杂合突变(NM_012179.3):c.402G>A和c.872-1G>A。c.402G>A遗传自父亲,而c.872-1G>A遗传自母亲。根据美国医学遗传学和基因组学会(American College of Medical Genetics and Genomics,ACMG)指南介绍,c.402G>A为无义突变,可导致蛋白翻译提前终止;c.872-1G>A为剪切突变,可导致蛋白剪切发生变化,均为致病突变,分别遗传自父母双方。同时,对该家系的基因组DNA(genomic DNA,gDNA)样本在FBXO7基因上下游2 Mb范围内进行单核苷酸多态性(single nucleotide polymorphism,SNP)多重扩增,进行家系SNP单体型分析,区分先证者致病携带的单体型为后续胚胎SNP连锁分析奠定基础。
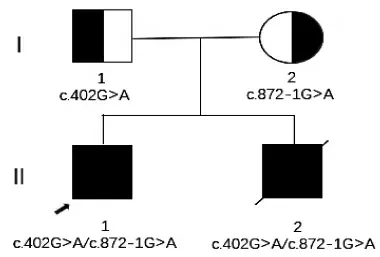
图1 FBXO7基因家系图谱

图2 FBXO7基因家系一代验证结果
1.2.2 卵细胞质内单精子注射(intracytoplasmic sperm injection,ICSI)及PGT-M治疗为患者制定控制性卵巢刺激方案,采用卵泡期短效长方案,最终获卵15枚,ICSI后正常受精9枚,于第5天获得可活检囊胚5枚,对扩张期囊胚滋养外胚层细胞进行活检。并将活检样本参照基因测序通用样本处理(XK-028,Yikon Genomics)试剂盒说明(ChromSwiftTM)进行单细胞全基因组扩增(whole genome amplification,WGA)。
取20 ng WGA产物应用转座酶试剂盒(KT100801924,Yikon Genomics)进行片段化建库,文库大小为200~500 bp,Illumina Nextseq 550平台测序0.04×深度,分析胚胎染色体非整倍性。取120 ng WGA产物为模板,利用FBXO7基因上下游的SNP引物行多重扩增,后续利用基因测序文库(XK-038,Yikon Genomics)试剂盒进行文库构建,文库大小约为250 bp,测序深度为100×。染色体拷贝数变异(copy number variations,CNV)分析时将原始读长(reads)去掉重复,以1 Mb大小的单元(bin)比对到基因组上,在整个基因组范围进行计数。利用循环二元分割算法(circular binary segmentation,CBS)对≥4 Mb的胚胎CNV进行报告,并应用R语言程序对24条染色体的每个单元的CNV进行可视化画图[2]。SNP位点分析时将高通量测序数据比对到人类参考基因组(hg19),进一步分析家系及检测样本全基因组SNP位点,在致病基因上下游1~2 Mb内挑选SNP位点。最终,根据胚胎突变基因的SNP位点连锁分析结果、基因点突变位点验证结果以及胚胎的染色体整倍性结果综合考虑,出具检测报告。
2 结果
2.1 家系预实验基因分析家系预实验基因分析结果示:父母双方均为FBXO7基因相应位点的突变携带者,先证者携带分别遗传自父母的FBXO7基因突变位点,为复合杂合突变。见图3、图4。

图3 父母及先证者SNP连锁分析
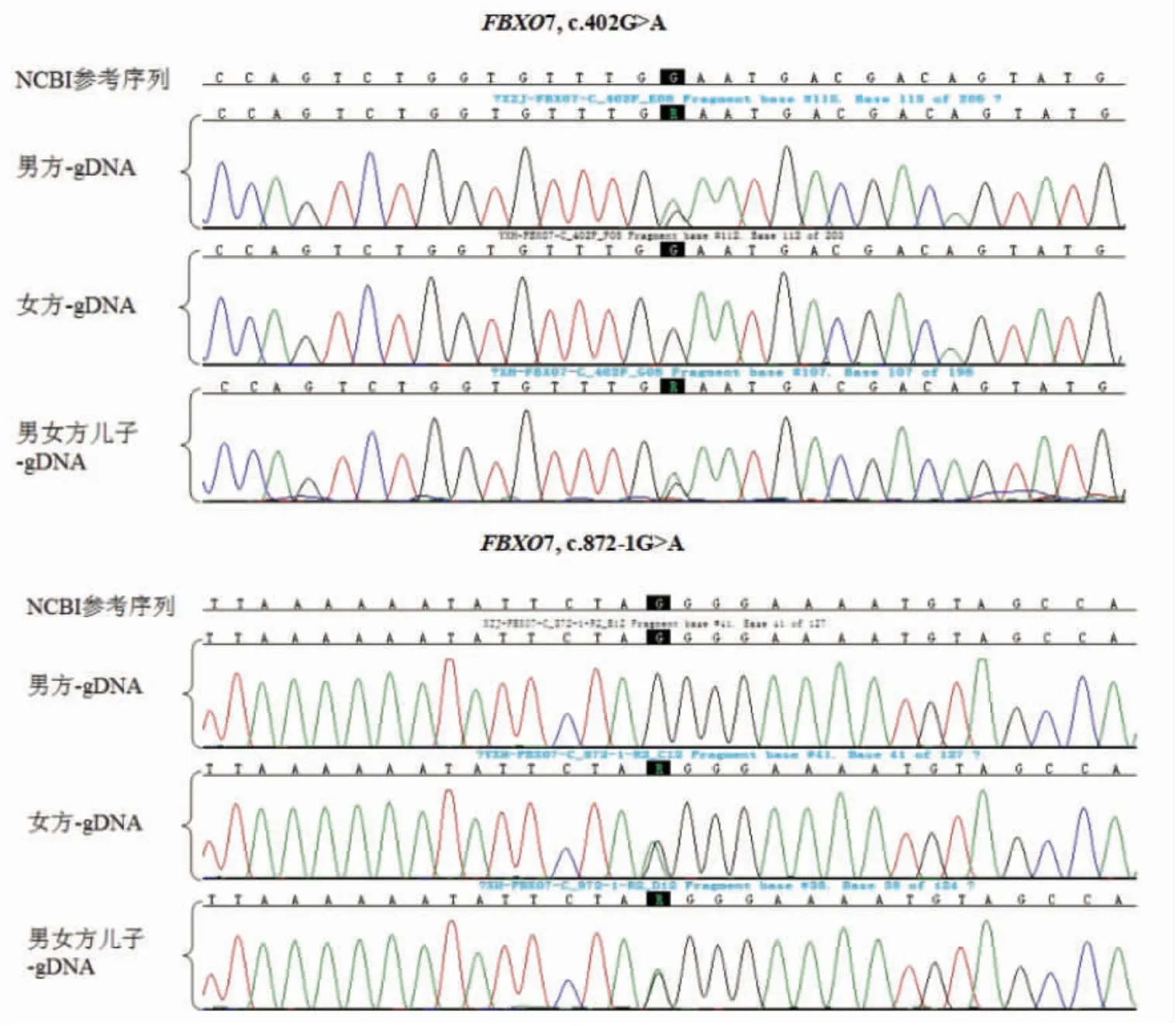
图4 父母及先证者基因分析结果
2.2 活检样本检测结果及移植结果5枚囊胚行滋养层细胞活检后均成功扩增,基因突变位点及SNP检测结果见表1和图5。5枚囊胚中有2枚(P2018052_1和P2018052_4)仅携带父源突变且染色体为正常二倍体,2枚胚胎染色体存在异常,1枚胚胎患病。遗传咨询后对患者行冻融胚胎移植,经内膜准备后将编号为P2018052_1(形态学评分为5BB)的活检后囊胚移植到母体,获得成功妊娠。妊娠期经过胎儿颈项透明层厚度(nuchal translucency,NT)、系统B超和羊水穿刺三联筛查验证胎儿与前期胚胎PGT-M遗传学检测结果完全一致,未发现其他异常。该患者于2020年4月3日成功分娩一名仅携带父源突变、无发病风险的健康男婴,出生体质量3 360 g。

图5 5枚囊胚SNP检测结果

表1 5枚囊胚活检样本CNV检测结果
3 讨论
帕金森病是一种神经退行性疾病[1],其特征为静止性震颤、肌肉痉挛、运动迟缓和体位不稳等,严重者亦有记忆障碍和痴呆[3]。家族性帕金森病在所有帕金森病患者中仅占10%[4],其可通过常染色体显性遗传、常染色体隐性遗传或罕见的X连锁遗传[5],其中FBXO7基因突变为常染色体隐性遗传方式。常染色体隐性遗传早发性帕金森病(autosomal recessive early-onset Parkinsonism,AREP)是一种早发性、发病年龄一般≤40岁的帕金森病,除有帕金森病的特征性临床表现外,还有其自身特点,如症状常于睡眠休息后减轻、晨轻暮重、早期对小剂量多巴胺反应敏感和肌张力障碍等[6]。研究发现,编码FBXO7蛋白的FBXO7基因突变可引起罕见的常染色体隐性遗传性神经退行性疾病——帕金森病15型[7],该病又称为PPS或苍白球-锥体束病(pallido-pyramidal disease,PPD)。患有这种疾病的患者主要表现为锥体束疾病伴发的帕金森病的早期发作,并常表现出精神运动迟缓、腱反射亢进、舞蹈症和其他非典型症状[8]。帕金森病15型属于青少年起病的帕金森病,多在幼年和成人早期发病,该病进展迅速,可有皮质脊髓体征,部分家庭早发性帕金森病伴有运动迟缓。目前国际上已有20例早发性帕金森病家族中FBXO7基因突变的病例报道,部分突变类型已被鉴定[8-9]。Wei等[9]报道了中国首例由FBXO7基因复合杂合突变引起的少年型帕金森病。
本家系中先证者和其弟均为FBXO7基因的复合杂合突变(NM_012179.3):c.402G>A和c.872-1G>A。无义突变c.402G>A遗传自父亲,而剪切突变c.872-1G>A遗传自母亲。通过在千人基因组计划、人类外显子数据库(ExAC)和SNP数据库(dbSNP)中检索,并且在突变数据库ClinVar、OMIM(Online Mendelian Inheritance in Man)和HGMD(Human Gene Mutation Database)中检索,均没有发现本家系中检出的2个基因突变的记录。c.402G>A突变使色氨酸密码子(UGG)转换为终止密码子(UGA),使蛋白质翻译提前终止(p.Trp134*),并导致FBXO7功能丧失。c.872-1G>A突变是剪切位点突变,位于IVS5-1位置,导致6号外显子剪切发生变化并产生异常蛋白。根据ACMG遗传变异分类标准和指南,将新的无义突变c.402G>A加权为非常强致病性证据(PVS1),中等致病性证据(PM2和PM4),并提供致病性支持(PP);剪切突变c.872-1G>A的权重为PVS1、PM2、PM3和PP。根据致病标准,将这两个变异归类为致病性。
目前已经发现的单基因遗传病有7 000多种,大部分单基因遗传病具有致死性、致残性或致畸性,且多数至今尚无有效治疗手段,对患者家庭及社会造成严重负担。PGT-M技术现已广泛应用于胚胎植入前的单基因病检测,在妊娠之前即对胚胎进行遗传学诊断,避免遗传学高风险的胚胎种植,从而实现优生优育[10]。本例帕金森病遗传方式为常染色体隐性遗传,夫妻双方分别携带致病杂合变异基因,后代有25%的概率患病,50%的概率为致病变异携带者,25%的概率为正常人。经用PGT-M技术,通过多次退火环状循环扩增技术(multiple annealing and looping-based amplification cycles,MALBAC)进行单基因扩增及高通量测序,对囊胚进行筛查,选择不同时携带母源以及父源致病位点的非致病性胚胎进行移植获得活产,成功阻断了帕金森病在该家系的垂直传递。
PGD-M技术已经成为解决单基因遗传病的一级预防手段之一。在生殖临床和生殖遗传的常规临床工作中,必须将临床表现和遗传学检查结合起来,提高对遗传性疾病的辨别力和洞察力,才能在实际的临床工作中及时发现遗传学风险,从而通过相应的治疗手段提前进行干预,切实通过技术手段达到预防出生缺陷、提高人口素质的目的。
