子宫内膜异位症体外受精移植未见原核胚胎成功妊娠一例
2022-02-19兰云竹王芳黄桂英陈绍威
兰云竹,王芳,黄桂英,陈绍威
育龄期是子宫内膜异位症(endometriosis,EMs)高发年龄,76%发生在25~45岁。随着我国“三孩”政策全面放开,有生育要求的女性日益趋多,约25%~35%不孕患者与EMs有关,除典型的进行性痛经表现,约5%~15%患者仅在妇科手术中发现存在EMs[1]。关于EMs的治疗方式及确切的实施时间等问题尚存争议,辅助生殖技术(assisted reproductive technology,ART)助孕工作中对EMs所致的不孕主要根据患者不孕时间、疾病严重程度及卵巢储备功能制定个体化治疗方案。而在进行ART助孕时,有时采用体外受精(in vitro fertilization,IVF)可获得未见原核(nonpronuclcus,0PN)胚胎,该类胚胎能否利用及其临床妊娠结局尚存争议。报告1例EMs患者采用ART助孕移植2枚0PN后成功妊娠,最终获得活产女婴的临床资料,为临床工作中EMs诊治策略及0PN胚胎的利用提供参考。
1 病例报告
患者 女,26岁,因输卵管粘连分离+输卵管伞端造口术+子宫内膜异位病灶清除术后6个月余未孕,于2018年10月1日就诊于西南医科大学附属医院(我院)不孕不育门诊。2018年3月8日患者因输卵管远端梗阻、EMs于我院住院,行腹腔镜下双侧输卵管粘连分离+输卵管伞端造口术+子宫内膜异位病灶清除术。2018年3月16日出院,术后无不适,性生活正常。2018年5月2日患者门诊复查B超提示(见图1):宫体大小约62.8 mm×58.5 mm×55.3 mm,肌层回声杂乱不均匀,右侧附件区查见大小约34.1 mm×30.5 mm×37.5 mm暗区声像,透声极差,内见密集等回声光点蠕动,考虑子宫腺肌病、右侧卵巢子宫内膜异位囊肿。未予以处置,建议继续备孕。患者自行试孕半年未孕,不愿等待自然妊娠,遂再次就诊于我院。患者平素月经规律,经期7 d,月经周期28 d,经量适中,痛经明显,需口服止痛药。妇科查体:子宫均匀增大,约孕3+个月大小,质硬,有明显压痛,后穹窿有触痛结节,右附件区一4 cm×5 cm囊性质韧包块。抗苗勒管激素(anti-Müllerian hormone,AMH)1.6 ng/mL,伴侣患畸形精子症。2018年10月20日门诊复诊后患者夫妻双方要求ART助孕,诊断考虑:原发性不孕症;双侧输卵管粘连分离+输卵管伞端造口术后;EMs;子宫腺肌病;伴侣畸形精子症。患者体质量指数(BMI)23.04 kg/m2,采用超长方案,周期中性激素及糖类抗原125(CA125)水平见表1,阴道B超见表2,2019年1月2日扳机日予以重组人绒毛膜促性腺激素(human chorionic gonadotropin,hCG)注射液250 μg(艾泽,默克雪兰诺有限公司,德国),37 h后行阴道超声监测下取卵。获卵4枚,其中成熟卵母细胞3枚,IVF受精2枚,最终获得0PN胚胎2枚。根据Peter卵裂期胚胎评分系统评估胚胎质量[2],结合实验室胚胎师观察,分别从细胞数、碎片分级(碎片<10%为4级,10%≤碎片<20%为3级,20%≤碎片<50%为2级,碎片≥50%为1级)及卵裂球均一度(均一评分1,不均一评分0)进行细胞评分,2枚0PN胚胎评分分别为830(细胞数为8,碎片分级为3级,卵裂球均一度为0)、1440(细胞数为14,碎片分级为4级,卵裂球均一度为0)(见图2、图3)。考虑患者患有EMs,建议患者可先予以2~3支亮丙瑞林后行冻融胚胎移植(frozen-thawed embryo transfer,FET),和患者充分沟通后,胚胎冷冻保存。
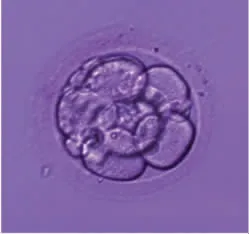
图2 评分840的0PN D3胚胎

图3 评分1440的0PN D3胚胎

表1 超长方案过程中性激素及CA125水平变化
表2 IVF助孕过程中B超情况
2019年1月10日患者门诊就诊要求行FET,于2019年1月14日采用替代周期FET,周期中性激素及CA125水平见表3,B超结果见表4。FET 2枚0PN胚胎妊娠后血清hCG水平及B超情况见表5。2019年6月21日FET术后35 d B超提示宫内一胎停止发育,患者无腹痛和阴道出血等不适,考虑停育胚胎可能随着孕周增加逐渐吸收机化,沟通后未予处理,嘱患者定期随访。2020年2月6日孕40+2周剖宫产一健康女婴,体质量2 950 g,儿童保健科随访至1岁生长曲线未见异常。

表3 FET周期性激素及CA125水平变化

表4 FET助孕过程中B超情况

表5 FET助孕妊娠后胎儿hCG水平及B超情况
2 讨论
2.1 EMs的治疗策略及进展当子宫内膜组织(腺体和间质)出现在子宫体外的部位时,称为EMs[1]。Llarena等[3]研究认为即使生育力正常的夫妇在排卵期性交,伴有EMs患者的妊娠率仅为2%~10%。对于EMs合并不孕症的治疗,目前主要包括药物、手术和ART。一线药物为口服避孕药和孕激素,二线药物则包括促性腺激素释放激素激动剂、促性腺激素释放激素抑制剂和芳香化酶抑制剂等[4]。欧洲人类生殖与胚胎学会(European Society of Human Reproduction and Embryology,ESHRE)指出:Ⅰ/Ⅱ期EMs相关不孕症患者行腹腔镜下子宫内膜异位病灶清除术可明显改善生育状况[5]。本例患者已行子宫内膜异位病灶清除术,术后试孕半年后行IVF助孕。这与Opøien等[6]认为对于Ⅲ~Ⅳ期EMs不孕症患者,盆腔粘连严重,更建议术后直接进行IVF一致。
2.2 亮丙瑞林治疗机制及临床运用亮丙瑞林是视丘下部所产生的促性腺激素释放激素(GnRH)的高活性类似物(GnRH-a),为合成的两端封闭的水溶性九肽,主要通过调节垂体分泌,抑制促性腺激素释放,降低性激素水平,达到闭经效果,使子宫内膜异位病灶吸收萎缩,有效地抑制垂体性腺系统功能[7]。体外研究认为,亮丙瑞林可降低体外子宫内膜细胞增殖能力,提高凋亡指数[8]。本病例在取卵前及移植前均使用亮丙瑞林,CA125较未注射前明显降低,尤其是在FET前予以3支GnRH-a,有效改善盆腔环境,减少早发LH峰对内膜容受性影响,增加胚胎种植成功率,提高临床妊娠率。
2.3 0PN胚胎发育潜能一般情况下,临床上认为2个原核(two pronuclcus,2PN)为正常受精。在无2PN情况下,仍有少部分受精卵未观察到原核,继续培养部分发生卵裂甚至发育成优质胚胎,定义此类胚胎为0PN胚胎。国内外已有优质0PN胚胎移植后娩出健康婴儿的相关报道[9]。临床上如何利用0PN胚胎为患者提供移植机会,成为胚胎学家们具有争议的话题。Pons等[10]比较了不同细胞数胚胎的整倍性和发育潜能,认为8细胞数胚胎占明显优势。Thompson[11]认为0PN的卵裂期胚胎有较高的胚胎异常率及高流产率。笔者认为倘若0PN出现过早或过晚,结合细胞受精及卵裂模式,该胚胎仍可能具有正常的核型。在临床工作中可以通过以下几种方式评估移植策略:①优先选择原核期有两个极体(2PB)的胚胎,一定程度上可以排除二倍体双雌胚胎的移植[12];②选择发育速度相对正常的0PN胚胎;③观察卵裂模式;④囊胚培养,自然筛选;⑤利用时差摄像技术(timelapse)动态地观察胚胎发育情况;⑥0PN胚胎进行胚胎植入前遗传学筛查(preimplantation genetic screening,PGS)后再考虑移植。该病例患者胚胎评分好,IVF授精后可能是错过了原核观察时间而判断为0PN胚胎,移植前与患者沟通可行PGS,患者拒绝,移植后定期产科随访,最终生育一健康女婴。
EMs的助孕方式目前并未有特定的促排卵方案或者移植策略供临床医生行标准化治疗,关于其诊治仍在探索中,尤其是对于0PN胚胎的利用值得临床进一步研究和思考。至于本病例出现一胚胎存活、一胚胎停止发育,是与0PN胚胎的利用有关,还是自然选择的过程尚不明确,还需要更多临床病例的累积、总结和讨论,最终提高患者临床妊娠率。
