骨髓间充质干细胞移植联合多点微量注射曲安奈德对兔耳增生性瘢痕及创面巨噬细胞极化的影响
2022-02-19左楠,王远,王爽
左 楠,王 远,王 爽
(1.西北大学附属医院 西安市第三医院,陕西 西安 710018;2.西安市第五医院,陕西 西安 710008;3.西安交通大学第二附属医院,陕西 西安 710004)
瘢痕是各种创伤后所引起的正常皮肤组织的外观形态和组织病理学改变的统称,它是人体创伤修复过程中必然的产物,其不仅会影响患者美观,而且部分生长到一定限度的瘢痕会引起诸如瘙痒、溃烂以及疼痛等严重影响患者生活质量[1-2]。增生性瘢痕是目前最常见的瘢痕类型之一,是一种在创面愈合的原始位置出现红色和突起的瘢痕,其特征是过度纤维化和细胞外基质沉积[3],其发病机制尚不清楚。目前国内外治疗瘢痕的方法在临床上都不是很成熟,疗效有待观察,并且有的所需时间长、痛苦大、容易反复、出现不良反应等,许多都不尽如人意[4]。因此,开发增生瘢痕治疗新疗法意义重大。曲安奈德是一种皮质类固醇药物,在临床上主要被用于治疗各类皮肤病或减少口腔溃疡带来的不舒适感[5-6]。 研究[7]表明,曲安奈德联合其他疗法对瘢痕具有一定的治疗疗效。目前,间充质干细胞因其治疗和预防增生性瘢痕形成潜力而进入公众视野。许多临床试验和临床前试验均表明,骨髓间充质干细胞(Bone marrow mesenchymal stem cells,BMSCs)[8]、绒毛膜间充质干细胞[9]、脂肪来源的间充质干细胞[10]等都具有促进皮肤伤口无瘢痕愈合和抑制组织纤维化的能力。然而,目前尚无BMSCs联合曲安奈德治疗瘢痕的研究报道,故本研究以兔耳创面模型为研究对象,使用BMSCs联合曲安奈德瘢痕内注射进行治疗,探讨BMSCs联合曲安奈德对兔耳增生性瘢痕形成的影响。
1 材料与方法
1.1 实验动物 60只新西兰兔(2~2.5 kg,1~1.5岁,雄性),购买自北京维通利华实验动物技术有限公司,均为健康级。所有兔子均饲养在通风干燥处,单笼喂养1周后方可用于实验研究。本研究所涉及动物研究均经本院动物伦理委员会审查和监督,符合美国国立卫生院实验动物护理和使用指南。
1.2 主要试剂与仪器 兔BMSCs(TOPCP0004,深圳市拓普生物科技有限公司),DMEM培养基(111995123,Gbico),胎牛血清(10099141C,Gbico),组织RNA提取试剂盒(R6688-01,武汉普兰德生物技术有限公司),逆转录试剂盒/反转录试剂盒(AORT-0020,广州天骏生物科技有限公司),2×SYBR Green qPCR Master Mix(K1070,APExBIO),曲安奈德注射液(国药准字H53021605,昆明积大制药股份有限公司),4 mm 皮肤活检穿孔器(15110-40,PELCO,美国)。
1.3 兔耳瘢痕模型的制作与分组 所有兔子术前禁食,耳静脉注射3%的戊巴比妥钠麻醉兔子,待兔子进入深度麻醉状态后,使用4 mm 皮肤活检穿孔器(15110-40,PELCO)。在每只耳朵的腹侧建立1 cm×1 cm创面。随机将60只兔子分为模型组、曲安奈德组和联合治疗组,每组20只。在制作创面3周后,模型组兔子不接受任何治疗;曲安奈德组兔子创面瘢痕内多点注射曲安奈德组,共计100 μl,每周治疗2次,共计治疗4周;联合治疗组兔子在曲安奈德组治疗的基础上,额外增加创面瘢痕内注射BMSCs治疗,共计0.5×106个BMSCs/只,每周治疗2次,共计治疗4周。
1.4 观察指标
1.4.1 创面愈合和完全上皮化时间:自实验兔耳创面建立后,每日观察创面愈合和创面上皮化情况,记录创面愈合和完全上皮化时间。
1.4.2 瘢痕面积、突出高度和瘢痕指数:创面建立第42天,首先测量兔耳瘢痕面积,然后测量兔耳瘢痕最高点与周围皮肤的落差(瘢痕突出高度)。最后,测量兔耳瘢痕最高点耳软骨表面的垂直距离(A),和瘢痕周围正常组织到耳软骨表面的垂直距离(B),计算瘢痕指数(瘢痕指数=A/B),瘢痕指数越高表明瘢痕增生越明显。
1.4.3 实时荧光定量PCR检测:耳静脉注射3%的戊巴比妥钠麻醉兔子,待兔子进入深度麻醉状态后,取下兔瘢痕组织,加入液氮后碾磨成粉,使用组织RNA提取试剂盒提起组织总RNA,然后用反转录试剂盒将提取的RNA反转录成cDNA。PCR参数设定:37 ℃、60 min,85 ℃、5 s。RT-qPCR:按照2×SYBR Green qPCR Master Mix试剂盒说明书制备20 μl 实时荧光定量PCR系统,并使用ABI 7500荧光定量PCR仪器进行扩增。PCR引物见表1。

表1 实时荧光定量PCR引物
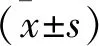
2 结 果
2.1 一般情况 本研究建立的所有兔耳创面在术后10~15 d完成创面上皮化,所有创面都未见感染和穿孔等。三组兔创面均出现瘢痕,其中模型组兔创面瘢痕最明显,瘢痕表现为红色、质地较硬,并且瘢痕厚度明显高于周围组织且创面中心组织厚度最高;曲安奈德组兔创面瘢痕颜色为红色,但色值较模型组淡、质地较软、瘢痕厚度低于模型组,同样表现为创面中心组织厚度高于周边;联合治疗组兔创面瘢痕为浅红色、质地在三组中最软、表面平,创面瘢痕组织厚度高于周围组织。
2.2 三组创面愈合和完全上皮化时间、瘢痕面积和突出高度比较 见表2。曲安奈德组兔耳创面完全上皮化时间、瘢痕面积和突出高度均显著低于模型组兔,而联合治疗组以上指标比曲安奈德组更低,差异均有统计学意义(均P<0.05)。
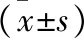
表2 三组兔耳创面愈合和完全上皮时间、瘢痕面积和突出高度比较
2.3 三组瘢痕指数比较 见表3。从第28天开始,曲安奈德组兔耳创面瘢痕指数均显著低于模型组,而联合治疗组兔耳创面瘢痕指数均显著低于曲安奈德组兔,差异均有统计学意义(均P<0.05)。
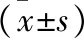
表3 三组兔耳创面瘢痕指数比较
2.4 三组创面瘢痕炎症因子mRNA表达水平比较 见图1。曲安奈德组兔耳创面炎症因子(TNF-α、IL-1β、IL-6和MCP-1)表达水平均显著低于模型组,而联合治疗组兔耳创面炎症因子表达水平显著低于曲安奈德组,差异均有统计学意义(均P<0.05)。
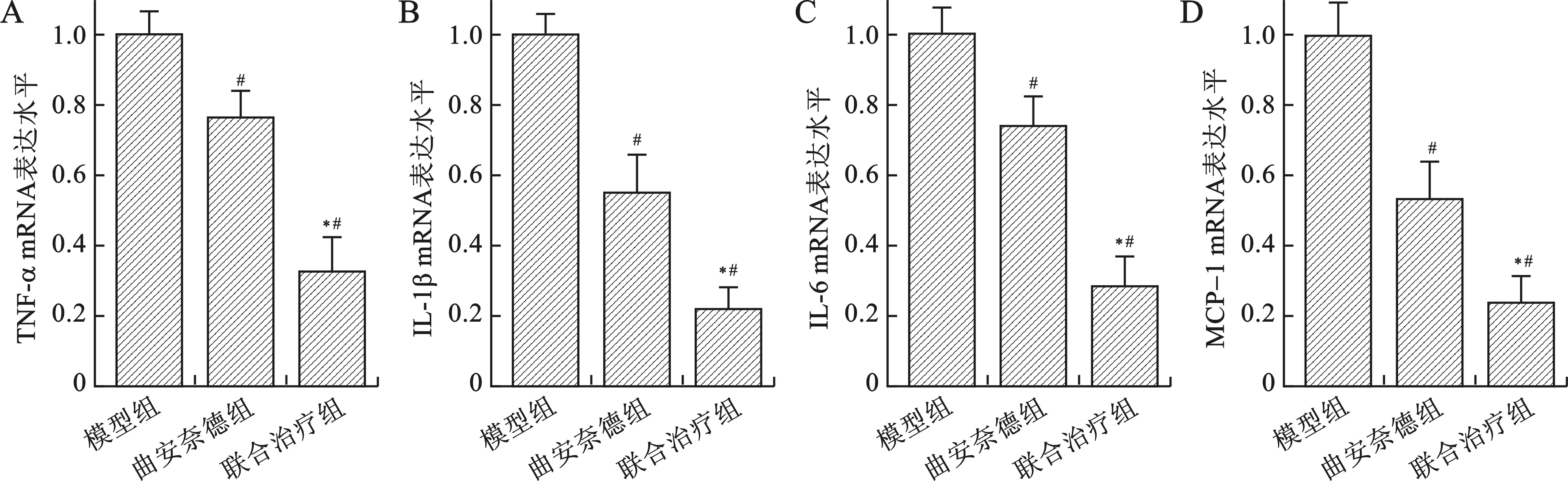
注:与模型组相比,#P<0.01;与曲安奈德组相比,*P<0.01
2.5 三组创面瘢痕巨噬细胞标志物表达水平比较 见图2。曲安奈德组兔耳创面M1巨噬细胞标志物(CD16和iNOS)表达水平均显著低于模型组,并且联合治疗组兔耳创面M1巨噬细胞标志物表达水平均显著低于曲安奈德组,差异均有统计学意义(均P<0.05)。曲安奈德组兔耳创面M2巨噬细胞标志物(CD206和Arg1)表达水平均显著高于模型组,并且联合治疗组兔耳创面M2巨噬细胞标志物表达水平均显著高于曲安奈德组,差异均有统计学意义(均P<0.05)。
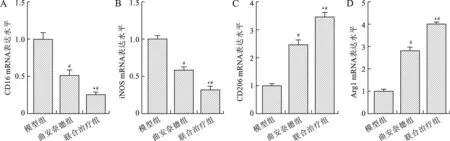
注:与模型组相比,#P<0.01;与曲安奈德组相比,*P<0.01
3 讨 论
目前国内外治疗瘢痕疗法包括局部药物封闭、皮肤移植、手术切除植皮、晶体磨瘢术、气囊扩张术、抗体注射、放射治疗、压迫疗法、激素疗法以及硅酮类等疗法。然而,无论那种瘢痕疗法在临床上都还不成熟,而且临床疗效尚需进一步观察[4]。此外,由于瘢痕发生的机制目前尚不明确,所以目前瘢痕修复治疗尚处于探索阶段。对于伤口愈合机制的探讨将有助于了解瘢痕形成的可能原因。之前的研究[11-12]表明,尽管伤口愈合的潜在机制很复杂,但炎症是决定性因素之一。增生性瘢痕是由伤口异常愈合引起的病理性瘢痕,其主要特征是持续的局部炎症和过多的胶原蛋白沉积[11-12]。因此,多种抗炎类药物被用于预防和修复增生性瘢痕。
曲安奈德是一种皮质类固醇药物,在多种疾病中具有显著的抗炎作用,在之前的研究中被用于辅助药物治疗和预防增生性瘢痕[13-14]。本文研究发现,曲安奈德瘢痕内多点微量注射有助于抑制增生性瘢痕的形成,而且BMSCs联合曲安奈德对增生性瘢痕形成的抑制作用优于单独使用曲安奈德。间充质干细胞是一类多功能细胞,多存在于结缔组织和器官组织的间质中,骨髓中含有丰富的间充质干细胞,被成为BMSCs。BMSCs具有较强的自我复制能力,在特定的部位植入BMSCs可以发挥促进组织修复、免疫调节以及炎症抑制的功能,且由于BMSCs不具有伦理争议,所以日益受到临床治疗的关注[15-16]。Xie等[17]研究发现,BMSCs可以显著抑制降低兔耳创面的愈合时间以及瘢痕面积和突出高度。本次研究结果提示,BMSCs联合曲安奈德预防增生性瘢痕的形成是有效的,而且联合治疗对增生性瘢痕形成的抑制作用明显强于单独使用曲安奈德。
尽管目前增生性瘢痕形成的具体分子机制尚未被揭示,但之前的研究表明炎症通过调节伤口处胶原蛋白的合成而影响瘢痕的形成,并且伤口处炎症强度与最终瘢痕形成的面积呈正相关[11-12]。本研究发现,曲安奈德组兔耳创面瘢痕炎症因子表达水平显著低于模型组,而联合治疗组兔耳创面瘢痕炎症因子表达更低,提示BMSCs联合曲安奈德治疗可能通过抑制瘢痕内部炎症反应而抑制增生性瘢痕的形成,这与Xie 等[17]的研究结果是一致的。Xie 等[17]研究发现,BMSCs可以通过下调创面瘢痕内p-IKBα/IKBα、p-p65/p65、p-JNK/JNK和pc-JUN/c-JUN的表达,而瘢痕内炎症因子的表达,最终通过抑制瘢痕内炎症而抑制增生性瘢痕的形成。
炎症细胞是炎症反应的执行者。在典型伤口愈合过程的炎症阶段,免疫细胞被认为主要用于防止病原微生物的入侵。然而,免疫细胞的失调会改变伤口愈合的结果并导致增生性瘢痕的形成,尤其是巨噬细胞。巨噬细胞是极其异质的可塑性细胞,在生理条件下,而且在炎症期间都具有重要作用。巨噬细胞能够响应许多不同的刺激而改变它们的表型,这个过程被称为激活或极化,由此巨噬细胞也被分为M1型巨噬细胞和M2型巨噬细胞[18-19]。M1型巨噬细胞主要表现为促进炎症反应,而M2型巨噬细胞则主要表明为炎症修复或抑制炎症反应[18-19]。本研究表明,BMSCs联合曲安奈德治疗可显著抑制M1型巨噬细胞表面标志物表达,而显著促进M2巨噬细胞表面标志物表达,表明BMSCs联合曲安奈德可促进兔耳瘢痕内M2巨噬细胞的极化,这与Xu 等[20]的研究结果是一致的。Xu等[20]研究发现,BMSCs可以通过促进M2巨噬细胞极化而减轻体内炎症。
综上所述,BMSCs联合曲安奈德对兔耳增生性瘢痕的形成具有抑制作用,其机制可能与促进M2巨噬细胞极化,降低瘢痕的炎症反应有关。
