小白菊内酯对骨肉瘤细胞凋亡与凋亡相关蛋白的影响及作用机制研究
2022-02-19任建政李正华陈小龙
纪 涛,任建政,李正华,陈小龙
(1.武警陕西省总队医院,陕西 西安710054;2.陕西省人民医院,陕西 西安710068)
骨肉瘤(Osteosarcoma,OS)作为一种原发性恶性肿瘤,起源于人体骨骼形成和发展过程,发病人群一般为青少年,全球年发病人数高达4~5万,且呈逐年上升趋势[1-2]。临床中针对骨肉瘤患者,常采用放疗和化疗等保守方法治疗,必要时需要进行手术切除。尽管在一定程度上缓解了病情发展,但是复发性骨肉瘤患者和转移性骨肉瘤患者尚不能得到彻底治愈[3-4]。所以,寻找新颖、廉价高效的药物用于临床治疗骨肉瘤显得极为迫切。小白菊内酯(Parthenolide,PTL)是一种倍半萜类化合物,单体可从菊科植物中提取获得,具有显著的抗炎症和抗肿瘤作用,因其来源丰富、价格低廉、获取成本低、不良反应小的特点而广受科研工作者的青睐[5]。然而,PTL对骨肉瘤的作用及分子机制尚不清楚。本研究检测PTL对体外培养的骨肉瘤细胞活性和凋亡的作用,通过细胞和分子水平探究PTL促进骨肉瘤细胞凋亡的作用及信号通路,为临床防治骨肉瘤提供实验依据。
1 材料和方法
1.1 实验材料 PTL(批号552337)购自北京百灵威科技有限公司,人骨肉瘤细胞(U2OS细胞)购自上海信裕生物技术有限公司,DMEM培养基、青霉素/链霉素均购自Gibco公司,血清购自美国康宁公司,Bax(批号A00183)、Caspase 3(批号BA2142)、Bcl-2(批号A00040-2)单克隆抗体均购自武汉博士德公司,Cleaved-Caspase 3(批号ab32042)购自英国Abcom公司,TUNEL 细胞凋亡原位检测试剂盒(批号QIA33)抗体购自美国Sigma-Aldrich公司,转膜仪(型号:TY-201-01)购自南京中科通仪公司,Real time RCR仪(型号qTOWER 2.0)购自德国耶拿公司,拍照显微镜(型号XSP-63)购自宁波湛京公司。
1.2 实验方法
1.2.1 PTL对骨肉瘤细胞活力的影响:骨肉瘤细胞用α-DMEM完全培养基培养(含10%FBS和1%青霉素/链霉素),细胞复苏后,待细胞铺满瓶底,加入胰酶,消化2 min,之后加入培养基终止,离心并重悬细胞,得到浓度为1×104/ml的细胞悬液。使用96孔板培养细胞,每孔加入200 μl细胞悬液,待细胞贴壁后,使用PTL浓度以此为0、5、10、20、40 μmol/L的培养基培养24 h,10 μl CCK-8反应液逐孔加入,培养箱孵育1 h,用酶标仪检测细胞吸光度(波长设置为490 nm)。
1.2.2 流式细胞双重染色法检测细胞凋亡:向T-25培养中加入5 ml培养液(细胞浓度为1×105/ml),实验分为:对照组(0 μmol/L PTL组);PTL组(5、10、20、40 μmol/L),培养时间结束后,收集细胞,细胞与FITC-AnnexinV+ PI反应液,避光孵育10 min,然后上机,进行细胞凋亡检测,每个样品重复测定3次,并进行统计分析。
1.2.3 TUNEL法检测细胞凋亡:将洁净的玻片置入6孔板,用吸管吸取赖氨酸对玻片进行涂抹处理,放入培养箱过夜,次日加入浓度为104/ml的细胞悬液,每孔2 ml,待细胞贴壁后,换用含PTL(20 μmol/L)或不含PTL的培养基。培养24 h后,经4%多聚甲醛固定,进行细胞凋亡检测,步骤参看TUNEL细胞凋亡检测试剂盒。
1.2.4 蛋白印迹法检测Bax、Bcl-2、Cleaved-Caspase 3、Caspase 3蛋白表达:待细胞(105/孔)贴壁后,换用含PTL或不含PTL的培养基,培养24 h后,用细胞刮收集细胞,置于冰上,每管加入RIPA裂解液300 μl,经离心,变性得到蛋白样品。使用伯乐电泳设备进行SDS电泳和半干转,最终蛋白完整地转移到PVDF膜上,PVDF膜经过PBST浸泡和洗涤,用5%脱脂牛奶封闭1 h,用一抗稀释液稀释抗体得到 Bcl-2(1∶1500)、Bax(1∶1500)、GAPDH(1∶3000)、Cleaved-Caspase 3(1∶1500)和Caspase 3(1∶1000)一抗稀释液,抗体完全浸没PVDF膜后,在摇床上4 ℃孵育过夜,次日,将膜用PBST洗涤3次后,加入显色液,使用伯乐ECL成像仪显色,拍照,用Image Lab6.0软件进行定量分析。
1.2.5 Real time PCR检测Bax、Bcl-2、Cleaved-Caspase 3、Caspase 3 mRNA表达:细胞处理分组和步骤与1.2.4一致。培养24 h后,移除培养基,用1 ml Trizol裂解细胞5 min,收集至离心管,经过离心沉淀等步骤,得到RNA,用DEPC处理过的纯水溶解RNA。按照TB GreenTMPremix Ex TaqTM试剂盒,将反应液、引物和cDNA模板按照比例混匀并加入96孔板,使用德国耶拿Qtower96G荧光定量PCR仪进行检测并分析。各基因引物序列见表1。
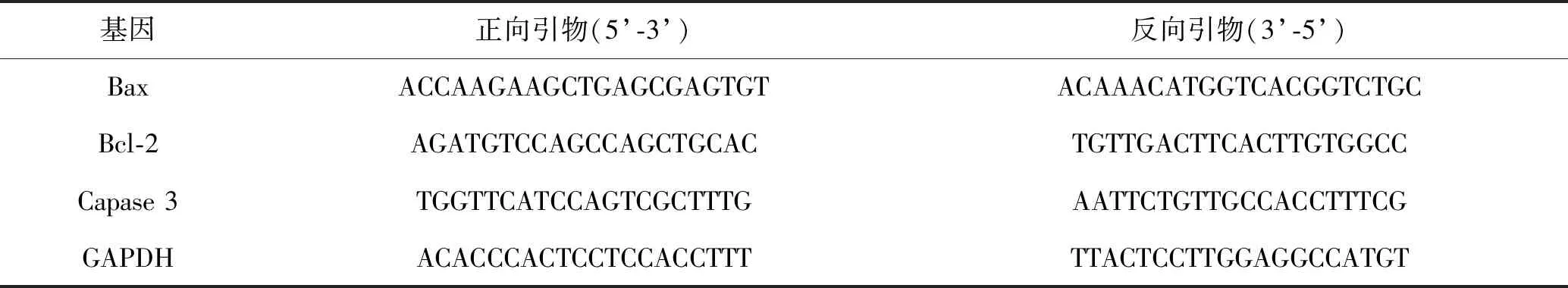
表1 基因引物序列
2 结 果
2.1 PTL对骨肉瘤细胞活力的影响 见图1。CCK-8结果表明,PTL浓度为5、10 μmol/L时,对骨肉瘤细胞活性没有显著抑制作用(均P>0.05)。随着PTL浓度梯度增加,当PTL浓度为20、40 μmol/L时,PTL对骨肉瘤细胞活性的抑制作用明显增加,与对照组相比,其差异均具有统计学意义(均P<0.05),但20、40 μmol/L PTL对骨肉瘤细胞的抑制作用比较无统计学差异(均P>0.05)。
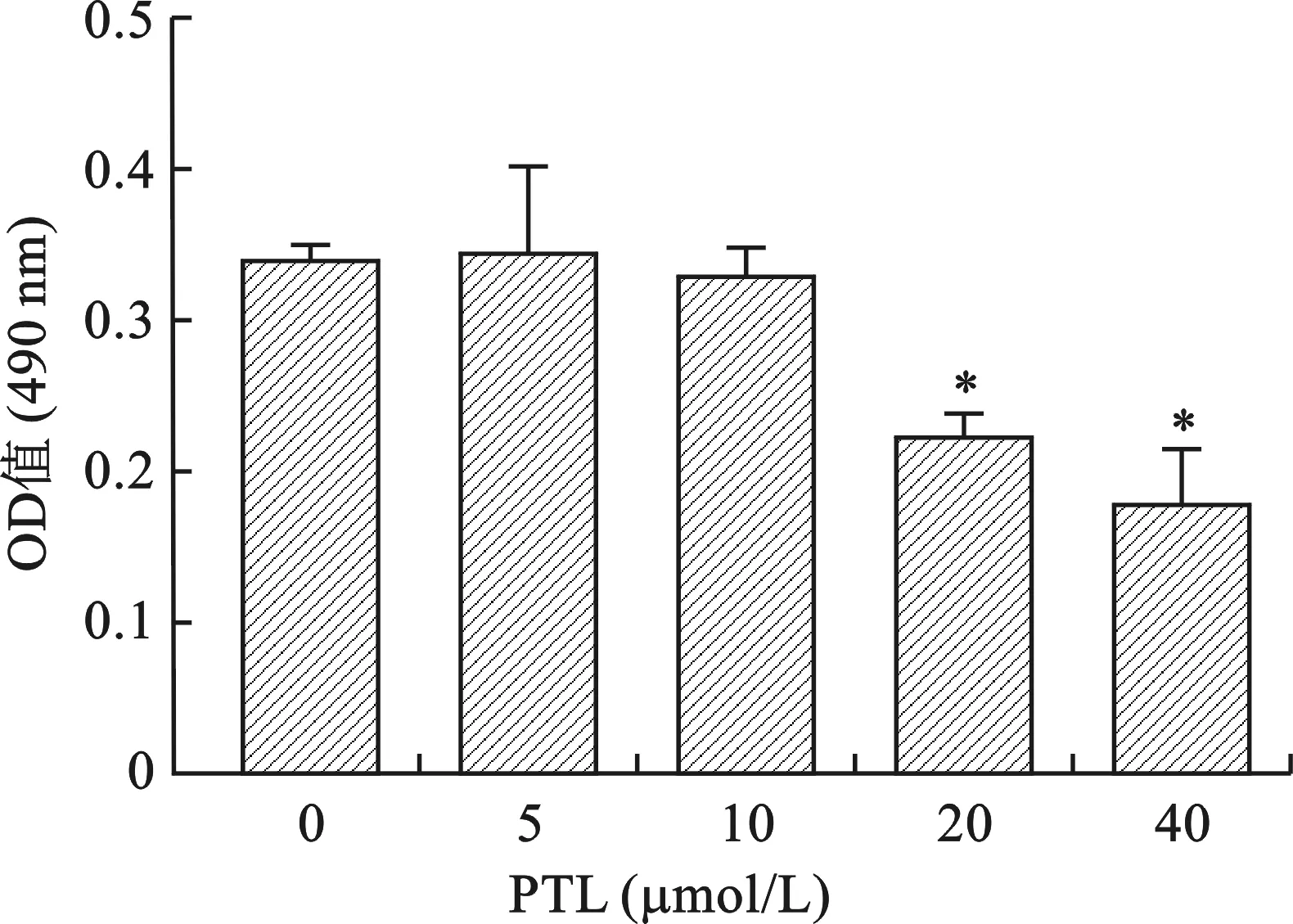
注:与对照组相比,*P<0.05
2.2 PTL对骨肉瘤细胞凋亡的影响 见表2(图2)。10、20 μmol/L的PTL对细胞凋亡无显著影响(均P>0.05)。随着浓度的增加,PTL(20、40 μmol/L)显著促进细胞凋亡,与对照组相比差异具有统计学意义(均P<0.05),但20、40 μmol/L PTL对骨肉瘤细胞的促凋亡作用无统计学差异(均P>0.05),因此,在本研究中,后续实验均采用20 μmol/L PTL。采用TUNEL法检测细胞凋亡,PTL显著促进骨肉瘤细胞凋亡,与对照组相比差异有统计学意义(P<0.05)。

表2 各组间细胞凋亡率比较(%)

注:与对照组相比,*P<0.05
2.3 PTL对骨肉瘤细胞Bax、Bcl-2、Cleaved-Caspase 3、Caspase 3 mRNA和蛋白表达的影响 见图3、4。结果显示,20 μmol/L PTL 显著上调骨肉瘤细胞促凋亡蛋白Bax mRNA和蛋白水平表达(均P<0.05),显著抑制抑凋亡蛋白Bcl-2 mRNA和蛋白水平的表达(均P<0.05)。Caspase 3作为细胞凋亡的最终执行者,20 μmol/L PTL显著促进Caspase 3 mRNA和Cleaved-Caspase 3蛋白表达上调(均P<0.05),且促进Cleaved-Caspase 3/Caspase 3比值上调(P<0.05),最终致使骨肉瘤细胞发生凋亡,与对照组相比,其差异均具有统计学意义(均P<0.05)。
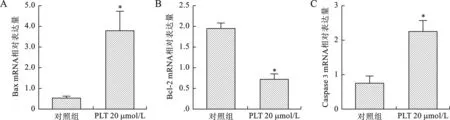
注:与对照组相比,*P<0.05
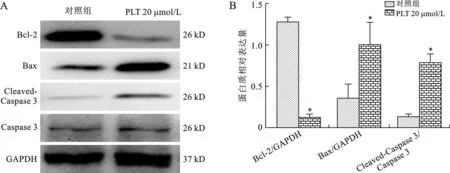
注:与对照组相比,*P<0.05
3 讨 论
文献[6]报道,PTL具有优异的抗癌活性,且对正常细胞无不良反应。大量研究[7]证明,PTL对多种肿瘤细胞均具有抗肿瘤作用。本研究通过细胞活性实验和流式细胞凋亡实验发现,低浓度的PTL(5、10 μmol/L)对骨肉瘤细胞活力无显著影响,20、40 μmol/L PTL可以有效促进骨肉瘤细胞凋亡,但两组间差异无统计学意义。因此后续实验采用20 μmol/L为工作浓度。通过Western blot和Real time PCR检测PTL对骨肉瘤细胞凋亡相关蛋白及基因表达的影响。
凋亡,是由众多细胞内外信号通路参与调控,各种细胞转录因子和凋亡信号传导通路传至细胞内,通过转录激活,激活靶基因产生效应,引起凋亡,是由调控细胞,维持细胞新陈代谢的重要机制[8]。细胞凋亡可以由不同的刺激物诱导,例如细胞毒性药物、辐射和缺氧应激。药物诱导肿瘤细胞凋亡是目前肿瘤研究的热点[9]。Bcl-2具有抗凋亡的功能,Bax具有促凋亡的功能[10-12],它们均属于Bcl-2家族蛋白。细胞凋亡的走向取决于Bax/Bcl-2比值。本研究中,PTL显著促进促凋亡Bax,并抑制Bcl-2的表达,骨肉瘤细胞内Bax/Bcl-2比例升高,引发细胞凋亡。
文献报道,Caspase 系列酶激活在Fas 引发的外源性凋亡过程中发挥着重要的作用[13], Caspase 8 的活化是反应的起始酶,Caspase 8的活化作为中间酶激活下游酶Caspase 9和Caspase 3[14]。Caspase 3作为细胞凋亡的关键酶,也是最著名的细胞凋亡标志物之一,是细胞凋亡的最终执行者,Caspase 3一旦被激活,预示着细胞凋亡的发生将不可逆转[15-17],Cleaved-Caspase 3是Caspase 3蛋白水解产物。Caspase 3一旦被水解活化,就会转移到细胞核中,在细胞核切割特定的底物。本研究中,用PTL处理骨肉瘤细胞后,发现相比对照组,处理组细胞凋亡百分比显著增加,而Western blot和Real time PCR结果也显示Cleaved-Caspase 3/Caspase 3比值上调,该结果从分子水平证实PTL促进骨肉瘤细胞发生凋亡。
有文献报道,PTL可通过上调 Bax 和降低Bcl-2 mRNA 表达诱导人前列腺癌细胞PC-3发生凋亡[18],也有研究显示,PTL通过促进 HepG2细胞内产生活性氧,进而引发细胞凋亡[19]。也有研究表明PTL通过诱导BGC-823细胞周期产生阻滞并促进细胞凋亡,PTL的抗肿瘤作用可能抑制了STAT3/E2F1信号通路[20],本研究证实PTL通过增加Cleaved-Caspase 3/Caspase 3比值诱导骨肉瘤细胞凋亡,在后续研究中,需要进一步从活性氧和细胞周期方面对PTL的促凋亡作用进行深入研究。
本研究证实PTL下调Bcl-2,上调Bax表达、最终导致Cleaved-Caspase 3/Caspase 3比例上调,引发骨肉瘤细胞发生凋亡,因此,本研究为PTL用于临床治疗骨肉瘤提供了理论依据。
