氮源对嗜热链球菌胞外多糖表型特征的影响
2022-02-18乔少婷李嘉雯田佳乐孙天松
刘 洋,乔少婷,李嘉雯,田佳乐,丹 彤,孙天松
(内蒙古农业大学 乳品生物技术与工程教育部重点实验室 农业农村部奶制品加工重点实验室内蒙古自治区乳品生物技术与工程重点实验室 呼和浩特 010018)
多数乳酸菌(Lactic acid bacteria)是安全的(Generally recognized as safe,GRAS),具有多种潜在的益生功能,广泛应用于医药、乳制品等[1]。乳酸菌在代谢过程中产生的次级代谢产物胞外多糖(Exopolysaccharides,EPS)属于大分子物质,结构复杂多样,不仅为机体提供生命活动的能量[2],还可作为增稠剂、稳定剂等应用于发酵乳制品[3]。据报道,乳酸菌胞外多糖具有抗氧化[4]、抗肿瘤,降低胆固醇[5],增强免疫力[6]和改善肠道微生态环境等特性[7]。如Laiño 等[8]研究表明乳酸菌与其所产生的胞外多糖以相互作用的方式可减少肠上皮细胞的炎症;Maeda 等[9]发现开菲尔乳杆菌产生的EPS,可降低血清胆固醇水平,抑制血压升高。
乳酸菌菌种、培养条件和培养基组分等因素的变化对胞外多糖的表型有影响[10]。当前,关于培养基中碳源类型对胞外多糖产量影响的报道较多,如陈营等[11]发现以葡萄糖为碳源时EPS 的产量相对较高,较低温度下更适合多糖的合成和积累。Aparna 等[12]发现在M17 培养基中添加1%蔗糖后,嗜热链球菌1275 胞外多糖的产量明显提高。刘晶等[13]发现当培养基中果糖的添加量为2%时,副干酪乳杆菌VL8 的胞外多糖产量提高了2.6倍。然而,关于培养基中氮源类型对胞外多糖表型影响的报道较少。本研究以大豆蛋白胨、胰蛋白胨、酪蛋白胨分别替换M17 培养基中复合氮源,以M17 基础培养基为对照,采用凝胶渗透色谱(Gel permeation chromatography,GPC) 测定嗜热链球菌IMAU20561 胞外多糖各组分的分子质量,采用红外光谱(Infrared spectrum,IR)和高效液相色谱仪(High performance liquid chromatography,HPLC)研究胞外多糖不同组分的理化性质,分析培养基中不同氮源对嗜热链球菌胞外多糖产量、分子质量和结构的影响。
1 材料与方法
1.1 材料与试剂
嗜热链球菌IMAU20561 (Streptococcus thermophilus),由内蒙古农业大学乳酸菌菌种资源库(Lactic acid bacteria collection center,LABCC)提供。
大豆蛋白胨、胰蛋白胨、酪蛋白胨、β-甘油磷酸二钠、抗坏血酸钠、酵母粉、硫酸镁、95%无水乙醇、三氯乙酸、苯酚、盐酸、浓硫酸(均为分析纯级),天津市风船化学试剂科技有限公司;M17 液体培养基,海博生物技术(青岛)有限公司;透析袋8 000~14 000 u,北京Solarbio 公司;氯化钠、氢氧化钠,天津市汇杭化工科技有限公司;DEAE-Cellulose 52,Coolaber 公司;Sepharose CL-6B,瑞士Sigma 公司。
1.2 设备与仪器
超净工作台,上海智城分析仪器制造有限公司;电热恒温培养箱,上海坤天试验仪器有限公司;高压灭菌锅,日本HIRAYAMA 公司;DHL-BN型电脑恒流泵、TH-500A 梯度混合器、CBS-B 程控多功能全自动部分收集器,上海青浦沪西仪器厂;SCIENTZ-10N 型真空冷冻干燥机,宁波新芝生物科技股份有限公司;DL-6M 型高速冷冻离心机,cence 湘仪集团;电子天平,上海浦春计量仪表有限公司;UV-1700 型紫外分光光度计、IR Affinity-1 型傅立叶变换红外光谱仪,日本SHIMADZU公司;ELEOS System 凝胶色谱仪,美国Wyatt 公司;Agilent1200 高效液相色谱仪,美国Agilent 公司。
1.3 试验方法
1.3.1 IMAU20561 胞外多糖的制备及测定
1) 胞外多糖的制备 将-80 ℃保存的IMAU20561 嗜热链球菌于M17 液体培养基活化,以1×10-7CFU 的接种量接于不同氮源培养基中,37 ℃,24 h 培养两代。将发酵液以12 000×g 离心25 min,去菌泥,上清液加80%三氯乙酸至终含量为4%,充分搅拌,4 ℃静置10 h。将静置后的发酵液12 000×g 离心25 min,取上清液,加3 倍体积无水乙醇,4 ℃静置24 h,12 000×g 离心25 min,取沉淀用少量蒸馏水复溶,在8 000~14 000 u 的透析袋中透析48 h,每6 h 换1 次水,将透析液-20℃冷冻,真冷冻干燥得粗多糖。
2) 胞外多糖标准曲线绘制 分别吸取葡萄糖标准溶液 0.0,0.1,0.2,0.3,0.4,0.5 mL 于具塞试管中,用蒸馏水补至0.5 mL,使各管含糖量分别为20,40,60,80,100 mg/L。每管加1 mL 6%苯酚溶液,迅速加入5 mL 浓硫酸,30 ℃水浴15 min,在波长490 nm 处测定吸光度。以葡萄糖浓度为横坐标,吸光度为纵坐标,绘制葡萄糖标准曲线,如图1所示,回归方程为:y = 0.0255x + 0.0109(R2=0.9969)。
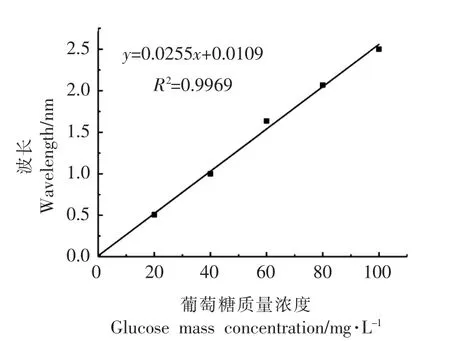
图1 葡萄糖标准曲线Fig.1 Standard curve of glucose
采用苯酚硫酸法[14]测定胞外多糖含量,于波长490 nm 处测定吸光度。以蒸馏水做空白对照,将所测吸光度值代入回归方程计算胞外多糖含量。
1.3.2 不同氮源对IMAU20561 胞外多糖结构影响
1.3.2.1 胞外多糖的纯化 将冻干后的20 mg/mL 粗多糖以的质量浓度于DEAE Sepharose-52纤维柱中进行第1 次纯化,收集不同EPS 组分并标记,将不同组分的EPS 以150 mg/mL 的质量浓度于Sepharose CL-6B 凝胶柱中进行第2 次纯化,收集纯化后的EPS 冷冻干燥。
1.3.2.2 各组分胞外多糖的纯度及分子质量测定 采用凝胶色谱法(Gel permeation chromatography,GPC) 对各组分EPS 分子质量、纯度进行测定。色谱条件:流动相:水+0.02%NaN3,色谱柱:Shodex OHpak 系列SB-806 串803,流速1 mL/min,柱温40 ℃,进样量500 μL。采用GPC 软件计算分子质量,根据峰值的对称性及出峰时间分析胞外多糖的纯度及分子质量。
1.3.2.3 各组分多糖的红外光谱检测 取适量胞外多糖样品与一定量的KBr 粉末充分混合研磨、压片。用傅里叶红外光谱仪测定,在4 000~400 cm-1波段扫描。
1.3.2.4 各组分的单糖组成 采用高效液相色谱仪检测各组分的单糖组成。称取一定量样品于水解管中,加1 mL 超纯水,1 mL 4 mol/L 三氟乙酸(Trifluoroacetate,TFA),充氮,110 ℃水解2 h,冷却至室温。取0.1 mL 于4 mL 离心管中,在60 ℃真空干燥箱中干燥2 h,向离心管内加入0.05 mL 0.3 mol/L NaOH,0.05 mL PMP 甲醇溶液,充氮,70 ℃水浴60 min,冷却至室温,加0.5 mL 0.3 mol/L HCl,0.75 mL 水,1.5 mL 氯仿,充分振荡摇匀后静置分层,弃下层液体氯仿。萃取3 次后,取水层,用0.45 μm 过滤膜除去杂质,用液相色谱仪分析。色谱条件:色谱柱为SHISEIDO C18 柱(4.6 mm×250 mm,5 μm),流动相:0.1 mol/L KH2PO4(pH 6.8)与乙腈体积比82∶18,流速1.0 mL/min,柱温25 ℃,波长245 nm。
2 结果与分析
2.1 IMAU20561 胞外多糖产量
以基础培养基M17 作对照,采用苯酚硫酸法测定以大豆蛋白胨、胰蛋白胨、酪蛋白胨为唯一氮源的M17 培养基中嗜热链球菌IMAU20561 胞外多糖的产量(图2)。可以看出,基础培养基M17 的胞外多糖产量为150.8 mg/L,以大豆蛋白胨为唯一氮源时的产量为480.7 mg/L,与基础培养基M17 相比提高2 倍多,胰蛋白胨培养基所产的EPS 量为175 mg/L,而酪蛋白胨培养基的EPS 产量最低,仅为28.1 mg/L。可见,不同氮源作培养基时嗜热链球菌IMAU20561 胞外多糖产量差异较大,这主要是因氮源是乳酸菌生长过程中的重要营养物质,不同氮源中的营养成分影响胞外多糖合成途径中相关酶的活性[15],从而影响胞外多糖的产量。近年来,关于氮源对胞外多糖的合成及产量的影响广受关注。如Khanh 等[16]发现酵母提取物、牛肉膏和蛋白胨等氮源能促进植物乳杆菌T10 产胞外多糖。Almalki[17]研究发现硫酸铵、酪蛋白、脱脂牛奶和燕麦粉等作为乳酸杆菌的氮源时EPS 的产量明显增加;Fazilet 等[18]研究发现硝酸钠和细菌学蛋白胨对不同菌株EPS 产量的影响差异较大,特别是无机氮源硝酸钠会抑制乳酸菌胞外多糖的合成。
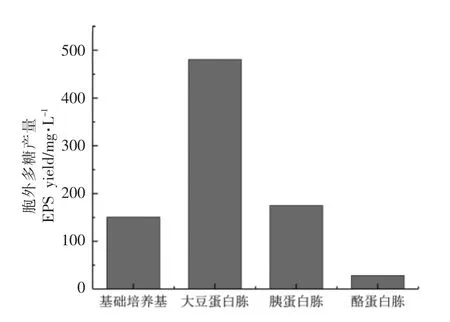
图2 不同氮源时胞外多糖的产量Fig.2 EPS yield under different nitrogen sources
2.2 IMAU20561 胞外多糖的纯化分离
2.2.1 胞外多糖DEAE-Cellulose 52 离子柱纯化 DEAE-Cellulose 52 纯化是利用分离物自身所带电荷不同,与离子交换剂结合能力的差异,经不同浓度的缓冲液洗脱,达到纯化的目的。嗜热链球菌IMAU20561 在大豆蛋白胨、胰蛋白胨、酪蛋白胨为单一氮源的M17 培养基中培养24 h,提取的粗EPS 经DEAE-Cellulose 52 纯化得到的EPS 组分如图3所示。大豆蛋白胨作唯一氮源时,M17 培养基所得粗EPS 经去离子水洗脱收集,冷冻干燥得到3 个组分:EPS 1-1 和EPS 1-2 为中性多糖,EPS 1-3 为酸性多糖或带有酸性基团的糖复合物。胰蛋白胨作唯一氮源时M17 培养基提取的粗多糖纯化得到3 个组分:EPS 2-1 为不带电荷的中性多糖,EPS 2-2 和EPS 2-3 为酸性多糖或带酸性基团的糖复合物。酪蛋白胨为唯一氮源时M17 培养基提取的粗多糖经分离纯化得到2 个组分,其中EPS 3-1 为不带电荷的中性多糖,EPS 3-2 为带负电荷的酸性多糖或带有酸性基团的糖复合物。基础培养基M17 所得粗多糖经离子交换柱纯化得到2 个组分,分别为中性多糖EPS 4-1和酸性多糖EPS 4-2。分别收集上述各组分中产量较高的EPS 1-3,EPS 2-3,EPS 3-1,EPS 4-1进行后续试验。
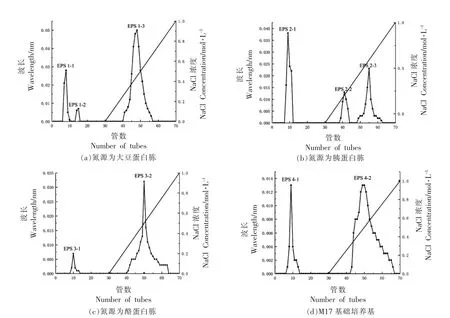
图3 不同氮源粗EPS 经DEAE-Cellulose 52 离子交换色谱柱梯度洗脱曲线Fig.3 Stepwise elution curve of crude EPS from different nitrogen sources on DEAE-Cellulose 52 chromatography column
2.2.2 胞外多糖Sepharose CL-6B 凝胶柱层析纯化 收集到的EPS 1-3,EPS 2-3,EPS 3-1,EPS 4-1 经Sepharose CL-6B 纯化,结果如图4所示。所得各组分均为单一峰,峰值对称,相对分子质量都较为均一。

图4 胞外多糖经Sepharose CL-6B 色谱柱的洗脱曲线Fig.4 Elution curves of EPS on Sepharose CL-6B chromatography column
2.3 IMAU20561 各组分胞外多糖分子质量
各组分胞外多糖分子量的测定结果由图5所示。多糖组分EPS 1-3,EPS 2-3,EPS3-1,EPS4-1经凝胶色谱仪的双检测器检测后均为单一对称峰,4 种组分均为单一多糖与凝胶过滤色谱法所得结果一致。
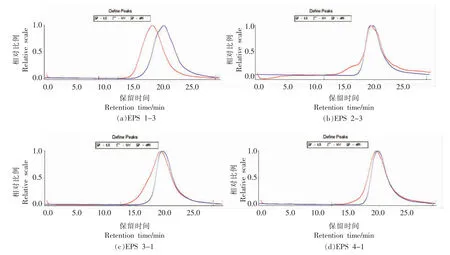
图5 胞外多糖的GPC 图谱Fig.5 GPC chromatogram of EPS
各EPS 组分的分子质量见表2,4 种组分的EPS 多分散系数(PDI,Mw/Mn)均小于3,表明分子质量分布的范围都较均一[19]。多糖的分子质量与胞外多糖水溶液的黏度呈正相关关系[20]。本试验中EPS 3-1 的分子质量远高于其它3 种多糖组分,说明酪蛋白胨作为唯一氮源时产生的多糖可增加乳制品中的黏度,可作为增稠剂、稳定剂等应用于乳制品生产中[21]。

表2 胞外多糖的分子特征Table 2 The molecular characteristic of EPS
2.4 IMAU20561 各组分多糖的单糖检测结果
2.4.1 各组分多糖的红外光谱检测结果 用红外光谱可以识别吡喃糖、呋喃糖,确定糖苷键的类型、糖的构型及EPS 链上羟基取代的信息,是鉴别多糖结构的重要方法。由图6可知,在3 600~3 200 cm-1范围内,EPS 1-3、EPS 2-3、EPS 3-1和EPS 4-1 都有一个宽而强的吸收峰,是由-OH键伸缩振动引起的;在2 930 cm-1附近的吸收峰为C-H 伸缩振动峰,是典型的多糖特征峰[22];在1 700~1550cm-1范围内,吸收峰为1632.65,1646.97 cm-1和1 643.39 cm-1,是羧基的对称或非对称伸缩振动[23];在1 500~950 cm-1范围为碳水化合物的指纹区域,在1 410~1 200 cm-1范围的吸收峰为C-H 的变角振动[2];1 026~1 049 cm-1和920~927 cm-1范围为吡喃糖环的对称或非对称伸缩振动吸收峰[24];在840~920 cm-1范围有多个吸收峰表示样品同时存在α 和β 构型[23]。可见,不同氮源培养基中获得的胞外多糖在构型上相似度较高,官能团差异较小。酸性多糖EPS 1-3 与EPS 2-3 都含有羟基、亚甲基等官能团。水洗纯化的多糖组分EPS 3-1 与EPS 4-1 主要官能团组成相似,EPS 1-3 在1 640 cm-1附近没有明显峰值,不能判断是否含有羧基,在多糖指纹区没有明显差异,差异性较小。
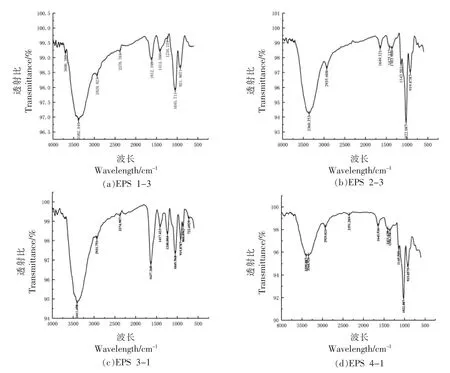
图6 胞外多糖的红外光谱图Fig.6 FT-IR spectrum of EPS
2.4.2 各组分的单糖组成 不同氮源的M17 培养基中嗜热链球菌IMAU20561 胞外多糖各组分的HPLC 分析结果见图8。图7为标准品单糖的出峰时间:①甘露糖(Man)(RT=13.375 min);②核糖 (Rib)(RT=17.121 min);③鼠李糖(Rha)(RT=17.872 min);④葡萄糖醛酸(GlcA)(RT=20.974 min);⑤半乳糖醛酸 (GalA)(RT=24.226 min);⑥葡萄糖(Glc)(RT=27.432 min);⑦半乳糖(Gal)(RT=31.296 min);⑧木糖(Xyl)(RT=32.538 min);⑨阿拉伯糖(Ara)(RT=34.144 min);⑩)岩藻糖(Fuc)(RT=38.673 min)。
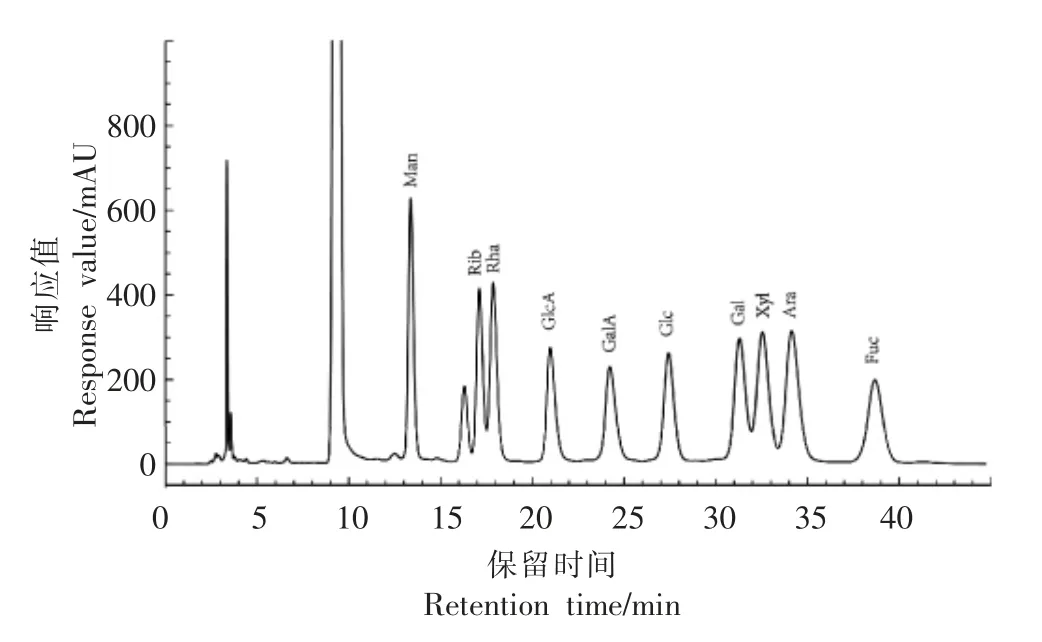
图7 单糖标准品的液相色谱图Fig.7 Liquid chromatogram of monosaccharide reference

图8 各组分的单糖组成分析图Fig.8 Analysis of monosaccharide composition of EPS
比对纯化的各组分胞外多糖的单糖组成与单糖标准品色谱图,根据出峰顺序及保留时间得出各组分之间的单糖种类及含量有一定的差异。EPS 1-3 和EPS 2-3 为酸性多糖,EPS 1-3 主要由半乳糖醛酸、半乳糖和阿拉伯糖组成,物质的量的比为1∶1.24∶0.68。EPS 2-3 主要由葡萄糖醛酸、葡萄糖和半乳糖3 种单糖组成,占总物质的量的85.58%,物质的量的比为1.84∶0.15∶1,这 与DEAE-Cellulose 52 离子柱纯化结果较一致。EPS 3-1 和EPS 4-1 主要由甘露糖、葡萄糖和半乳糖组成,物质的量的比分别为1∶8.36∶0.15 和1∶3.68∶0.14。这两种中性多糖组分的物质的量的比和单糖的种类差异较小,还需进一步确定是否为同类型多糖。
3 结论
乳酸菌是公认的食品级安全微生物,其在乳制品发酵过程中会产生次级代谢产物胞外多糖,而胞外多糖具有独特的流变学特性和分子结构,可作为增稠剂、乳化剂和稳定剂等在乳制品生产中发挥重要作用。本试验以分离自传统发酵乳制品中的嗜热链球菌IMAU20561 为对象,研究不同氮源对胞外多糖表型特征的影响,得到如下结论:
1) 由不同氮源的M17 培养基获得的胞外多糖的产量不同,当大豆蛋白胨为唯一氮源时,胞外多糖产量最高,达480.7 mg/L。
2) 由不同氮源的M17 培养基所得胞外多糖分子质量也有显著差异,以酪蛋白胨为唯一氮源的M17 培养基所得EPS 分子质量最大,其次为基础培养基M17、大豆蛋白胨培养基和胰蛋白胨培养基。
3) 有不同氮源的M17 培养基生产的胞外多糖结构有显著差异,各单糖组成的百分比有所不同。
