健脾祛湿方联合美沙拉嗪治疗克罗恩病疗效观察*
2022-02-18拉扎提巴合提雷云霞
盛 好,拉扎提·巴合提,徐 杰,雷云霞
新疆医科大学附属中医医院,新疆 乌鲁木齐 830000
克罗恩病(Crohn’s disease,CD)的发病机制目前不完全清楚,本病的特征性病理表现是不连续的、全层的炎症改变,本病可发生在胃和肠道的各个部位,临床常见腹泻、腹痛,病情反复、迁延难愈[1]。根据相关研究数据[2],本病在我国的发病率为2.29/10 万,但是随着医学诊疗技术的发展以及人们对健康越来越关注,本病的发病率有增加趋势。目前没有治疗本病的特效药物,也没有明确的预防措施,临床主要以缓解临床症状、减少反复发作为主。氨基水杨酸制剂、糖皮质激素、免疫抑制剂等是克罗恩病的常用药。有研究发现[3-4],肠道炎症的产生与炎性细胞因子释放增加关系密切,因此抑制炎性细胞因子释放的药物对于治疗本病具有重要意义。中医药治疗克罗恩病有明显疗效,中医认为克罗恩病为虚实夹杂,因虚致实,虚主要指脾胃虚弱,实主要指湿邪,故治疗主要以健脾祛湿为主,本研究应用健脾祛湿方治疗克罗恩病,现报道如下。
1 资料与方法
1.1 临床资料将2017年4月至2018年10月在新疆医科大学附属中医医院就诊的中度活动期CD 患者90 例随机分为对照组和试验组各45 例。对照组中男28 例,女17 例;年龄24~49 岁,平均(37.0±7.9)岁;简化CDAI 评分(7.01±0.98)分;病程3~13 年,平均(6.98±4.12)年。试验组中男24 例,女21 例;年龄23~58 岁,平均(38.6±7.2)岁;简化CDAI 评分(6.94±1.15)分;病程3~13 年,平均(7.20±2.98)年。两组一般资料比较差异无统计学意义(P>0.05),本实验通过医院医学伦理委员会审核。
1.2 诊断标准参考《炎症性肠病诊断与治疗的共识意见》[5](2012年修订版本)的诊断标准及其关于CD 的简化克罗恩疾病活动指数(Crohn’s disease activity index,CDAI)评分5~8分。
1.3 纳入标准1)符合相关诊断标准;2)年龄18~65岁;3)患者知情同意并签署知情同意书。
1.4 排除标准1)其他并发症、药物过敏、该实验所用药物禁忌症以及近期使用激素类药物或免疫抑制剂者;2)妊娠期、哺乳期妇女;3)合并严重消化系统、循环系统疾病及精神疾患无法配合本研究者。
1.5 治疗方法
1.5.1 对照组 使用美沙拉嗪肠溶片(惠迪,葵花药业,国药准字H19980148,规格:0.25 g/片)每次1 g,每日3次,根据病情逐渐减量,同时补钙治疗。
1.5.2 试验组 在对照组治疗基础上,加用健脾祛湿方,药物组成:党参18 g,炒白术30 g,茯苓30 g,炙甘草9 g,桔梗9 g,升麻9 g,薏苡仁30 g,白蔻仁9 g,砂仁(后下)9 g。每日1剂。早、晚温服。
两组均治疗2个月。
1.6 观察指标
1.6.1 CDAI 评分及CD 内镜评分 疾病活动的严重程度采用CDAI 方法评估,内镜下病变严重程度采用CD简化内镜(SES-CD)评分。
1.6.2 sPLA2、ESR、CRP 定量分析 分泌型磷脂酶A2(secretory phospholipase A2,sPLA2)指标分析委托新疆医科大学医学检验中心,主要试剂盒(Human sPLA2 ELISA KIT)由上海沪鼎生物科技生产,货号:D-11062;采用魏氏法检测红细胞沉降率(erythrocyte sedimentation rate,ESR);全自动免疫透视比浊法测定C反应蛋白(C-reaction protein,CRP,美国Beckman Coulter 生产);ESR和CRP检测在医院检验科完成。
1.6.3 IL-6、TNF-α和MCP-1 检测 清晨空腹使用抗凝采血管采取患者静脉血5 mL,离心取上清液。白细胞介素6(interleukin-6,IL-6,上海西唐生物科技公司,货号:F01310)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α,上海西唐生物科技公司,货号F02810)和单核细胞趋化因子1(monocyte chemoattractant protein-1,MCP-1,上海西唐生物科技公司,货号:F01700)采用酶联免疫吸附试验(ELISA 法):1)设置标准品孔和样本孔,标准品孔各加不同浓度的标准品50 μL;样本孔先加待测样本10 μL,再加样本稀释液40 μL;空白孔不加;2)标准品孔和样本孔中每孔加入辣根过氧化物酶标记的检测抗体100 μL,用封板膜封住反应孔,37℃恒温箱温育60 min;3)弃去液体,吸水纸上拍干,将孔内清洗干净后拍干晾干;4)每孔加入底物A、B 各50 μL,37℃避光孵育15 min 后每孔加入终止液50 μL,在450 nm波长处测定各孔的OD 值;5)所有吸光度值均减除空白值后乘以稀释倍数5 倍,进行下一步计算;6)以标准品的吸光度值绘制标准曲线,推导回归方程,计算待测血清中细胞因子含量,本院检验科负责检测。
1.7 安全性评估记录患者不良反应及副作用。
1.8 统计学方法采用SPSS 20.0 统计软件分析数据,如数据符合正态分布,计数资料以构成比及率描述,采用χ2检验,计量资料以±s表示,采用t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 CDAI 与SES-CD 内 镜 评 分两 组CDAI 与SES-CD 方法评分治疗前后及治疗后比较差异均有统计学意义(P<0.05)。见表1。
表1 两组患者治疗前后CDAI与SES-CD内镜评分比较(±s) 分

表1 两组患者治疗前后CDAI与SES-CD内镜评分比较(±s) 分
注:*表示与本组治疗前比较P<0.01;#表示与对照组治疗后比较,P<0.05
组别对照组试验组tp例数45 45简化CDAI评分干预前6.88±1.06 7.01±0.98-0.604 0.397干预后1个月5.51±0.56*3.55±0.47*#17.984 0.000干预后2个月4.85±0.77*2.79±0.71*#13.194 0.000 SES-CD评分干预前5.90±1.73 6.01±1.98-0.281 0.711干预后1个月4.26±1.01*4.09±0.89*#0.847 0.151干预后2个月3.80±1.13*3.02±0.81*#3.763 0.049
2.2 sPLA2、ESR、CRP与治疗前比较,两组患者sPLA2、ESR和CRP水平均降低,差异具有统计学意义(P<0.01);治疗后试验组3 个指标均较对照组低,差异具有统计学意义(P<0.05)。见表2。
表2 两组患者治疗前后sPLA2、ESR及CRP比较(±s)
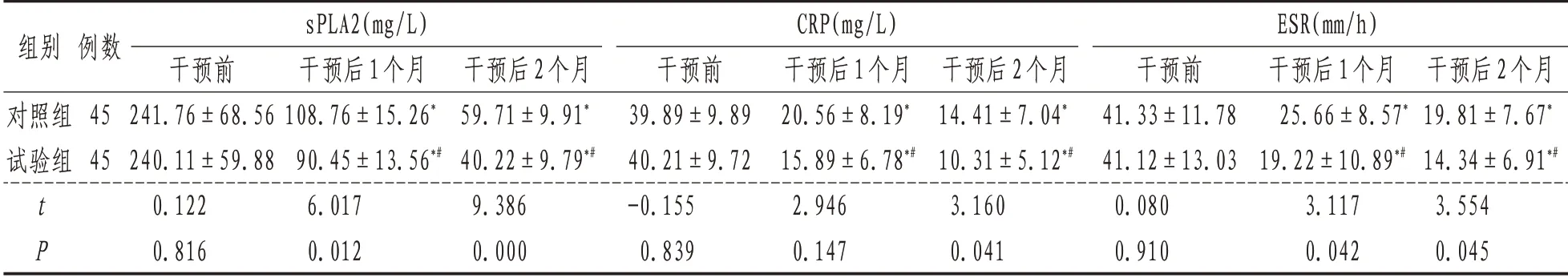
表2 两组患者治疗前后sPLA2、ESR及CRP比较(±s)
注:*表示与本组治疗前比较,P<0.01;#表示与对照组治疗后比较,P<0.05
组别对照组试验组tP例数45 45 sPLA2(mg/L)干预前241.76±68.56 240.11±59.88 0.122 0.816干预后1个月108.76±15.26*90.45±13.56*#6.017 0.012干预后2个月59.71±9.91*40.22±9.79*#9.386 0.000 CRP(mg/L)干预前39.89±9.89 40.21±9.72-0.155 0.839干预后1个月20.56±8.19*15.89±6.78*#2.946 0.147干预后2个月14.41±7.04*10.31±5.12*#3.160 0.041 ESR(mm/h)干预前41.33±11.78 41.12±13.03 0.080 0.910干预后1个月25.66±8.57*19.22±10.89*#3.117 0.042干预后2个月19.81±7.67*14.34±6.91*#3.554 0.045
2.3 IL-6、TNF-α和MCP-1与治疗前比较,两组患者治疗后IL-6、TNF-α 和MCP-1 均降低,差异具有统计学意义(P<0.01);治疗后,试验组3 个指标均较对照组低,差异具有统计学意义(P<0.05)。见表3。
表3 两组患者治疗前后IL-6、TNF-α和MCP-1比较(±s) pg/mL
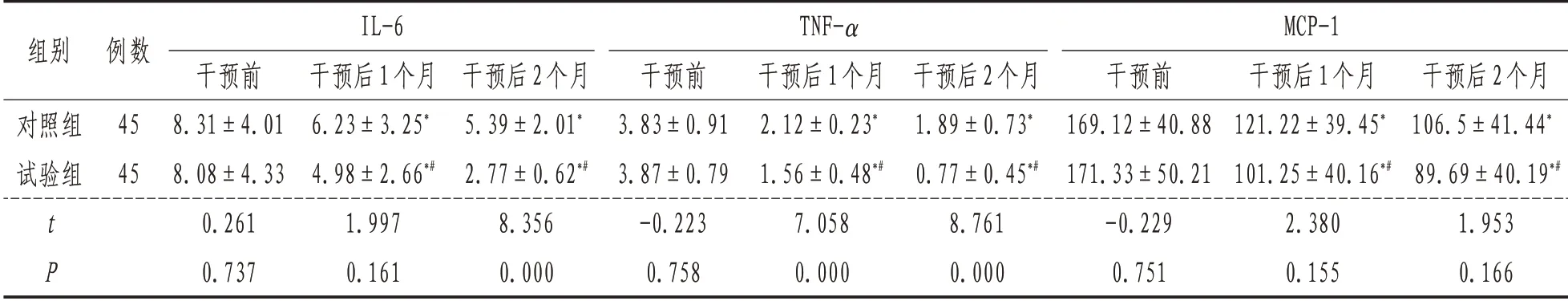
表3 两组患者治疗前后IL-6、TNF-α和MCP-1比较(±s) pg/mL
注:*表示与本组治疗前比较,P<0.01;#表示与对照组治疗后比较,P<0.05
组别对照组试验组tP例数45 45 IL-6干预前8.31±4.01 8.08±4.33 0.261 0.737干预后1个月6.23±3.25*4.98±2.66*#1.997 0.161干预后2个月5.39±2.01*2.77±0.62*#8.356 0.000 TNF-α干预前3.83±0.91 3.87±0.79-0.223 0.758干预后1个月2.12±0.23*1.56±0.48*#7.058 0.000干预后2个月1.89±0.73*0.77±0.45*#8.761 0.000 MCP-1干预前169.12±40.88 171.33±50.21-0.229 0.751干预后1个月121.22±39.45*101.25±40.16*#2.380 0.155干预后2个月106.5±41.44*89.69±40.19*#1.953 0.166
2.4 安全性试验期间试验组脱发1 例、轻度转氨酶偏高1 例;对照组轻度转氨酶偏高2 例,WBC轻度偏低1 例。给予相应对症治疗,无其他特殊不适。两组不良反应均为轻度,不良反应发生率两组比较差异无统计学意义(P>0.05)。
3 讨论
克罗恩病的发病机制目前并不完全清楚,可能与个人生活习惯、遗传因素、社会环境、感染因素等有关,本病的特征性病理表现除了消化系统症状外,还可能出现全身症状,如低热、营养不良、贫血等,少数患者合并皮肤黏膜、关节或眼睛病变[6-7]。克罗恩病出现并发症或伴有其他系统严重并发症一般预后不佳,严重者会威胁患者生命[8]。有研究发现[9],活动期克罗恩病患者炎性细胞因子的水平波动较大,炎性细胞因子在炎症中起关键介导作用[10-11]。IL-6、TNF-α、MCP-1被多次证明与炎症的产生关系密切[12],是导致炎症产生的关键物质,也有实验表明,这3 种细胞因子参与了克罗恩病的发病[13]。实验研究发现[12],血小板活化因子、花生四烯酸类等与肠道炎性疾病的发生有密切关系,但是这些物质都需要一种关键性生物酶sPLA2催化才能产生。因此,sPLA2是肠道炎性疾病产生的关键物质,抑制sPLA2 活性是治疗肠道炎性疾病的关键。有学者用小鼠肠炎模型作为研究对象,发现用柳氮磺胺吡啶联合sPLA2抑制剂可能对小鼠肠炎起治疗作用。美沙拉嗪是一种治疗肠炎的常规用药,主要抑制细胞合成PGE2、LTB4,从而改善肠道炎症[14]。
可见,抑制该类细胞因子活性是一种靶向治疗方法,目前已经批准在临床使用的有TNF-α单克隆抗体、结合TNF-α受体的融合蛋白等,其中IL-6受体已是治疗类风湿性关节炎的重要药品之一[15]。目前临床疗效优于对症治疗[16]。该类药物最开始只用于常规治疗后效果不满意的患者,后来通过临床观察发现,这类药物可作为治疗CD 的常规用药。
关于肠道炎症,中医学有独特理论,脾胃虚弱运化无力会导致水湿内停,日久化热则表现为黏膜溃烂[17-18]。治疗主要以健脾祛湿为主,本研究在四君子汤的基础上,适当配伍燥湿中药,实现益气健脾、渗湿止泻的治疗作用。
综上所述,健脾祛湿方联合美沙拉嗪不仅可以更好地改善疾病症状,也可改善炎症状态,而且未出现严重不良反应。但是本研究纳入受试者例数相对较少,观察时间相对较短,今后需要借助大样本、长时间相关研究及回访来证实健脾祛湿方治疗CD的临床疗效。
