一种快速高效检测转基因玉米方法的建立
2022-02-18周德龙孟令聪郑淑波穆王薪淇刘文国
周德龙 孟令聪 郑淑波 王 楠 李 穆王薪淇 卢 实 王 敏 刘文国 路 明
(1吉林省农业科学院玉米研究所/玉米国家工程实验室(长春)/国家玉米工程技术研究中心(吉林)/农业农村部东北中部玉米生物学与遗传育种重点实验室/吉林省农作物育种南繁基地开放实验室,130033,吉林长春;2吉林吉农高新技术发展股份有限公司,136100,吉林公主岭)
玉米作为全球第一大粮食作物,在保障粮食安全方面起到尤为重要的作用[1]。自20世纪90年代转基因玉米获批商业化许可推广至今,其种植面积逐年增加,2019年全球转基因玉米种植面积达6090万hm2,转基因玉米应用率为31%[2]。近些年来,我国转基因玉米研发取得显著进展,2020年抗虫耐除草剂玉米“DBN9936”、“DBN9501”和“瑞丰 125”,以及耐除草剂玉米“DBN9858”相继获得生产应用安全证书,这是继2009年向国产转基因植酸酶玉米发放生产应用安全证书之后,再次在主粮领域向国产转基因玉米颁发批准生产应用安全证书,这将大大推动转基因玉米产业化进程,使品种研发进入新的发展阶段。育种工作中能够快速准确筛选出含目的基因的新材料,建立高效快速的目的基因鉴定技术尤为重要。
随着分子技术的快速发展,相关的检测方法也在更新换代。目前应用比较广泛的是在常规PCR技术基础上相继发展的多重 PCR、数字 PCR、复合PCR和荧光定量PCR等转基因检测技术方法[3-9]。常规PCR和荧光定量PCR的检测方法均需要预先采用 CTAB法或试剂盒等方法提取待检测样品DNA,耗时长且工作量较大,无法实现高效快速的转基因玉米筛选。
本研究通过常规PCR法、TaqMan探针实时荧光PCR法及叶片直接PCR法检测转基因玉米植株叶片CaMV35S启动子和NOS终止子2个元件,比较3种检测方法的优、劣势,为快速精准筛查转基因玉米提供技术支撑。
1 材料与方法
1.1 试验材料
转基因玉米材料T561、T661、T841和非转基因玉米品种吉单27由吉林省农业科学院玉米研究所提供。
1.2 PCR前处理
将4份供试材料播种于沙盘中,待其长至2叶1心时,用取样器分别取直径为0.6cm叶片,采用CTAB法提取DNA用于常规PCR,结合琼脂糖凝胶电泳及荧光定量 PCR进行转基因检测。取直径为0.2cm的叶片用于直接PCR结合毛细管电泳的方法进行转基因检测。
1.3 试剂及引物信息
Primerdesign®LtdTM(GMO)定量检测试剂盒购于北京科奥明生物技术有限公司;2×Taq PCR MasterMix购于博迈德生物有限公司;快速DNA提取扩增试剂盒购于北京天根生化科技有限公司;2×M5 Hiper超光速mix和M5 Hiper超光速mix直接扩增最佳伴侣购于北京聚合美生物科技有限公司。 引物信息见表1。

表1 转基因检测引物信息Table 1 Primer informations for genetically modified detection
1.4 试验方法
1.4.1 常规PCR扩增 采用CTAB法提取待测样本DNA,用Nano-Drop2000测定待测样品浓度,将待测样品DNA浓度稀释到50~100ng/μL。PCR反应体系按照转基因植物及其产品成分检测基本标准物质制备技术规范执行,用 1%琼脂糖凝胶电泳检测所得PCR产物,用凝胶成像仪记录试验结果。
1.4.2 TaqMan探针实时荧光PCR扩增 采用试剂盒提取样本DNA,对每份待测样品采用TaqMan特异性荧光标记法,反应设置3次重复,每批反应同时设有阴性对照、阳性质控和空白对照,RT-PCR扩增反应体系转基因植物及其产品成分检测按基本标准物质制备技术规范执行。
1.4.3 叶片直接PCR扩增 取玉米直径0.2mm的幼嫩叶片少许装入1.5mL离心管中,加入20μL裂解液M5 Hiper超光速预混液,用移液枪尖简单研磨即可,如果待检样品为老叶片或组织,需要加入50μL裂解液充分研磨1~2min。研磨后95℃热水浴10min,使其充分裂解后,将样品管置于离心机中12000转/min离心 1min,即可得粗提物用于后续PCR反应。粗提物可短期保存在4℃条件下,长期保存需-20℃条件。取粗提物上清液进行 PCR扩增,3次重复,同时设置阴性对照、阳性质控和空白对照,扩增反应总体系 10μL:超纯水 ddH2O 3μL、2×M5 Hiper 超光速预混液 5μL、上游引物(10μmol/L)0.5μL、下游引物(10μmol/L)0.5μL和模板DNA 1.0μL。反应条件为95℃预变性3min;94℃变性25s、58℃退火25s、72℃延伸60s(PCR延伸速度设为60s/kb,由于所用DNA模板为粗提物,所以速度慢),共37个循环(较常规PCR增加 2~3个循环所扩增出的条带会更清晰明亮);72℃终延伸5min。所得PCR产物用毛细管电泳进行分析。
2 结果与分析
2.1 常规PCR检测分析
利用常规PCR法进行转基因元件CaMV35S启动子和NOS终止子检测(图1和图2),除空白对照和阴性对照外,其余材料均扩增出CaMV35S启动子和NOS终止子,且目的条带非常清晰,扩增片段大小分别为195bp(CaMV35S启动子)和182bp(NOS终止子),与目的片段大小一致,表明这些材料均含有转基因成分。
2.2 TaqMan探针实时荧光PCR检测分析
利用TaqMan特异性荧光标记法检测玉米转基因成分时,无需绘制标准曲线,可直接作定性分析。结果(图3和图4)表明,阴性对照无典型扩增曲线,而待测样品T561、T661、T841和阳性质控对转基因元件CaMV35S启动子和NOS终止子均有典型扩增曲线。
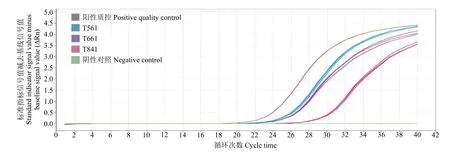
图3 CaMV35S实时荧光反应扩增曲线Fig.3 Real time expansion reaction curves of CaMV35S

图4 NOS实时荧光反应扩增曲线Fig.4 Real time expansion reaction curves of NOS
2.3 叶片直接PCR检测分析
通过叶片直接PCR后,对PCR产物进行毛细管电泳(图5和图6),表明除空白对照和阴性对照外,其余材料均扩增出与CaMV35S启动子和NOS终止子目的条带片段大小一致的特异性条带,且扩增效果清晰可见、无杂带。通过毛细管电泳峰图结果(图7)进一步验证叶片直接PCR法扩增出的目的条带峰图清晰可见,并且无影子峰和非特异性峰。因此,采用叶片直接PCR法结果真实准确,并且操作简单、方便、快捷。
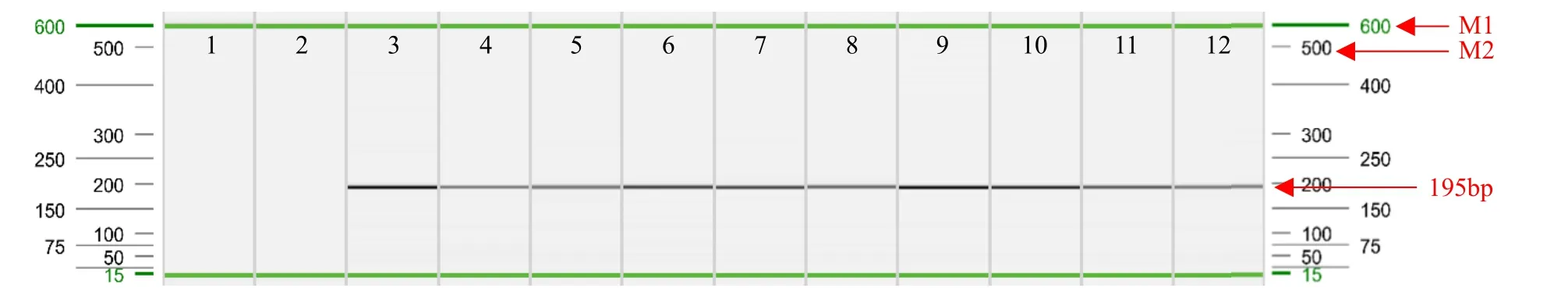
图5 CaMV35S启动子直接PCR检测Fig.5 Direct PCR detection of CaMV35S promoter

图6 NOS终止子直接PCR检测Fig.6 Direct PCR test results of NOS terminator

图7 CaMV35S启动子和NOS终止子毛细管电泳峰值结果Fig.7 Peak results of capillary electrophoresis of CaMV35S promoter and NOS terminator
2.4 3种方法耗时与成本比较
通过3种转基因检测方法的对比(表2)得出,常规PCR法从DNA的提取至电泳结果分析结束耗时307min,3种方法试剂耗材花费80元。TaqMan探针实时荧光PCR法从DNA的提取至荧光PCR结果分析结束耗时223min,使用试剂耗材花费106元。叶片直接 PCR法从叶片的预处理至电泳结果分析结束耗时117min,使用试剂耗材花费60元。叶片直接PCR法在耗时和成本上均优于常规PCR法和TaqMan探针实时荧光PCR法。

表2 3种方法消耗时间及成本Table 2 Time and cost consumed of three methods
3 讨论
随着分子检测技术的快速发展,如何准确快速筛选出含有目标性状的基因通常是育种家最关心的问题,同时也促成了 TaqMan探针实时荧光PCR、数字PCR、多重PCR和单管巢式PCR方法的出现[10-11]。国内外建立的转基因成分检测方法中,PCR是应用最普遍的技术,包括常规PCR和TaqMan探针实时荧光PCR[12-14]。常规PCR法检测工作量大,且存在一定污染,并且在提取DNA时无论采用传统的CTAB法还是采用试剂盒法,均耗费时间较长且成本较高,尤其是在样本量比较大的情况下,DNA的提取直接制约着后续检测工作的效率。利用TaqMan探针实时荧光PCR法筛查玉米中转基因成分时,操作简单、定性快速、结果准确,同时可避免对环境及人造成危害,但是定量检测试剂盒成本较高,前期同样需要提取DNA,对DNA的纯度要求较高。叶片直接 PCR法无需单独提取DNA,所用试剂为单组分试剂,不含强酸强碱成分,保证了后续PCR反应的稳定可靠,不仅操作简单,而且避免了样本交叉污染,只需几分钟即可得到DNA模板粗提物,操作安全、快速、无污染。
4 结论
通过常规PCR法、TaqMan探针实时荧光PCR法及叶片直接PCR法检测CaMV35S启动子和NOS终止子2个转基因元件,在检测样本数量相同的情况下,叶片直接 PCR法分别较常规 PCR方法和TaqMan探针实时荧光PCR法节约62%和48%的时间以及25%和43%的成本,并且所扩增出的目的条带清晰可见,符合目的片段大小,结果真实可靠。因此,叶片直接PCR法可以作为1种快速、高效、准确、环保且低成本的转基因检测方法广泛使用。
