水稻细胞质雄性不育及其育性恢复基因的研究进展
2022-02-18段琉颖谢建坤胡标林
段琉颖 吴 婷 李 霞 谢建坤 胡标林
(1江西师范大学生命科学学院,330022,江西南昌;2江西省农业科学院水稻研究所/水稻国家工程实验室(南昌),330200,江西南昌)
雄性不育(male sterility,MS)在自然界高等植物中广泛存在,是指雌配子发育正常而雄配子发育异常,且与外来花粉正常受精结实的遗传现象,主要包括细胞质雄性不育(cytoplasmic male sterility,CMS)和细胞核雄性不育(genic male sterility,GMS)。CMS又称核质互作雄性不育,是一种由花粉败育进而导致受精结实异常的母性遗传现象,受线粒体不育基因和育性恢复(restorer of fertility,Rf)基因共同调控。CMS和Rf作用模式主要由细胞质线粒体基因导致雄性不育,而 Rf能改变线粒体中不育基因的转录或表达,使育性得以恢复[1]。水稻(Oryza sativa L.)是全球最重要的三大粮食作物之一,世界上超过50%的人群以稻米为主食,因此水稻的高产、稳产与全球粮食安全和社会稳定密切相关。利用杂种优势能有效提高农作物产量、品质和抗性,而水稻CMS是三系杂交稻杂种优势利用的重要途径。水稻三系的CMS和Rf系统成功配套极大推动了水稻杂种优势的利用和杂交水稻在中国大规模推广应用。中国杂交水稻种植面积超过50%,占全国水稻总产量的60%以上[2],为我国乃至世界粮食增产做出了卓越的贡献。
1954年Sampath和Mohauty首次报道了水稻CMS现象后,国内外学者开始设想通过不育系选育实现杂种优势在水稻生产上应用;随后在 1958年,日本 Katsuo等利用中国红芒野生稻与日本粳稻藤板5号杂交,育成世界上首个具有中国红芒野生稻细胞质的藤板5号不育系[3]。
1964年,袁隆平[4]提出了利用三系法实现水稻杂种优势利用的构想,开启了我国杂交水稻研究的征程。随着分子生物学研究的发展,分子克隆与生物信息学技术不断成熟并得到广泛应用,对各种不育类型育性恢复机理的研究也越来越深入。本文主要综述了水稻CMS机制、Rf基因的来源、育性恢复遗传、定位克隆以及育种应用等方面的研究工作。
1 水稻细胞质雄性不育基因的克隆及其不育机理研究
发现并利用水稻雄性不育系是发展杂交水稻的必要前提和重要的物质基础。迄今为止,育成的水稻CMS胞质类型十分丰富,已达60多种,主要包括野败型(CMS-WA)、矮败型(CMS-DA)、D型、冈型(CMS-GA)、印水型(CMS-ID)、红莲型(CMS-HL)、马协型(CMS-MX)、万恢型(CMSNX)、爪哇型(CMS-LX)、Y型、K52型(CMSK)、包台型(CMS-BT)、滇型(CMS-DT)和D1型(CMS-D1)[5-7],其中前10种主要用于籼稻,而后4种用于粳稻,这些不同类型CMS根据其恢保关系大致分为CMS-WA、CMS-HL和CMS-BT三大类型。CMS-D1是孢子体雄性不育,无花粉型败育,为东乡野生稻特有,其恢保关系不同于其他孢子体不育类型[7]。目前已有7个水稻CMS相关基因被克隆,分别是CMS-WA型的WA352、CMS-BT型的 orf79、CMS-HL型的 orfH79、CMS-CW 型的orf307、CMS-RT98型的orf113、CMS-RT102型的orf352和CMS-D1型的orf182[7-13]。
自20世纪70年代以来,CMS-WA型已在三系杂交水稻的生产中得到广泛应用,但其不育的分子机理直到最近才逐渐明晰[8]。直到2002年,第1个水稻线粒体基因组测序完成提高了对水稻细胞质不育分子机制的认识。Luo等[8]发现了水稻CMSWA型的不育基因,并阐明了其产生的分子机制。通过对整个CMS-WA线粒体基因组的转录本进行检测分析,发现了1个新的嵌合开放阅读框,其编码1个含有352个氨基酸的蛋白质,该蛋白质具有3个跨膜区域,命名为WA352;进一步通过线粒体转运信号(MTS)与候选基因核转化融合检测其功能,表明WA352是导致CMS-WA型的不育基因[8]。该研究[8]还表明,COX11是不育蛋白WA352发挥作用的互作因子和细胞色素c氧化酶(Cyt c)的组装因子,能清除活性氧(ROS)。而ROS通过影响线粒体的通透性来促进Cyt c向细胞质释放,进而触发动物或植物程序性细胞死亡(programmed cell death,PCD)。简而言之,WA352能特异地在小孢子母细胞期的绒毡层积累并与COX11相互作用,从而抑制COX11清除活性氧的功能,导致ROS积累,Cyt c释放,进而引起绒毡层PCD异常,最终导致CMS-WA型花粉败育。
Yi等[14]利用CMS-HL粤泰A与粤泰B构建的线粒体基因组BAC文库,在粤泰A线粒体基因组atp6基因下游200bp处发现了1个编码79个氨基酸的开放性阅读框(open reading frame,ORF),命名为 orfH79,其转录产物 ORFH79主要存在于CMS-HL水稻的线粒体中,而在可育系中缺失。进一步将不育基因 orfH79融合为线粒体转运肽序列并转化至野生型水稻,其表达诱导配子体雄性不育表型;其转基因植株的花粉中 ROS积累过多,ATP/ADP值、线粒体膜电位和呼吸速率均降低,并且初生根和侧根生长迟缓,根尖 ROS积累异常,造成配子体雄性不育,这表明orfH79可导致CMSHL水稻细胞配子体雄性不育[10]。
CMS-BT不育系来源于印度籼稻 Chinsurah BoroⅡ,其细胞质的线粒体基因组中含有N-atp6和B-atp6 2个 atp6基因的拷贝,组成型转录共编码ATPase复合物的亚基。B-atp6下游存在1个编码含有79个氨基酸的细胞毒性蛋白orf79基因,其C端对细胞毒性是必要的;同时该基因的功能互补结果也证实了orf79就是CMS-BT不育基因。orf79基因编码的细胞毒肽对大肠杆菌具有毒性作用,在花药小孢子中特异性积累,导致花粉败育[9]。
CMS-D1是一种无花粉型的孢子体细胞质雄性不育类型,来自东乡野生稻。通过线粒体基因组测序和比较分析,结果检测到1个候选基因orf182,orf182由1个水稻线粒体基因组片段、1个与高粱线粒体序列同源的片段以及1个未知起源的片段组成,可编码1个含有182个氨基酸的蛋白[7]。orf182的功能分析表明,其可与线粒体转运肽融合诱导雄性不育,使花药中缺乏花粉粒;其在大肠杆菌体内表达,还能抑制大肠杆菌生长,使其呼吸速率降低,ROS过量积累,ATP水平降低。综上表明,基因orf182与水稻CMSD1的无花粉型孢子体雄性不育有关[7]。
CMS发生的分子机制多样,目前有关植物CMS形成机理主要可归纳为如下4种假说:
1.1 细胞毒性机理假说
细胞毒性是指由细胞或化学物质引起的细胞损伤事件,不依赖于凋亡或坏死的细胞死亡机理。Dewey等[15]首次提出了线粒体异常基因编码细胞毒性的假说,认为CMS基因的产物能造成花药孢子体和配子体细胞线粒体功能受损,导致雄性不育。大多数CMS蛋白具有典型的细胞毒蛋白特征(10~35kDa的跨膜蛋白,含有一个疏水区域)。
1.2 异常细胞程序性死亡假说
PCD是生物体发育过程中普遍存在的,是生物体在生长发育过程中由自身基因决定的主动有序的死亡方式,是生物体新陈代谢过程中正常的生理反应。从小孢子发生到雄配子体发育成熟的不同阶段,小孢子或雄配子体异常的 PCD都会造成植物细胞质雄性不育,其中一部分是由绒毡层细胞PCD异常造成的,还有一部分是由减数分裂过程中特定阶段的PCD异常所引起[16]。
1.3 线粒体能量供给紊乱假说
细胞生命活动所需95%的能量来自线粒体,线粒体在植物的生长发育尤其是生殖生长过程中极为重要。花药细胞发育所需要的能量比其他部位的细胞所需能量更多,因此花药细胞可能会通过增加线粒体数目或代谢活性产生更多的能量[17]。在该假说中,线粒体CMS基因的产物会造成线粒体的能量代谢异常,不能产生足够的能量,影响孢子体和配子体的正常发育,从而导致花粉败育。
1.4 反向调控假说
该假说认为线粒体与细胞核之间发生逆向调控,线粒体的不育基因产生信号来调控细胞核基因的表达,进而控制CMS基因在线粒体中的表达[18]。目前,在水稻CMS中,只有中国野生稻细胞质不育系(CMS-CW)符合这一假说。CMS-CW恢复基因Rf17编码线粒体蛋白(retrograde-regulated sterility,RMS),等位基因Rf17和rf17均不改变CW-orf307转录。而CMS-CW细胞质通过1个或多个未知的反向信号上调rf17的表达,但由于启动子调控区域变异致使CMS细胞质未上调Rf17的表达。RMS上调表达抑制花粉萌发,导致配子体不育[11,19-20]。
总而言之,CMS的形成涉及复杂的信号调控和代谢过程,毒性蛋白、早期异常 PCD和能量不足可能是形成CMS机制的一部分。无论引发水稻CMS现象的分子机制如何,孢子体(主要是绒毡层)或配子体细胞都会因为线粒体氧化还原过程或能量产生异常而死亡,最终导致花粉败育。
2 三系杂交稻恢复系恢复基因的来源
水稻CMS和Rf基因的发掘和利用使我国杂交水稻的研究水平大幅提升。三系杂交稻的商业化应用除了需培育出优良的不育系外,还要选育与之配套的优良恢复系。因此,在三系杂交水稻研究的过程中,恢复基因的研究倍受关注。
有关水稻恢复基因的研究最早可追溯到20世纪60年代,许多学者开始对恢复基因的来源进行探索性研究。1972年,Shinjyo[21-22]发现强恢复品种主要分布在仅种植粳稻和籼稻的热带地区,而来自日本及其他温带国家或地区的水稻品种绝大部分为非恢品种。1970年我国培育出野败型CMSWA的不育细胞质,1973年以袁隆平为首的全国杂交水稻协作攻关小组从东南亚品种中筛选到强恢复系[23]。自此,相继培育了许多恢复系,然而这些骨干恢复系大多来源于低纬度地区的籼稻品种。与之不谋而合的是,多项研究均表明,恢复基因频率在热带比在亚热带或温带地区高。随后对印度的冬稻(aman)、秋稻(aus)和夏稻(boro)3个生态型籼稻品种进行研究,结果表明,冬稻和夏稻品种筛选出恢复系的频率比秋稻品种更高。而印尼的“布鲁稻”(bulu)和“久来稻”(tjereh)2个生态型品种和爪哇岛的“久来稻”品种具有强恢复力。在亚洲范围内,强恢复系主要在南亚、东南亚和我国华南;在美国,仅种植粳稻的加利福尼亚州未发现强恢复系,而在主要种植籼稻的路易斯安那州和得克萨斯州筛选出3个强恢复系[24]。综上,起源于低纬度地区的水稻品种恢复系频率高于起源于高纬度地区的水稻品种,籼稻品种的恢复系频率高于粳稻品种。
自我国三系杂交稻配套成功以来,先后在生产上涌现了IR24、IR26、IR661、IR30、明恢63、扬稻6号以及华占等一批骨干籼型恢复系,资源比较丰富[25-26],然而这些骨干恢复系遗传背景单一[27],其系谱大部分可追溯到明恢63和IR系列品种等少数几个优异恢复系[28],基本上含有东南亚地区农家品种Peta的遗传成分,属于南亚和东南亚中籼生态型[29],这大大限制了高产优质杂交组合的培育。可见,三系杂交稻育种中亟需丰富恢复系的遗传多样性,而拓宽恢复系的来源以加强杂种优势的利用已成共识[30]。
我国杂交水稻生产中应用的雄性不育细胞质来源于地方品种和野生稻[31],而细胞质雄性不育总是与恢复基因相伴随并协同进化的[32],由此野生稻中必然存在相应的恢复基因[33]。因此,发掘和利用新的恢复基因,特别是野生稻来源的恢复基因将是丰富我国恢复系的恢复源、扩大杂交稻双亲遗传距离以及选配优良杂交组合的有效手段,可有效避免我国恢复系的恢复基因单一化所带来的潜在危险。
3 水稻恢复基因经典遗传学研究
20世纪70年代后期以来,大量的水稻育性恢复遗传研究表明,胞质雄性不育性均可被相应的恢复基因所恢复。一般认为,CMS-WA及其恢保关系相类似的胞质不育类型的育性恢复主要受2对基因或单个主效基因控制[34-36]。CMS-BT和CMS-HL的育性恢复主要由1对基因控制[37-38]。此外,微效基因对细胞质雄性不育的育性恢复也具有一定的影响。恢复等位基因在一些基因位点上表现出特定的多态性,且完全恢复不同类型CMS的不育性所需的恢复基因数目不等[34-38]。由此可见,恢复基因对不育性的恢复作用具有专效性。这些经典遗传学研究均采用一般经验标准将群体划分为不同的育性组别,然后根据经典遗传理论和统计分析方法推断控制性状的基因对数、不同基因的相对效应及基因间互作存在与否。实际上,大多数群体的育性分离呈双峰型连续分布,少数群体的育性分离呈典型的正态分布或多峰分布,育性群体无法明确划分“育”和“不育”的界限。因此,胞质雄性不育的育性恢复受主效基因控制的同时,还可能受微效基因的修饰作用。可见水稻胞质不育性恢复遗传机理十分复杂。
4 水稻恢复基因的定位与克隆
分子生物学技术的快速发展,极大地推动了水稻细胞质雄性不育及其育性恢复的分子机理研究。自20世纪70年代起,国内外研究者对野败型(CMSWA)、红莲型(CMS-HL)、包台型(CMS-BT)和矮败型(CMS-DA)等不同类型CMS开展了育性恢复QTL分析,在水稻12条染色体上检测到超过75个不同胞质类型育性恢复 QTL,其表型贡献率介于2.9%~61.9%。然而,由于不同学者采用的研究材料及育性指标不同,其QTL定位结果也不尽相同。
4.1 野败型胞质不育恢复基因定位
有关野败型细胞质雄性不育育性恢复基因定位的报道较多,目前已定位到40个野败型育性恢复QTL,广泛分布在水稻的除9号染色体以外的11条染色体上[39-55](表1)。
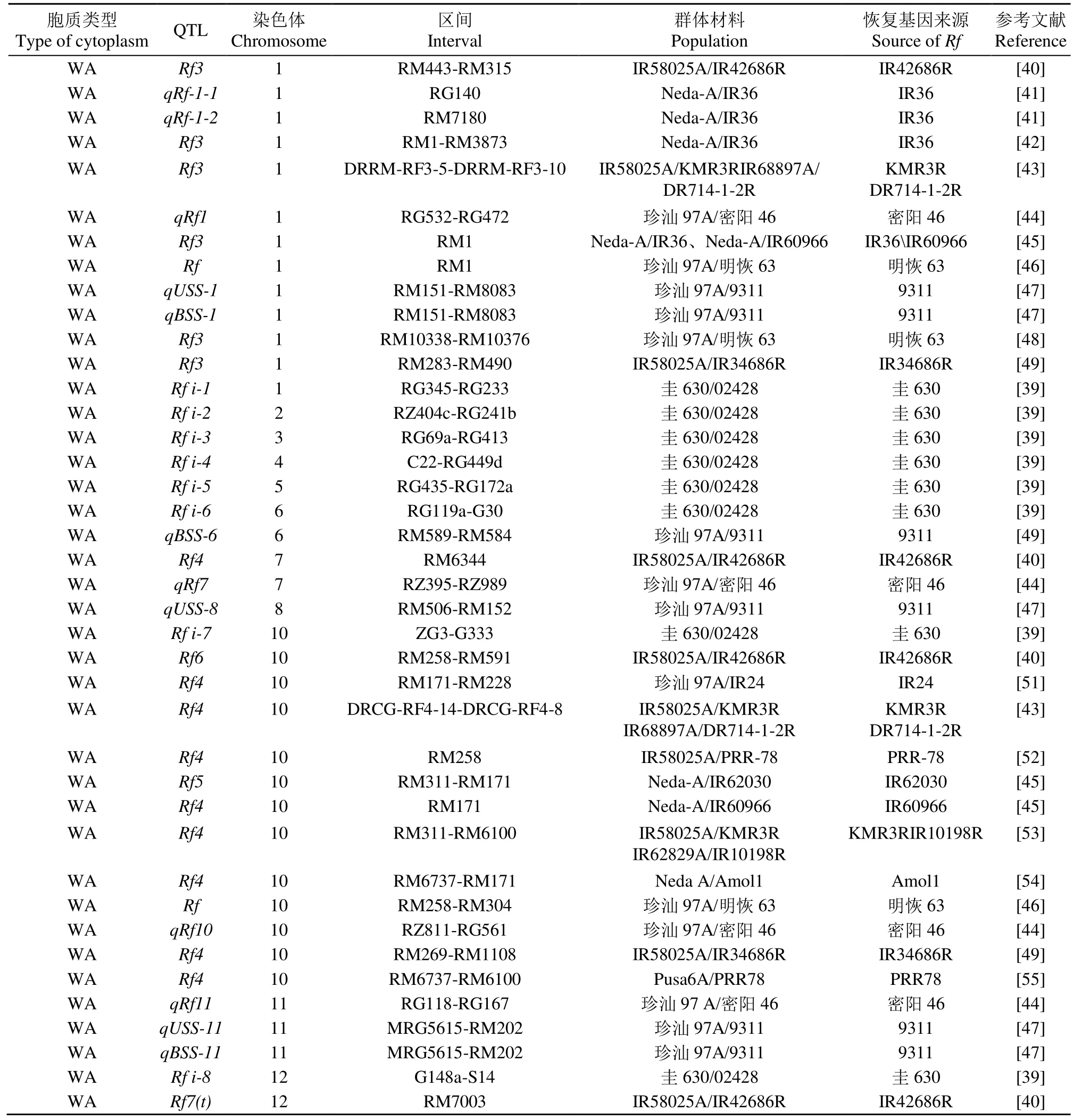
表1 水稻CMS-WA育性恢复QTLTable 1 QTL for fertility restoration of CMS-WA in rice
在 1号染色体上共检测到 13个育性恢复QTL[39-50],其中10个QTL成簇分布于染色体的短臂端,有 4个贡献率大于 32%。在10号染色体上检测到了13个育性恢复QTL[39-40,43-46,49-55],成簇分布于长臂端,其中庄杰云等[44]定位到的 QTLqRf1表型贡献率最大,为43.0%;Ngangkham等[55]将育性恢复 QTLRf4精细定位至区间 RM6737~RM6100,其物理位置约104kb。2、3、4、5和8号染色体上各定位到1个育性恢复QTL,其中位于3和4号染色体上的Rfi-3和Rfi-4的贡献率均大于35%,为主效QTL。而在6、7、11和12号染色体上共检测到9个育性恢复QTL,其遗传效应均为微效[39,44,47]。上述研究报道认为,野败型恢复基因主要受2对主效基因控制,但各自的效应大小不同,表现出累加效应,且受微效基因的影响。
4.2 红莲型胞质不育恢复基因定位
CMS-HL不育胞质来源于海南红芒野生稻,属于典型的配子体不育类型,迄今共定位到8个育性恢复QTL,分布于1、8和10号染色体上[56-62](表2)。Shen等[62]在水稻1号染色体长臂端检测到1个红莲型育性恢复QTL,介于区间RG374~RG394。在8号染色体上定位到2个育性恢复QTL[59-60],Huang等[60]将其精细定位至区间RM407~SNP32,物理位置约16.8kb。在10号染色体定位到5个育性恢复QTL[56-58,61],成簇分布在该染色体长臂端相似区域,其中Hu等[57]将育性恢复QTLRf5精细定位至区间RM6469~RM25659,物理位置约67kb;刘航等[54]检测到 1个红莲型恢复基因的主效 QTLqRF-10-1,同时还受其他几个微效QTL的影响。上述研究表明,CMS-HL育性恢复QTL主要位于8和10号染色体上。
4.3 包台型胞质不育恢复基因定位
目前中国生产上应用面积最大的粳稻不育系为包台型(CMS-BT)细胞质,大多经典遗传研究表明,CMS-BT的育性恢复性受 1对显性基因控制。迄今4个育性恢复QTL被定位到水稻10号染色体上[63-66](表 3),其中 Akagi等[63-64]首先在 10号染色体定位到1个QTL,之后在此基础上将其精细定位至区间68923-6~68923-9之间,物理位置约为22.4kb。
4.4 其他类型胞质不育恢复基因定位
目前共定位到8个CMS-DA型胞质不育育性恢复QTL,分别位于1、5、9和10号染色体上[67-69](表4)。在1号染色体上定位到3个主效育性恢复QTL,其中,Hu等[69]检测到的育性恢复QTL贡献率最大,为30.2%。在5和9号染色体上分别检测到1个微效和主效育性恢复QTL,其贡献率分别为8.6%和16.0%[68-69]。在10号染色体上定位到3个育性恢复 QTL[67-68],其中 2个育性恢复 QTLqRf10-2和qRf10为主效 QTL,其贡献率均大于35%。该研究[67-68]认为植株的育性恢复除受到主效基因的控制外,还受微效基因和环境的影响,恢复基因之间、恢复基因与遗传背景之间、恢复基因与环境之间亦存在着复杂的相互作用。CMS-DA育性恢复QTL主要位于1和10号染色体上,贡献率介于2.9%~43.2%。
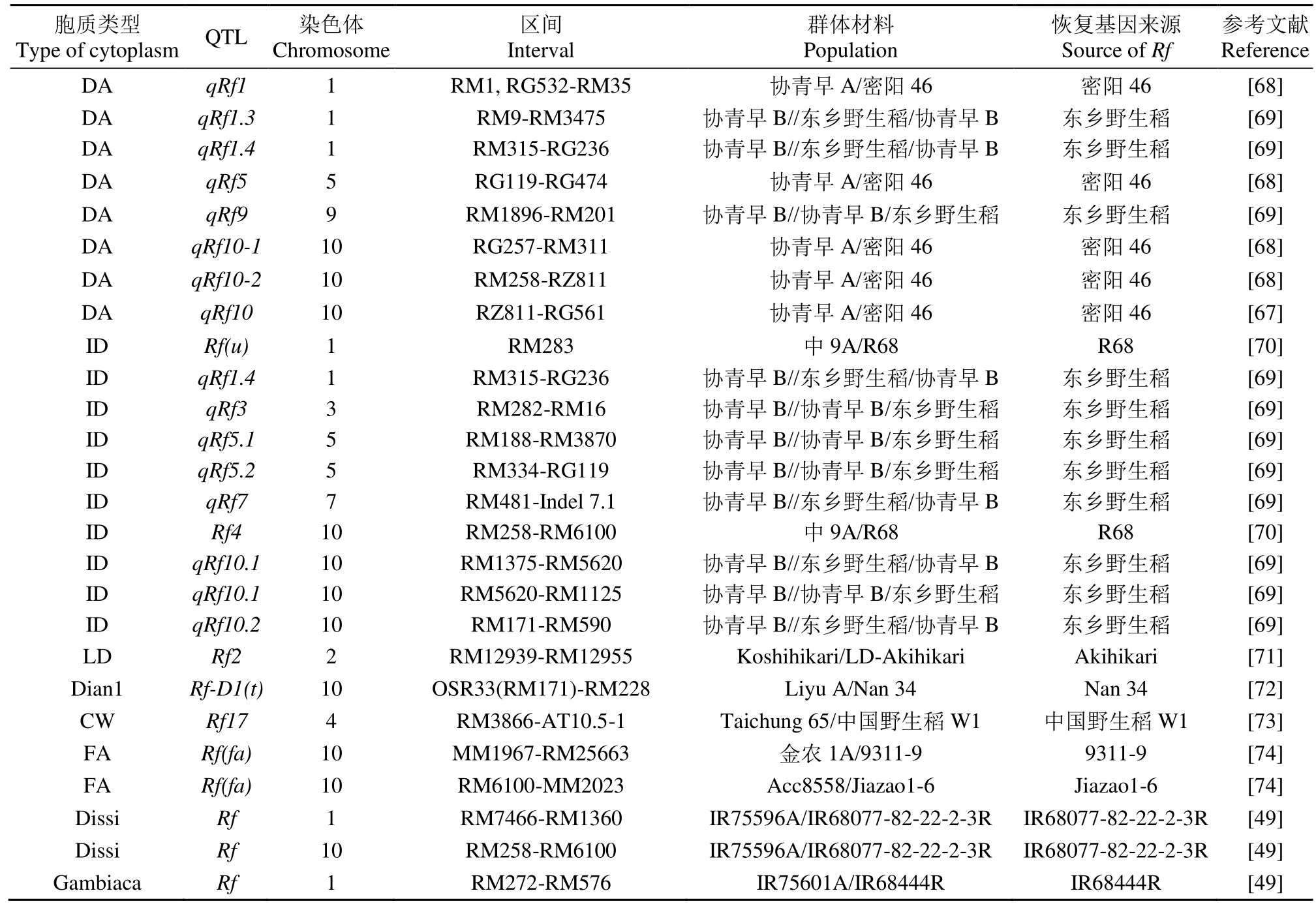
表4 水稻其他类型胞质不育育性恢复QTLTable 4 QTL for fertility restoration of other CMS
共检测到10个CMS-ID型胞质不育育性恢复QTL,分别分布于水稻1、3、5、7和10号染色体上[69-70](表4)。在1号染色体上定位到2个育性恢复QTL[69-70]。在3号染色体上检测到1个主效育性恢复QTLqRf3,贡献率为14.9%。在5号染色体上检测到2个育性恢复QTL,其中qRf5.1的表型贡献率为17.4%,为主效QTL。在7号染色体上检测到1个育性恢复QTL,其遗传效应较小,表型贡献率为9.3%[69]。在10号染色体上检测到4个育性恢复 QTL[69-70],其中育性恢复 QTLqRf10.1和qRf10.2[69]与Rf4[70]位于相同染色体区域。
在DT型不育胞质育性恢复基因定位方面,Tan等[71]在水稻10号染色体上定位到1个控制滇型细胞质不育育性恢复基因的主效基因;Fujii等[19,73]在水稻4号染色体上定位到1个新的CMS-CW型恢复基因Rf17,其增效等位基因来自普通野生稻。此外,Li等[74]将 CMS-FA型福建野生稻细胞质育性恢复基因Rf(fa)定位在10号染色体区间RM6100~MM2023,其物理位置约 121.1kb,而 CMS-FA是一种新型的籼型水稻孢子体雄性不育类型。
尽管迄今为止检测到了大量的不同胞质不育类型的育性恢复基因,但绝大部分恢复基因来自栽培稻和地方品种,有关野生稻恢复基因的发掘和定位研究较为薄弱[19,69,73-74]。
4.5 水稻恢复基因的克隆及其育性恢复机制
目前,已经克隆了7个水稻育性相关的恢复基因,包括野败型恢复基因Rf4、红莲型育性恢复基因Rf5和Rf6、包台型恢复基因Rf1(Rf1a和Rf1b)、Ifr1、Lead-Rice型恢复基因Rf2以及CW型恢复基因Rf17(表5)[8-9,20,57,66,71,75-79]。

表5 已克隆的水稻细胞质不育育性恢复基因Table 5 The cloned fertility restorer genes for cytoplasmic male sterility in rice
CMS-WA育性恢复主要受 2对主效显性基因Rf3和Rf4的控制,分别位于1和10号染色体上[48],且Rf4恢复基因遗传效应强于Rf3,且Rf3具有协同效应[49]。Rf4编码PPR蛋白,通过降低不育基因WA352的转录本水平恢复育性,Rf3对WA352转录水平无影响;相反,在Rf3恢复的植株中,在小孢子母细胞阶段没有检测到WA352蛋白,这表明Rf3可能在翻译后水平发挥作用[8,76-77]。
CMS-HL育性恢复受2个恢复基因Rf5和Rf6的控制[58],且Rf5和Rf6能正常恢复CMS-BT胞质不育[80]。其中,Rf5与CMS-BT的恢复基因Rf1a相似,编码1个PPR蛋白,但Rf5蛋白对atp6-orfH79转录本的加工机制不同。在CMS-BT/Rf1系统中,Rf1a直接结合B-atp6/orf79mRNA,而在CMS-HL/RF5/RF6系统中,恢复基因Rf5和Rf6不能直接结合不育基因的mRNA。其育性恢复蛋白RF5和RF6需要分别通过招募其他的育性恢复复合体去结合并剪切不育基因mRNA,从而使育性恢复。这些复合体中与恢复基因互作的重要亚基成分包括GRP162、RFC3和OsHXK6。目前相关的互作因子都已被鉴定,并且2个恢复基因都有各自独立的途径来实现不育转录本的加工[57-61,81]。
CMS-BT细胞质中含有线粒体基因atp6,该基因能与一个异常的线粒体开放阅读框orf79共转录编码一个细胞毒素蛋白而导致雄性不育。其育性恢复受Rf1控制,包含2个紧密连锁的恢复基因Rf1a和Rf1b,均编码1个PPR蛋白的多基因簇成员,其中蛋白 Rf1A可直接与不育基因转录本 B-atp6/orf79的mRNA互作,进而剪接B-atp6/orf79mRNA恢复育性,而蛋白Rf1B则通过降解B-atp6/orf79的mRNA恢复育性[9]。
CMS-LD育性恢复受Rf2控制,其编码的蛋白由152个氨基酸组成,具有1个富含甘氨酸的结构域。该结构域可能直接或间接地与引起CMS的蛋白质互作,使育性恢复。CMS-CW育性恢复受Rf17控制,包含2个功能基因PPR2和ORF11(RMS)。ORF11具有反向调控雄性不育的功能。ORF11表达增加抑制花粉萌发,从而导致配子体不育;而抑制ORF11的表达可恢复植株育性[20,71,78-79]。
全基因组关联研究是分析水稻复杂性状的有效方法之一。对CMS-WA和CMS-HL胞质类型育性恢复相关性状进行全基因组关联分析,分别检测到13和6个显著性位点,其中3个CMS-WA型和2个CMS-HL型育性恢复位点分别与Rf4和Rf6一致;进一步对恢复基因Rf4、Rf5和Rf6进行单倍型分析,表明Rf4、Rf5和Rf6分别有4、2和8个主要单倍型[77]。关联分析与连锁分析相结合可以更有效地挖掘水稻育性恢复相关基因。在克隆的7个水稻育性恢复基因中,水稻 CMS-WA、CMS-BT和CMS-HL的恢复机制研究已较为深入,大部分RF编码PPR蛋白,对CMS的调控主要表现在转录或转录后水平。无论以何种机制实现育性恢复,水稻CMS育性恢复的分子机制都有待进一步研究。
5 水稻育性恢复基因的育种利用
水稻细胞质雄性不育及其育性恢复相关基因的发掘与利用极大地促进了我国杂交水稻的大面积推广与应用,对世界水稻增产、粮食安全和社会稳定发挥了重要作用。自20世纪70年代的泰引1号、IR24、IR26和IR661等第1代籼型三系恢复系被测交筛选之后,采用测恢、杂交育种和辐射诱变育种等不同方法,迄今已育成的水稻恢复系不胜枚举,相继出现IR30及其衍生系等第2代三系恢复系,明恢63、桂33、测64-7等第3代三系恢复系,扬稻6号等第4代恢复系两系、三系兼用的共恢恢复系和华占及其衍生系等第5代共恢恢复系[82-83]等不同阶段。其中第3~4代恢复系的测64-7、桂33、明恢63和扬稻6号等代表性恢复系通过“恢复基因转移”选育而成,其主要恢复基因可追溯至IR8、IR30和Peta等东南亚品种,它们是野败型杂交稻前期的主要恢复系以及后续恢复系选育的重要核心种质;而第 5代恢复系华占则由马来西亚品种SC02-S6经复测和系统选育而成,说明骨干恢复系在恢复系更替和杂交稻选育中具有重要作用。
在杂交水稻恢复系发展与演变进程中,明恢63对中国杂交水稻的更新换代具有里程碑意义,其具有恢复力强、恢复谱广、综合农艺性状优良、抗病和配合力好等特点,同时早、晚杂交稻可以兼用,含有恢复基因Rf3和Rf4/Rf1B[46,82],是目前我国应用最广的恢复系,其衍生培育超过617个恢复系。由明恢63与珍汕97A配制的水稻品种汕优63具有米质好、稻瘟病抗性强、产量高及抗逆性强等优良的农艺性状,种植地域为 100°36′ E~121°56′ E、17°30′ N~37°49′ N,是种植面积最大的品种,1984-2009年累计推广面积达6.288亿hm2[82]。
扬稻6号是具有高产、优质、多抗和适应性广等特点的中籼恢复系,其对野败型及其类似不育系无恢复力而对红莲型和两系不育系的恢复能力较强,含有恢复基因Rf5和Rf6[59,61]。扬稻6号配制的两优培九是继汕优63之后全国应用面积最大的两系杂交稻,集优质、超高产和多抗性状于一体,整合了理想株型与部分亚种间强大的杂种优势[84],在我国杂交稻发展进程中具有重要意义。
华占是近年来在杂交稻育种应用中最广泛的恢复系之一,以引自马来西亚的SC02-S6为亲本材料,通过与不同类型不育系测配选恢和系统选择育成,2008-2017年以华占配组大面积推广的优质组合13个,累计推广373.3万hm2[83]。根据国家水稻数据中心的公开信息(http://www.ricedata.cn/variety/,截止到2020年12月)显示,以华占为父本的杂交组合已有147个通过审定,其中三系组合98个、两系组合 49个,多数育成组合具有丰产优质和抗稻瘟病等特性。可见,华占是重要的三系和两系不育系共恢恢复系。由上述分析可见,恢复系是杂交水稻的重要组成部分,杂交水稻组合的更新演替与恢复系的改良与发展密不可分;而恢复基因利用和恢复系的选育是提高杂交水稻抗性与杂种优势的主要推动力。然而,目前我国大面积应用的三系杂交稻组合所使用的不育系主要还是野败型、红莲型和包台型,而生产中推广的籼型不育系的恢复系基本上含有东南亚地区品种或品系的遗传成分,其亲源均可追溯到IR系统、明恢63和测64-7等少数几个优良亲本,导致恢保关系单一,难以实现更进一步的杂种优势,只有发掘新的恢复源才能更进一步提高杂种优势。
6 展望
我国杂交籼稻育种处于世界领先地位,主要得益于在不同类型不育细胞质源及其相应的育性恢复源的发掘利用和优质不育系、恢复系的选育等方面的迅速发展。而水稻育性恢复是由多基因控制的质量-数量性状,其遗传机制十分复杂,不同育性恢复基因之间、恢复基因与遗传背景之间、恢复基因与环境之间存在着复杂的相互作用。得益于分子生物学技术和理论的迅速发展,水稻CMS及其Rf基因相继被克隆和鉴定,丰富了不同胞质类型的不育形成机理和育性恢复机制的认识。此外,育种者可以通过分子标记辅助选择利用已精细定位或克隆的恢复基因,使得恢复系选育过程中恢复位点的选择更加便利[85]。然而,鉴于CMS/Rf系统在作物遗传育种中的重要性,需要研究更多的不同类型水稻CMS/Rf系统并应用于水稻生产实践,以避免遗传脆弱性和同质化现象。因此,就CMS及其Rf的生物学研究和应用应加强如下几点:
6.1 加强三系杂交稻优势的理论基础研究
目前,有关水稻CMS-BT、CMS-WA和CMSHL的不育基因及其恢复作用机理的研究较为全面深入,而对水稻CMS-LD、CMS-CW、CMS-FA和CMS-D1不育基因及其恢复作用机理等研究相对浅显[7,20,71,74],这也限制了它们被广泛应用[86-87]。因此,加强不育基因及其恢复基因的发掘及其机理研究可以指导杂交水稻的不育系和恢复系选育实践,最终应用于水稻生产。
6.2 加快破解三系杂交稻局限性
我国三系杂交水稻的骨干不育系和恢复系分属于南亚、东南亚中籼生态型和中国华南早籼生态型等两大杂种优势群,然而群内的遗传多样性较低,亲本间同质化现象严重。大部分三系杂交水稻不育系属CMS-WA[85],存在遗传差异小和遗传背景单一等风险,容易引发水稻生产安全危机。应大力发掘水稻种质资源特别是野生稻等栽培稻近缘种中新的CMS基因和恢复基因,不断丰富三系杂交稻不育细胞质源和恢复源。最近报道的东乡野生稻细胞质[7]是与现有恢保关系不同的新的细胞质资源,应加强开展东乡野生稻胞质类型的三系杂交稻的育种应用和杂种优势群研究。
6.3 加强水稻远缘杂交研究,提高水稻的杂种优势
远缘杂交产生的水稻杂种优势潜力巨大,以“粳不籼恢”杂交模式育成的籼粳亚种间三系杂交稻取得重要进展。继续加强籼粳杂交的理论和应用研究,以期获得更大突破。广泛开展籼稻、粳稻和热带粳稻等不同类型水稻间的远缘杂交研究,探索新的水稻杂种优势群。
6.4 利用生物信息学技术,助力三系杂交稻育种
借助高通量测序和CRISPR/Cas9技术,综合全基因组、转录组、蛋白组、代谢组和表观基因组等不同组学研究,从不同水平对水稻CMS及其Rf基因的分子机制进行系统深入的研究,为全面了解CMS/Rf的分子机制提供丰富的信息,加速对水稻细胞质雄性不育及其育性恢复调控机理的研究进程。此外,通过KASP高通量基因分型等技术[85]鉴定挖掘水稻育性恢复的候选等位基因,利用分子标记和 CRISPR/Cas9编辑技术[88]等分子技术对不育系和恢复系的综合性状进行分子改良,助推高效CMS/Rf系统的育种利用。
