超声处理辅助大豆分离蛋白改善蛋黄乳化性
2022-02-17毕雅雯涂勇刚董世建徐明生
毕雅雯, 刘 晶, 蒋 艳, 涂勇刚, 董世建, 徐明生*
(1.江西农业大学 江西省农产品加工与质量控制工程实验室,江西 南昌 330045;2.安徽荣达食品有限公司,安徽 宣城 242228)
蛋黄具有很高的营养价值和功能特性,其质量约占鸡蛋总质量的28%~29%。蛋黄含有蛋黄卵磷脂、低密度脂蛋白(LDL)、高密度脂蛋白(HDL)、卵黄高磷蛋白、卵黄蛋白等表面活性成分,并且具有很强的天然乳化性,对油脂和水有很强的亲和力,是制造焙烤食品、乳饮料及冰激凌时起乳化作用的重要配料[1]。但是蛋黄的乳化性会受其加工方法的影响,如降低蛋黄浓度可导致乳液的乳化性下降,乳液易分层或析油,对产品的外观及保质期易造成不良影响,限制了蛋黄乳液在实际生产中的应用[2]。因此,改善蛋黄乳化性具有重要的意义。
研究表明,蛋黄蛋白对乳化性的贡献高于磷脂,针对蛋白质改性来提升蛋黄乳液的乳化性是研究热点。如秦凤娇等[3]发现磷酸盐作用于蛋黄后,蛋黄的电负性增强,油滴间的静电排斥作用提高,乳液的稳定性得到改善;Xu等[4]使用辛烯基琥珀酸酐(OSA)淀粉破坏了蛋黄蛋白聚集体,提高了油水界面的吸附率以达到稳定蛋黄乳液的作用;Yan等[5]采用高静水压力诱导蛋黄蛋白展开,使其更易吸附于油水界面,改善了蛋黄的乳化性。近年来,由于蛋白质具有两亲性,能够扩散和吸附到油水界面上,形成稳定的界面蛋白膜,而被广泛用作乳化剂,增强乳液的乳化性[6]。而SPI是一种由大豆球蛋白和β-伴大豆球蛋白组成的刚性球状蛋白,具有良好的乳化性,主要作为加工助剂用于乳液中[7]。如大豆分离蛋白作用于乳清分离蛋白,发现复合物的乳化性相比单一的乳清分离蛋白得到更好改善,且乳液的粒径更小,静电排斥力更强[8]。除乳化剂影响乳液的乳化性外,超声功率也是影响乳液乳化性的重要因素。超声波改变蛋白质乳化性主要通过声空化效应形成局部极端物理力,引起食品系统中的一些物化性质和微观结构变化[9]。如Xie等[10]通过超声处理蛋黄使蛋黄低密度脂蛋白部分聚集,蛋白质分子结构拉伸和局部构象变化,提高了蛋黄乳液的乳化性;王喜波等[11]利用超声波改变大豆分离蛋白-乳清蛋白乳液的乳化性和结构,发现超声处理辅助大豆分离蛋白,可以进一步改善乳清蛋白的乳化性,使乳液具有更大的表面电荷和更小的粒径,形成更稳定的乳液。但是有关SPI改善蛋黄乳液乳化性以及SPI辅以超声处理改善蛋黄乳液乳化性的影响尚不清楚。
作者以新鲜蛋黄为原料,研究SPI对蛋黄乳化性的影响,并在此基础上进一步研究不同超声功率对EY-SPI乳化性的影响,为改善蛋黄乳液类产品的生产及应用提供一定理论依据和数据支撑。
1 材料与方法
1.1 材料与试剂
鸡蛋:市售;SPI(食品级,纯度>98%):临汐山松生物制品有限公司产品;尼罗红:美国Sigma试剂公司产品;其他试剂均为分析纯。
1.2 仪器设备
超微声波细胞粉碎仪:宁波新艺有限公司产品;Zetasizer Nano ZS90粒子分析仪:美国Malvern公司产品;T25分散机:德国IKA公司产品;OLYMPUS倒置荧光显微镜:奥林巴斯(深圳)工业有限公司产品;高速冷冻离心机:上海安亭仪器公司产品;V-5600型可见分光光度计:上海元析仪器有限公司产品。
1.3 方法
1.3.1 乳液的制备将1 g的SPI、EY、EY-SPI粉末分别溶于99 g的去离子水中,25℃下磁力搅拌2 h,使其充分溶解,放置过夜,将EY、SPI、EY-SPI溶液和大豆油按体积比7∶3混合,10 000 r/min下高速剪切2 min,得到EY、SPI和EY-SPI乳液。
1.3.2 超声处理分别采用0、150、300、450 W的超声功率,将制备好的EY、SPI、EY-SPI乳液处理8 min。在超声波处理整个过程中,将温度控制在25~35℃。
1.3.3 乳化活性与乳化稳定性的测定参考Xie等[12]的方法,略做修改。从底部吸取50 μL乳液,与5 mL的0.1 g/dL SDS溶液混合,用可见分光光度计在波长500 nm处测定吸光度。乳化活性(EAI)和乳化稳定性(ESI)的计算公式如下:
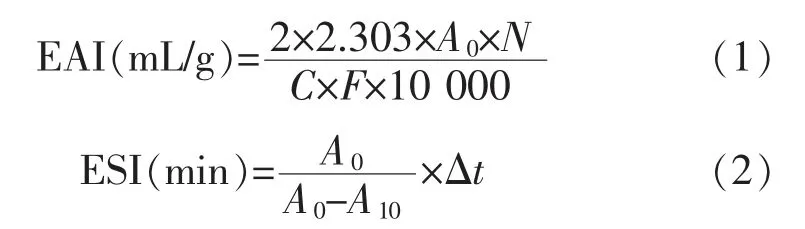
式中:A0为匀浆后的吸光度;N为稀释因子,100;C为样品的质量浓度,mg/mL;F为原油乳状液的体积分数(0.25);A10为10 min后乳液的吸光度。每个样品测量并重复3次。
1.3.4 乳析指数的测定将未超声和超声处理的乳液放置在密封管中,25℃保存14 d,每天测量乳液的乳化量。乳析指数的计算公式如下:
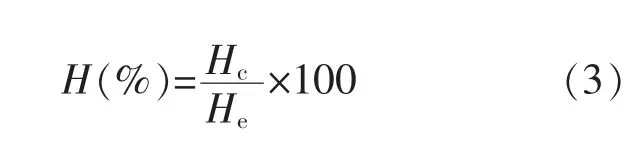
式中:H为乳析指数,%;Hc为底部透明液层高度,cm;He为总乳液高度,cm。
1.3.5 粒径的测定参考文献[13]的方法,略做修改。分散介质的折射率为1.330,吸收指数为0.001,分散液滴的折射率为1.456。测定前,用PBS溶液将乳液稀释250倍,以避免多次散射。对每个记录进行10多次扫描,每个样本进行3次测量。
1.3.6 Zeta电位的测定参考文献[14]的方法,略做修改。乳液的Zeta电位是根据激光多普勒电泳迁移率理论,在25℃下使用粒子分析仪测定,每个样本测量3次。乳液在测定前,用PBS溶液稀释2 000倍。对每条记录进行15次以上扫描,每个样本进行3次测量。
1.3.7 溶解度的测定参考文献[15]的方法,略做修改。准确称取30 g样品溶液,使用高速冷冻离心机在4℃条件下以10 000 r/min离心30 min。离心后,取上清液用BCA蛋白质定量法在562 nm处测定蛋白质质量浓度。溶液中总蛋白质含量通过凯氏定氮法测定。可溶性蛋白质的溶解度通过以下公式计算:
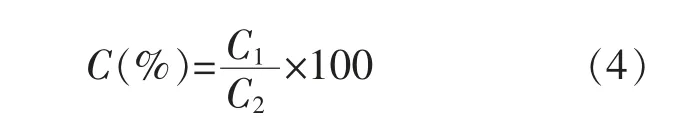
式中:C为可溶性蛋白质的溶解度,%;C1为上清液中蛋白质含量;C2为蛋黄中总蛋白质含量。
1.3.8 界面蛋白吸附量的测定参考文献[16]的方法,略做修改。取新鲜乳液30 mL于50 mL离心管中,10 000 r/min转速下离心30 min,乳液被分为上层乳析相和下层水相。将离心管在-40℃下冷冻8 h,固定上下相,然后使用刀片将上层乳析相去掉,剩余的下层水相使用0.22 μm滤膜过滤,采用凯氏定氮法测定蛋白质质量分数。界面蛋白吸附量按照下式进行计算:

式中:K为界面蛋白吸附量,g/g;M为乳液中总蛋白质质量,g;M1为下层水相蛋白质质量,g;M2为乳液中油的质量,g。
1.3.9 SDS-PAGE电泳分析参考文献[17]的方法,略做修改。取新鲜乳液30 mL于50 mL离心管中,10 000 r/min转速下离心30 min,乳液被分为上层乳析相和下层水相。将离心管在-40℃下冷冻8 h以固定上下相,将上下相分离。取约1 g上层乳析相(界面蛋白),质量浓度调整为2 mg/mL,进行煮沸。采用体积分数5%浓缩胶(80 V)和体积分数12%分离胶(120 V)进行电泳分析。
1.3.10 微观结构的测定参考文献[18]的方法,略做修改。采用荧光显微镜观察新鲜乳液的形态,将40 μL尼罗红染料加入至2 mL乳液中,进行染色,拍摄图片。
1.3.11 数据统计与分析所有的样品进行3次测定,计算平均值。使用Origin 8.0和Excel 2013分析所有数据。使用SPSS 19.0进行方差分析,显著性分析采用Duncan多重比较法。
2 结果与分析
2.1 乳化活性与乳化稳定性
如图1所示,在EY中添加SPI,可以显著提高EY的乳化活性和乳化稳定性(P<0.05),表明在蛋黄中添加SPI可显著改善蛋黄的乳化活性和乳化稳定性。超声处理后EY、SPI、EY-SPI的乳化活性和乳化稳定性显著提高(P<0.05);当超声功率为150 W时,EY-SPI乳液的乳化稳定性最好(P<0.05),表明适当的超声功率可以辅助SPI显著改善蛋黄的乳化稳定性(P<0.05);随着超声功率的增强,乳液的乳化稳定性降低。超声功率超过150 W后超声功率对EY-SPI的乳化活性影响不显著。Zhang等[19]研究发现乳清蛋白作用于SPI,WPI-SPI复合物的界面蛋白吸附量增加和油滴间的静电排斥力增强,乳液的乳化稳定性提高,所以EY-SPI乳液的乳化稳定性增强也有可能是由于油水界面的吸附量和表面电荷分布发生变化所引起的。超声处理后,通过声空化效应产生的物理力,乳液的粒径减小,进一步改善其乳化活性和乳化稳定性;而150 W的超声功率可以改变EY-SPI在油水界面的分布,从而显著提高EY-SPI的乳化稳定性[20];但在超声处理过程中,颗粒的破碎和重聚同时发生,超声功率过高时,蛋白质之间重聚现象出现,所以乳液的乳化稳定性在一定程度上下降[21]。
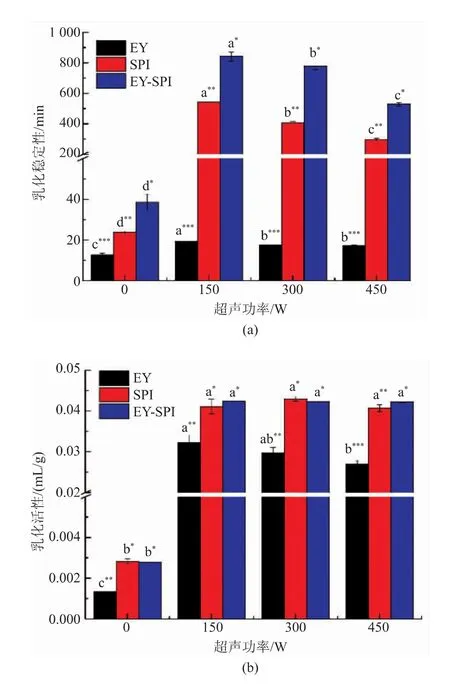
图1 不同超声功率的EY、SPI、EY-SPI乳化特性Fig.1 Emulsification characteristics of EY,SPI and EYSPI under different ultrasonic power
2.2 乳液的乳析指数
为了进一步考察乳液的乳化稳定性,测定了第1天和第14天乳液的乳析指数和外观图。乳液贮存1 d的外观图和乳析指数见图2(a)、(b),EY-SPI乳液的乳析指数显著低于EY和SPI乳液(P<0.05),表明EY-SPI乳液中,液滴之间的斥力作用强度高于EY、SPI乳液,液滴才有规则地分布并紧密堆积使乳脂层加厚,乳析指数降低[22]。超声处理后乳液的乳析指数显著降低(P<0.05),该变化趋势与乳液的乳化稳定性变化相反,表明超声处理可以显著改善乳液的乳化稳定性(P<0.05),但是随着超声功率的增强,乳液的乳析指数未发生显著性变化,具体原因还需进一步研究。
乳液贮存14 d的外观图和乳析指数如图2(c)、(d)所示,SPI、EY-SPI乳液的乳析指数显著高于EY乳液(P<0.05),可能是因为随着贮存时间的延长,SPI、EY-SPI乳液中的蛋白质开始聚集,界面蛋白吸附量减少,乳液的乳脂层厚度较小,乳析指数增加。超声处理后,乳液的乳析指数显著减小(P<0.05),当超声功率为150 W时,EY-SPI乳液未发生相分离,乳析指数为0,乳液最稳定,说明超声处理可以辅助SPI显著提高蛋黄的乳化稳定性(P<0.05),该结果与2.1中乳化稳定性的研究一致。
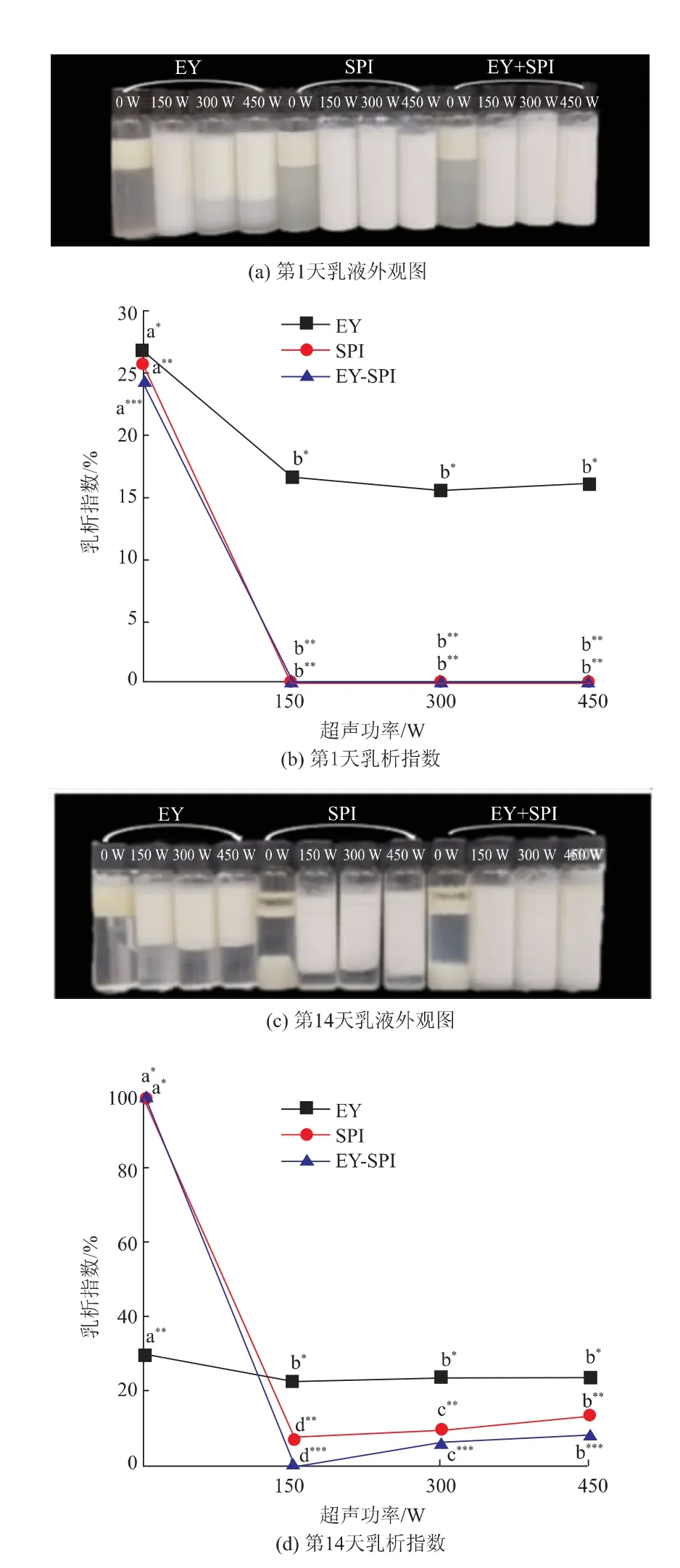
图2 不同超声功率的EY、SPI、EY-SPI乳析指数Fig.2 Emulsification index of EY,SPI and EY-SPI under different ultrasonic power
2.3 乳液的粒径
乳液粒径大小对乳液的稳定性有很大的影响,一般乳滴的直径越小,乳液的稳定性越强。乳液的粒径变化如图3所示,EY-SPI乳液的粒径显著高于EY和SPI乳液(P<0.05),表明在蛋黄液中添加SPI,EY-SPI乳液中可能产生蛋白质聚集体。超声处理后乳液粒径显著减小(P<0.05),当超声功率为150 W,EY-SPI乳液的粒径最小(P<0.05),说明适当的超声功率可以显著减小乳液的粒径(P<0.05),使蛋黄乳液达到稳定的状态;随着超声功率的增强,SPI、EY-SPI乳液的粒径增大,EY乳液的粒径减小。超声处理后,由于超声的声空化效应,产生了湍流和高剪切力,加剧了油滴的破裂,从而使乳液的粒径减小[23];而150 W的超声处理使得EY-SPI中蛋白质更容易吸附在乳液表面,蛋白质之间产生空间位阻作用,抑制了EY-SPI乳液液滴之间的相互作用,进一步减小乳液的粒径[24];但是高强度的超声功率可以产生较大湍流力和微流体,增加碰撞和聚集的速度,导致蛋白质聚集体的形成,使乳液的粒径增大[25]。
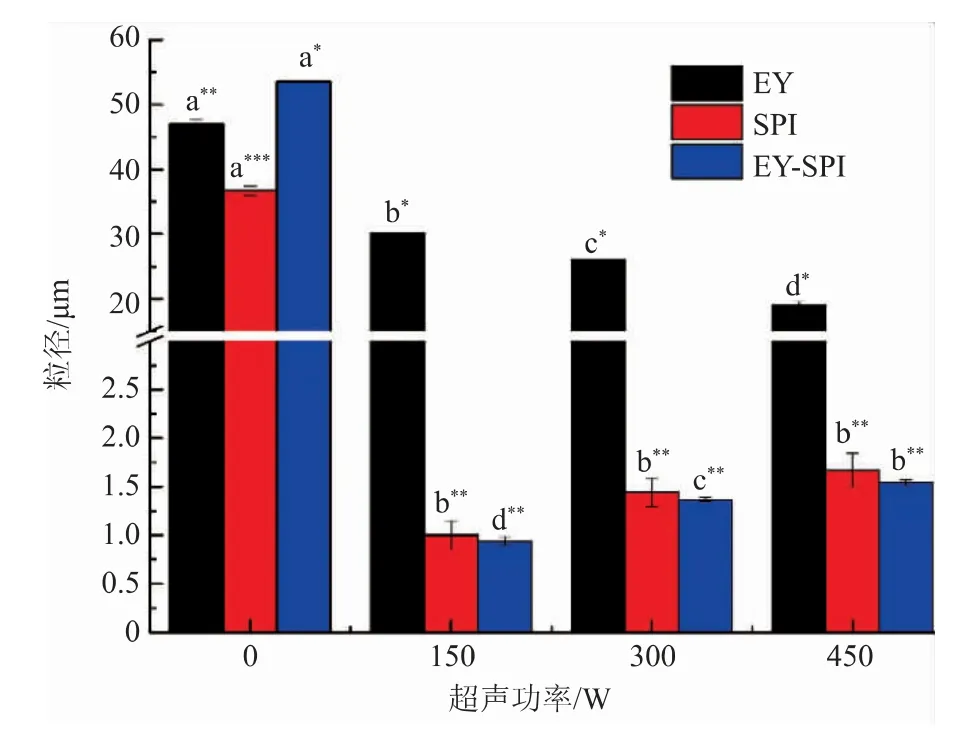
图3 不同超声功率的EY、SPI、EY-SPI粒径Fig.3 Particle size of EY,SPI and EY-SPI under different ultrasonic power
2.4 乳液的微观结构
微观结构是表征乳液颗粒大小、分散性、不稳定性的指标。如图4所示,采用倒置荧光显微镜对其微观结构进行分析,绿色荧光代表油脂。超声功率为0 W时,乳液的液滴尺寸较大,聚集情况严重。而经过超声处理后,乳液的液滴尺寸显著减小,液滴呈规律的球形状态,少有聚集情况;当超声功率为150 W时,EY-SPI乳液的液滴尺寸最小且分布均匀。表明超声处理可以减小乳液的粒径大小,并且包裹油滴的界面蛋白之间产生较强的空间阻力,形成规则的球形[26];150 W的超声处理使EY-SPI蛋白在油水界面形成更加致密的膜结构,减少了液滴的聚集。
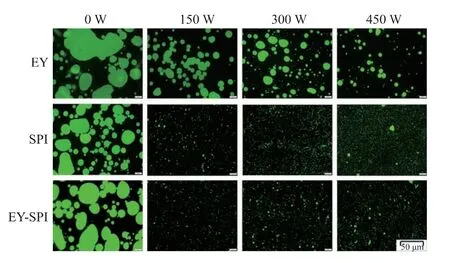
图4 不同超声功率的EY、SPI、EY-SPI微观结构Fig.4 Microstructure of EY,SPI and EY-SPI under different ultrasonic power
2.5 乳液的界面蛋白吸附量
界面蛋白的吸附能力对乳液聚集稳定有重要影响。如图5所示,EY-SPI乳液的界面蛋白吸附量显著高于EY、SPI乳液(P<0.05),表明EY、SPI等质量混合,可以使乳液的界面蛋白吸附量增加。超声处理后乳液的界面蛋白吸附量显著提高(P<0.05),当超声功率为150 W时,EY-SPI乳液的界面蛋白吸附量显著高于EY乳液(P<0.05)。随着超声功率的增强,乳液的界面蛋白吸附量降低。EY-SPI乳液界面蛋白吸附量增加可能是由于加入SPI,更多的蛋白质吸附于油水界面,油滴被更好的包裹,防止了油滴的聚集和絮凝,提高了乳液的稳定性[27];由于超声处理使蛋白质颗粒减小,更易吸附于油水界面,乳液的界面蛋白吸附量增加;150 W的超声功率可以使更多的EY-SPI蛋白吸附于油水界面,增强了液滴之间的静电排斥力,从而使EY-SPI乳液的乳化稳定性提高。超声功率超过150 W时,乳液的界面蛋白吸附量开始下降,可能是由于过高的超声功率使蛋白质发生自聚集行为,在油水界面的伸展吸附作用减弱[28]。
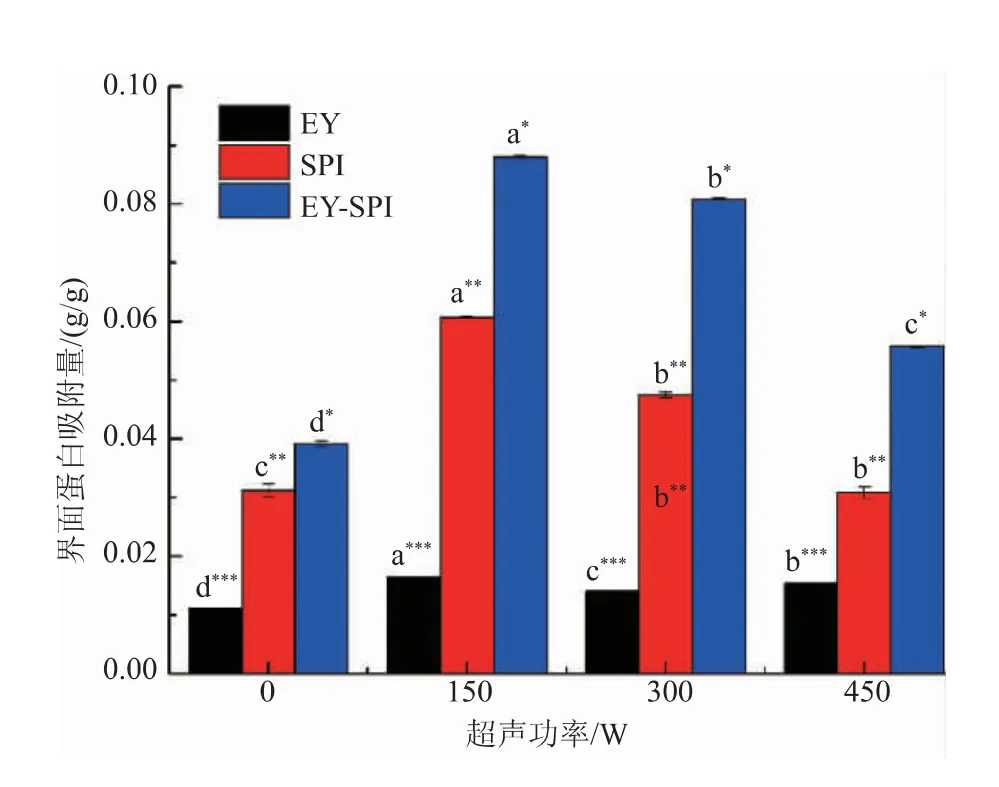
图5 不同超声功率的EY、SPI、EY-SPI界面蛋白吸附量Fig.5 Interfacial protein adsorption capacity of EY,SPI and EY-SPI under different ultrasonic power
2.6 乳液的界面蛋白组成
蛋黄乳液主要由蛋白质形成并进行稳定,而不同蛋白质稳定乳液的能力也有所差异[29],为此利用SDS-PAGE电泳分析乳液的界面蛋白组成变化情况。由于各组界面蛋白均稀释了同样的倍数,条带的深浅一定程度代表其界面蛋白含量的高低,条带的数量代表界面蛋白的种类。如图6所示,泳道5~8为EY界面蛋白条带,主要是低密度脂蛋白(相对分子质量分别为2.20×105、1.10×105~1.80×105和5.00×104)以及卵黄球蛋白(3.8×104~4.0×104)。泳道9~12为SPI界面蛋白条带。与泳道5~8相比,泳道1~4 EY-SPI出现了一些新条带,主要是3.4×104和1.5×104,这些新增条带与泳道9~12的条带基本一致,说明添加SPI后,EY-SPI乳液中的蛋白质共同吸附于油水界面,使EY-SPI乳液的界面蛋白的吸附量显著高于EY乳液。随着超声功率的增强,乳液条带颜色加深,表明超声处理可以使更多的蛋白质吸附于油水界面,乳液的乳脂层加厚,乳液液滴的静电排斥力增强,乳化稳定性提高[30]。
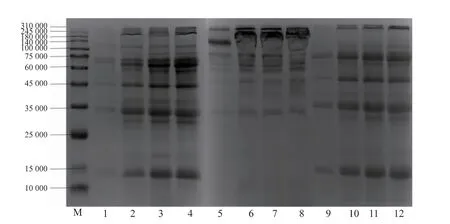
图6 不同超声功率的EY、SPI、EY-SPI界面组成Fig.6 Interface composition of EY,SPI and EY-SPI under different ultrasonic power
2.7 乳液的Zeta电位
通过测量乳液Zeta电位,研究了静电作用对蛋白质乳液稳定性的影响。如图7所示,EY-SPI乳液的Zeta电位显著高于EY乳液(P<0.05),表明在蛋黄液中添加SPI可显著增强蛋黄的静电排斥力。超声处理后乳液的Zeta电位显著提高(P<0.05),当超声功率为150 W时,EY-SPI乳液的静电排斥力最强(P<0.05)。EY-SPI乳液的Zeta电位比EY乳液的高,可能是由于SPI的加入,使更多的蛋白质吸附到乳液液滴表面,增大了油滴的表面电荷,增强了液滴间的排斥力,提高了乳液的稳定性[31]。超声处理后,EY-SPI乳液的Zeta电位增大可能是由于超声处理使蛋白质折叠分解,暴露了更多的亲水基团,增强了表面电荷密度,增大了乳滴之间的静电排斥力,提高了乳液的稳定性[32],而适当的超声功率可以使更多的蛋白质吸附于油水界面,形成较厚的乳脂层,增强液滴间的静电排斥力。
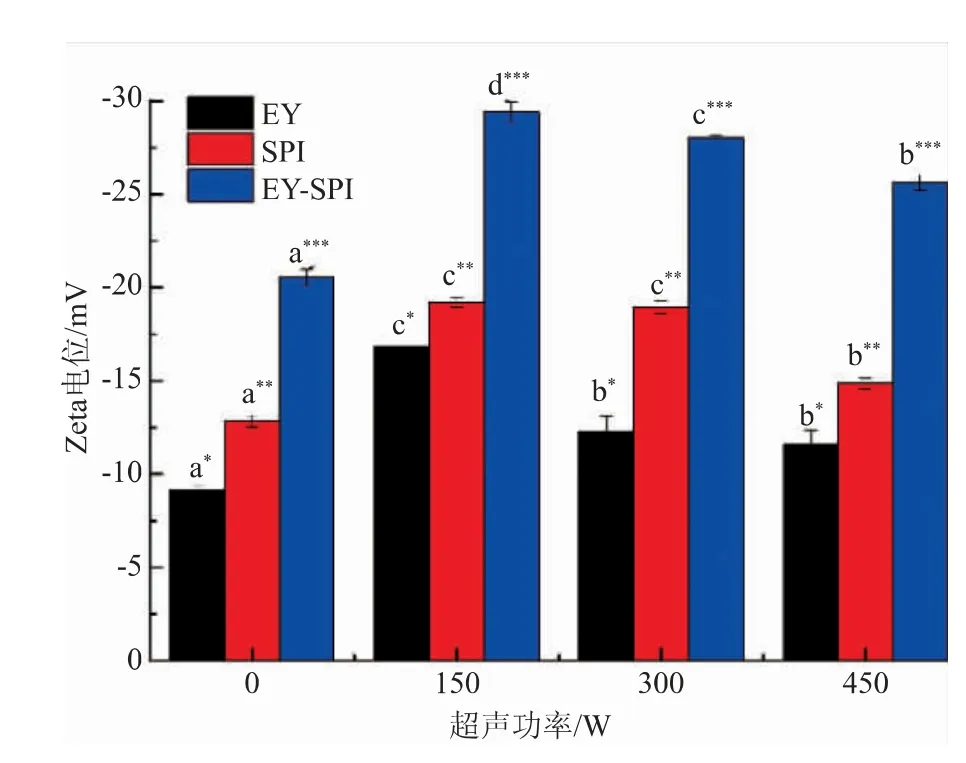
图7 不同超声功率的EY、SPI、EY-SPI电位Fig.7 Electric potential of EY,SPI and EY-SPI under different ultrasonic power
2.8 蛋白质的溶解度
蛋白质的溶解度是影响乳液性质的一个重要因素。一般认为,蛋白质的溶解度较大时,蛋白质在溶液或者两相界面发挥的作用较大,乳化性较好。如图8所示,EY-SPI乳液的蛋白质溶解度显著高于EY乳液(P<0.05),表明在蛋黄液中添加SPI可显著增强蛋黄蛋白的亲水性。超声处理后乳液的蛋白质溶解度显著提高(P<0.05),当超声功率为150 W时,EY-SPI乳液的蛋白质溶解度最高(P<0.05)。蛋白质溶解度的增加可归因于超声处理降低了EY-SPI的粒径,增强了蛋白质与水的相互作用,从而增加了蛋白质的溶解度[33];也可能是由于蛋黄蛋白分子在超声作用中部分展开,变得更易溶解,更易与SPI发生相互作用,在乳化过程中能够快速吸附到油水界面,形成稳定的乳状液[34]。
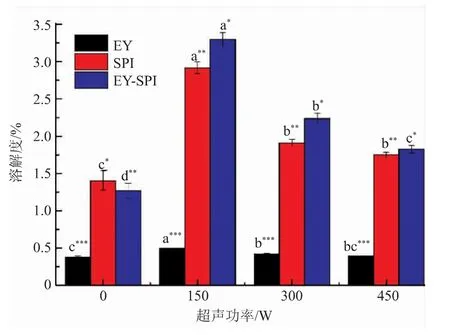
图8 不同超声功率的EY、SPI、EY-SPI溶液中蛋白质溶解度Fig.8 Solubility of EY,SPI and EY-SPI under different ultrasonic power
3 结语
添加SPI后,EY乳液的Zeta电位增大,界面蛋白吸附量提高,有效改善了EY的乳化性。而当150 W超声功率作用于EY-SPI乳液时,蛋白质聚集体破碎,形成了小的可溶性蛋白质聚集物,在乳化过程中迅速吸附在油水界面,形成了较厚的界面蛋白膜,提高了静电排斥力,乳液粒径最小,分布均一,乳液更稳定。
