用于3种食源性致病菌核酸提取的微流控芯片制备
2022-02-17申炳阳喻梓瑄占太杰周新丽
曹 宁, 申炳阳, 喻梓瑄, 占太杰, 周新丽
(上海理工大学 健康科学与工程学院,上海 200093)
由食源性致病菌引起的食源性疾病不仅严重危害人类健康,还会导致重大的经济损失[1-2],如何快速、准确地识别食源性致病菌显得尤为重要[3-4]。常用的食源性致病菌检测技术是分子诊断技术[5],如聚合酶链反应(PCR)和酶联免疫吸附测定(ELISA)。核酸提取是分子诊断的第一步,核酸的提取质量与效率直接影响实验研究结果和诊断结果[6-7]。目前,基于磁珠法提取核酸的方法最为常见,采用特异性磁珠能够捕获样品中的靶标核酸,通过外部磁体的移动执行多步骤洗涤,但该方法提取核酸存在耗时长、操作烦琐、试剂损耗多等缺点,极大降低了检测效率。
微流控技术是在微观尺寸下控制、操作和检测复杂流体的技术,通道和反应腔尺寸为微米级,具有小型化和集成化的特点[8-9]。目前,微流控技术能够把化学和生物等多领域中所涉及的样品制备、分离、等分、检测及细胞培养等操作集成在芯片上[10-11],且多单元灵活组成,构成芯片实验室。将微流控技术用于磁珠法提取核酸[12-13],能够减少扩散距离、缩短提取时间、简化操作步骤,该方法已成功应用于RNA[14-15]和DNA[16]的纯化,以及细胞分离[17]和免疫测定[18]。Shi等[19]提出了一种磁珠法与微流控技术相结合的方法用于核酸提取。该系统使用亲水性斑点固定微流控液滴,通过磁体控制磁珠在液滴之间运动。这种方法可以在低浓度的培养基中提取总RNA,提取的样品量满足实时定量PCR的检测,提取过程耗时5 min。此方法能同时提取多个样品,还可以从复杂样品中提取微量核酸,但不能测量核酸提取浓度、优化反应条件。Shu等[20]提出了一种自动液滴阵列方法,首先将试剂以油包水形式进行预存储,油相能够通过交互作用渗入微孔和缝隙,而水相被表面张力排除在外;其次,通过自动液滴阵列控制磁珠的运动来完成样品的裂解、洗涤、洗脱和检测。此方法需要编程方式来自动化控制磁珠,可操作性较差。Suimpf等[21]提出了一种在离心微流控芯片上对甲型H3N2流感病毒进行全自动样品检测方法,该检测系统通过离心微流控技术实现基于PCR的病原体检测自动化,将所有必要过程集成在一张芯片上。此方法从样品到检测完成的全部分析时间不到3.5 h,但该芯片设计复杂,制造难度大,成本高,不易进行商业化生产。
针对上述问题,作者设计并制作了一种用磁珠法提取核酸的微流控芯片,该芯片具有制作简便、操作简单、试剂消耗量低、核酸提取环境封闭性好等优势,并可对3种常见食源性致病菌进行核酸提取。为了提高核酸提取效率,对芯片通道的亲水处理时间,核酸提取孵育时间、磁珠混合次数及洗脱时间进行了优化。
1 材料与方法
1.1 材料与试剂
1.1.1 材料聚甲基丙烯酸甲酯(Polymethylmethacrylate,PMMA;光学级):日本三菱科技有限公司产品;双面胶(光学级):东莞富印胶粘科技有限公司产品;NA营养琼脂培养基:青岛海博生物技术有限公司产品;LB肉汤培养基:上海博微生物科技有限公司产品;DP705磁珠提取试剂盒:天根生化科技有限公司产品;B600001 Taq DNA聚合酶:上海生工生物工程有限公司产品。
1.1.2 菌株大肠杆菌(ATCC43895)、沙门氏菌(IQCC10518)、单增李斯特氏菌(ATCC19117):中国检验检疫科学研究院动植物检疫所赠送。
1.1.3 引物采用Primer premier 5.0分别以rfbe、sefA、hlyA基因为模板进行大肠杆菌、沙门氏菌和单增李斯特氏菌PCR引物设计。大肠杆菌上游引物rfbe-F:AAGATTGCGCTGAAGCCTTTG,下 游 引 物rfbe-R:CATTGGCATCGTCTGGACAG。沙门氏菌上游引物sefA-F:TTTACGGTCTATTTTGATTTG,下游引物sefA-R:ATATGCTCCACAAGGTTAATG。单增李斯特氏菌上游引物hlyA-F:CTGGCACGGACTTC CACTTAC,下游引物hlyA-R:TTTGAGCACCGATG ATGATTT。以上引物均由上海生工生物工程有限公司合成。
1.2 仪器与设备
VLS2.30二氧化碳激光雕刻机:美国UNIVERSAL公司产品;TBK508芯片贴合机:深圳深旺达科技有限公司产品;YQ-620C超声波清洗机;上海易净超声波仪器有限公司产品;DW-86L828超低温保存箱:青岛海尔科技有限公司产品;HD850超净台:江苏杰森博生物科技有限公司产品;GHP-9160恒温培养箱:上海一恒科学仪器有限公司产品;NANO DROP 2000C超微量分光光度计、ST16低温离心机:北京赛默飞科技有限公司产品;ZQZY-70BF摇床:上海知楚仪器有限公司产品。
1.3 芯片的设计与制作
采用磁珠法提取食源性致病菌中的核酸。磁珠法提取原理为[22]:用纳米技术对超顺磁性纳米颗粒的表面进行改良和修饰后,制备成超顺磁性氧化硅纳米磁珠。100 nm~1 μm的磁珠可以有效吸附生物样品中微量核酸,再通过外界磁场将磁珠吸附、转移、洗涤、洗脱等,完成核酸的纯化。根据此原理,微流控芯片主要包括1个核酸裂解腔、4个核酸清洗腔及1个核酸洗脱腔,分别用于磁珠与核酸的结合、核酸纯化及核酸的洗脱。
采用三维设计软件Solidworks设计出芯片的数字模型,使用聚甲基丙烯酸甲酯(PMMA)制作,芯片的尺寸为70 mm×60 mm×1.8 mm。如图1所示,芯片由3层厚度分别为0.5、0.8、0.5 mm的PMMA组成,上层主要包括气动阀(A1~A5)、抽气孔(B1)及通气孔(C1);中层主要包括裂解腔(L1)、清 洗腔(P1~P4)、洗脱腔(E1)、毛细管阀(M)等结构,各腔室的体积分别为156、180、100、180、60、15 μL。最终,使用底板进行密封键合,形成一个平行且互相可贯通的微流体网络。采用抽气孔(B1)负压抽取的方式使流体按照通道结构进行流动。芯片使用激光雕刻机进行制作,采取光学级双面胶黏合的方式进行封装,使用芯片贴合机进行对准键合并除去气泡,最终制作出核酸提取微流控芯片。
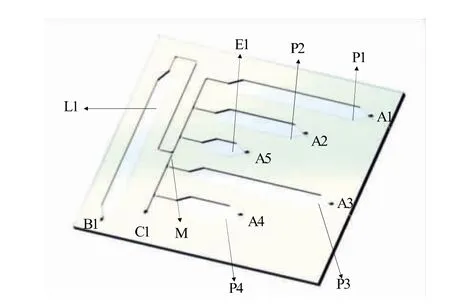
图1 核酸提取芯片的结构示意图Fig.1 Schematic diagram of nucleic acid extraction chip
1.4 芯片上核酸提取程序
首先,分别将磁珠、清洗液1、清洗液2、清洗液3、清洗液4及洗脱液预存储于L1、P1~P4以及E1中,使用硅胶贴进行密封。其次,将食源性致病菌的裂解液加入裂解腔中进行孵育裂解,裂解液中含有溶菌酶及蛋白酶K,溶菌酶能够水解细菌细胞壁,而蛋白酶K促进蛋白质水解,当DNA从食源性致病菌中释放后,磁珠会将其吸附。在裂解过程中,使用钕铁硼(NdFeB)磁铁手动控制磁珠的运动,促进细菌裂解和DNA吸附过程。裂解完成后,吸附有DNA的磁珠被磁铁牢牢固定在裂解腔内,此时注射泵以10 μL/s的流量进行液体负压抽取去除裂解液。然后,按照A1~A4的先后顺序依次打开气动阀,使P1、P2、P3、P4中的清洗液分次清洗带有核酸的磁珠,进而去除磁珠上非特异性结合的蛋白质、多糖等杂质,完成核酸的纯化过程。在洗脱前,要确保清洗液中的乙醇完全挥发,以10 μL/s的流量进行液体负压抽取,干燥10 min,去除磁珠周围及芯片上的残留液体。最后,打开气动阀(A5)将洗脱液释放到裂解腔,在56℃的恒温下进行磁珠上的核酸洗脱。将纯化后的核酸移至离心管中,用于后续检测或放入-20℃进行保存。
1.5 通道的亲水处理时间对核酸提取的影响
PMMA为芯片制作材料,具有优异的光学性能,但是其表面的疏水性能不利于微通道中流体的流动。为了减少流动时气泡的产生、降低溶液的损耗、提高核酸的提取质量浓度,采用吐温20对PMMA表面进行亲水处理[23]。将芯片PMMA放入体积分数为1%的吐温20溶液中,分别静止放置5、10、15、20、25、30 min,再将PMMA取出,放入烘箱30 min烘干。滴加体积为5 μL的去离子水于处理后的PMMA表面,测定水珠在芯片上接触角的大小,以此来判断亲水性的强弱。最后,使用吐温20试剂处理前和处理后的芯片进行大肠杆菌核酸提取,分析亲水处理对核酸提取质量浓度的影响。
1.6 芯片上核酸提取条件的优化
为了提高芯片上核酸提取质量浓度及纯度,采用上述芯片对大肠杆菌进行核酸提取,分析孵育时间、磁珠混合次数及洗脱时间对核酸提取效果的影响。
核酸孵育过程中,通过增加孵育时间,磁珠上的结合位点能够与核酸充分结合。选取孵育时间分别为3、6、9、12、15 min,每3 min进行一次磁珠的三维旋转,其他条件保持不变,最终在56℃的恒温加热板上加热10 min提取核酸,测定不同孵育时间条件下提取核酸的质量浓度。
核酸孵育过程中,通过三维旋转磁铁来进行磁珠混合,增强磁珠捕获效果,该过程核酸与捕获探针结合来捕获具有匹配序列的靶标,每隔3 min将磁铁三维旋转3、5、7、9、11次,其他条件保持不变,最终在56℃的恒温加热板上加热10 min提取核酸,测定不同磁珠混合次数条件下提取核酸的质量浓度。
核酸洗脱过程中,通过洗脱液及高温使磁珠与核酸连接间的共价键断裂,核酸转移至洗脱液。选取洗脱时间为5、10、15、20、25 min,并将芯片放在56℃的加热板上,其他条件保持不变,测定不同洗脱时间条件下提取核酸的质量浓度。
1.7 核酸质量浓度测定
提取核酸的质量浓度通过超微量分光光度计进行测量。将洗脱液的测试结果作为空白对照,得到DNA质量浓度及DNA纯度(A260/A280)。DNA质量浓度越高,表明相同菌株浓度下的DNA提取率最高;DNA纯度(A260/A280)取值在1.8~2.0表明纯度很好,取值小于1.8表明有蛋白质污染,取值大于2.0表明DNA有部分降解或有RNA污染[24]。
1.8 芯片提取核酸的扩增与验证
用微流控核酸提取芯片对革兰氏阴性菌(大肠杆菌、沙门氏菌)及革兰氏阳性菌(单增李斯特氏菌)进行核酸提取,对芯片上提取的3种不同种类的DNA进行PCR扩增和PCR产物的琼脂糖凝胶电泳实验。添加1 μL模版DNA,5 μL 10×PCR Buffer缓冲液(100 mmol/L Tris-HCl(pH 8.8,25℃)),3 μL 25 mmol/L MgCl2,1 μL 10 mmol/L dNTP,2 μL上游和下游引物,1 μL 5 U/μL Taq聚合酶添加至离心管中,用去离子水定容至最终体积为50 μL进行PCR反应。热循环方案:94℃初始变性5 min,94℃变性45 s,58℃进行30 s,72℃进行60 s,35次循环;72℃延伸10 min。以ddH2O为模板作为阴性对照。添加20 μL扩增产物与2 μL SinoBio 2×Taq混合液混合,在120 V恒定电压下,用1.5 g/dL的琼脂糖凝胶电泳分离扩增产物,将凝胶置于凝胶成像仪上,在紫外线照射下观察实验结果。
2 结果与分析
2.1 微流控芯片上的流体控制
微流控芯片上的流体控制过程如图2所示。在芯片上的L1、P1、P2、P3、P4及E1等区域分别定量加入156、180、100、180、60、15 μL的染料(见图2(a)),再使用硅胶贴密封住气动阀(A1~A5)及抽气孔(见图2(b))。调节注射泵以10 μL/s的流量进行液体负压抽取,抽取裂解腔中液体(见图2(c))。抽取完成后,将清洗腔P1的气动阀A1的密封硅胶贴转移至通气孔,使清洗腔P1内气压与大气平衡,注射泵将清洗腔P1的液体泵送至裂解腔进行清洗(见图2(d)),20 s后抽取到注射泵内。将清洗腔P2的气动阀A2的密封贴转移至清洗腔P1的气动阀A1处,清洗腔P2的液体由注射泵泵送至裂解腔进行清洗(见图2(e)),10 s后抽取到注射泵内。同理,依次将清洗腔P3、清洗腔P4、洗脱腔的液体泵送至裂解腔(见图2(f)~(h)),完成流体控制的全过程(见图2(i))。
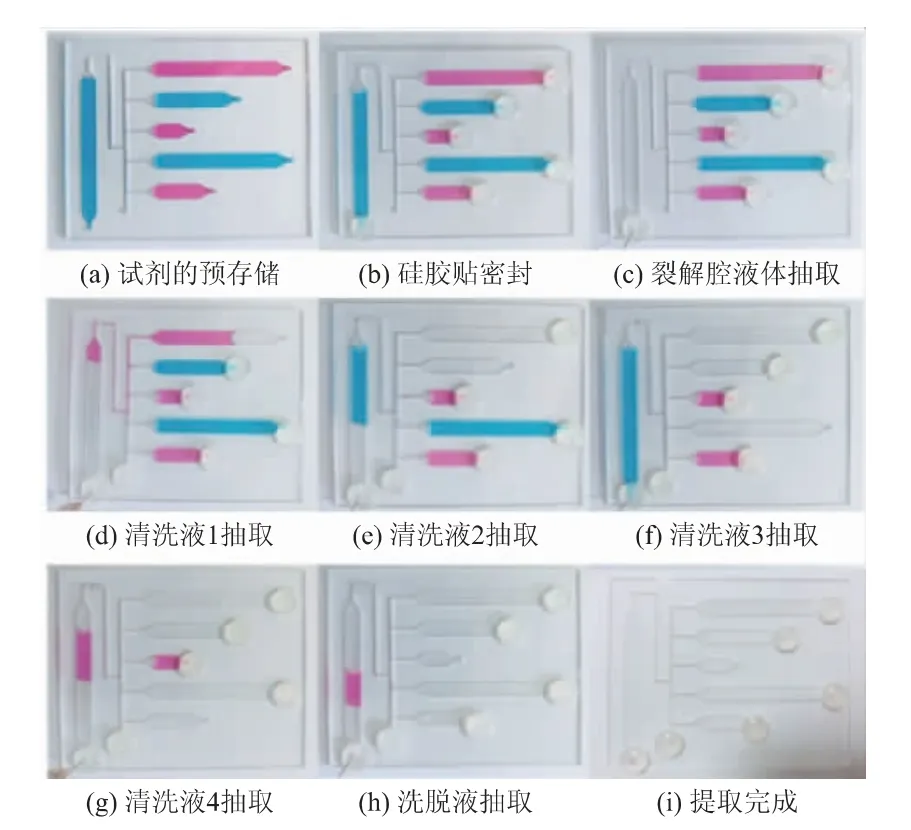
图2 芯片上流体控制实物图Fig.2 Images of fluid control on the chip
2.2 通道的亲水处理对核酸提取的影响
2.2.1 吐温20处理时间对通道亲水程度的影响接触角是固、液、气三相的交界点和固-液界面与液-气界面的切线形成的夹角,液体在固体表面的接触角能够反映液体在固体表面的亲疏水性[25-26]。亲水性增加,试剂在芯片中的残留量下降,核酸提取率增加。图3(a)从左到右依次为未做亲水处理、芯片放入体积分数为1%的吐温20中分别处理15 min和30 min后液滴在芯片表面的图像。测量不同处理时间下液滴与芯片的接触角如图3(b)所示,没有经过吐温20处理的PMMA,其接触角为65.92°,随着吐温20处理时间的不断增加,接触角逐渐变小,当处理时间大于25 min后,接触角达到最小且基本保持不变,说明亲水性能趋于稳定,此时PMMA的亲水性最好。
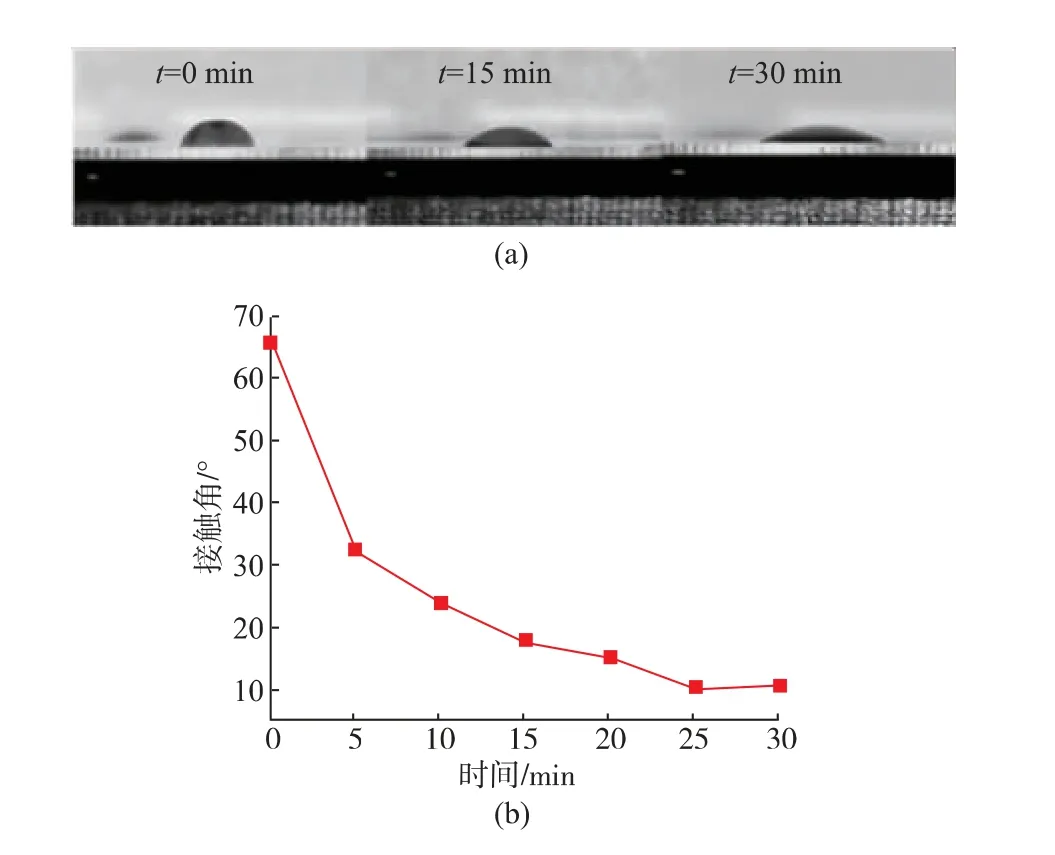
图3 吐温20处理时间与接触角之间的关系Fig.3 Relationship between reagent processing time and contact angle
2.2.2 亲水处理对芯片上核酸提取质量浓度的影响芯片亲水处理前后,核酸提取质量浓度由表1所示,吐温20处理前芯片上的核酸提取质量浓度为80.2 ng/μL,经过体积分数为1%的吐温20处理30 min后,芯片上核酸提取质量浓度为99.40 ng/μL,表明亲水处理能够有效提高核酸提取质量浓度。可采用体积分数为1%的吐温20对PMMA处理30 min,作为后续核酸提取最优条件。

表1 芯片亲水处理前后的核酸提取质量浓度及纯度Table 1 Nucleic acid extraction concentration before and after the hydrophilic treatment of the chip
2.3 芯片上核酸提取条件的优化
2.3.1 孵育时间优化孵育时间对芯片上核酸提取质量浓度的影响如图4所示。从图中可以看出,随着孵育时间的提高,DNA与磁珠吸附效果逐渐增强,在9 min时达到最高值,核酸提取质量浓度为72.65 ng/μL;孵育时间大于9 min后,核酸提取质量浓度开始下降,这是因为磁珠上的结合位点有限,其他非特异性杂质与核酸竞争结合磁珠上的位点,导致核酸提取质量浓度下降。从图4中可以看出,孵育时间为6、9、12、15 min时,A260/A280均在1.8~2.0,表明孵育时间在6~15 min时,核酸纯度良好。综合考虑,选择孵育时间9 min为最佳孵育时间。
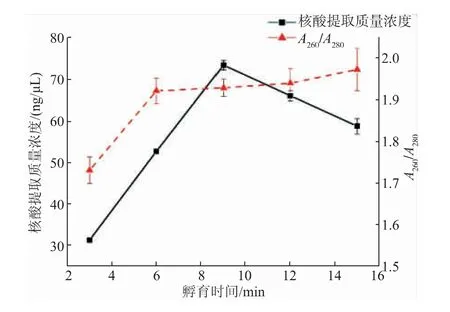
图4 孵育时间对芯片上核酸提取质量浓度的影响Fig.4 Effect of incubation time on the nucleic acid extraction concentration on the chip
2.3.2 磁珠混合次数优化磁珠混合次数对芯片上核酸提取质量浓度的影响如图5所示。从图中可以看出,随着磁珠混合次数的增加,核酸提取质量浓度不断增加,在磁珠混合次数为9次时达到最高值,随后基本保持不变。在磁珠混合次数为9次时,核酸提取质量浓度为94.76 ng/μL。在使用磁珠提取核酸的过程中,磁铁与磁珠吸附后,磁珠易发生团聚现象,不能充分吸附目标核酸,且团聚磁珠难以分散,随着磁珠混合次数的提高,磁珠团聚现象减少。当磁珠混合次数在5、7、9次时,A260/A280的比值在1.8~2.0,表明核酸纯度良好。综合考虑,选择磁珠混合次数9次为最佳磁珠混合次数。
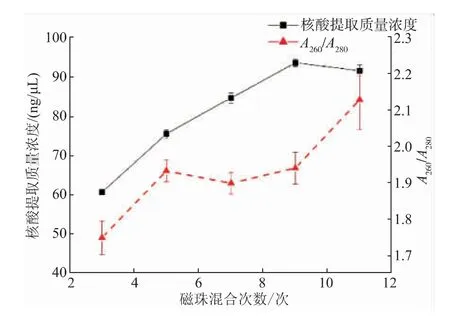
图5 磁珠混合次数对芯片上核酸提取质量浓度的影响Fig.5 Effect of magnetic beads mixing times on the nucleic acid extraction concentration on the chip
2.3.3 洗脱时间优化洗脱时间对芯片上核酸提取质量浓度的影响如图6所示。从图中可以看出,随着洗脱时间的增加,核酸提取质量浓度不断增加,在洗脱时间为20 min时达到最高值,随后开始下降。在洗脱时间为20 min时,核酸提取质量浓度为149.80 ng/μL。随着洗脱时间的不断增加,洗脱液在内部可能造成蒸发的现象,核酸提取的质量浓度下降。从图6中可以看出,洗脱时间为10、15、20、25 min时,A260/A280的比值在1.8~2.0,表明洗脱时间在10~20 min时,核酸纯度良好。综合考虑,选择洗脱时间20 min为最佳洗脱时间。
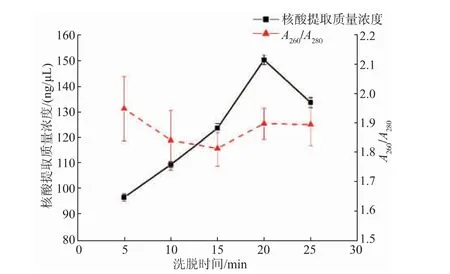
图6 洗脱时间对芯片上核酸提取质量浓度的影响Fig.6 Effect of elution time on the nucleic acid extraction concentration on the chip
2.4 芯片上3种食源性致病菌的核酸提取质量浓度
在上述孵育时间为9 min、磁珠混合次数为9次、洗脱时间为20 min优化条件下,用微流控芯片对革兰氏阴性菌(大肠杆菌、沙门氏菌)及革兰氏阳性菌(单增李斯特氏菌)进行核酸提取,表2为3种食源性致病菌的核酸提取质量浓度。结果表明,3种食源性致病菌的核酸提取质量浓度及纯度良好。
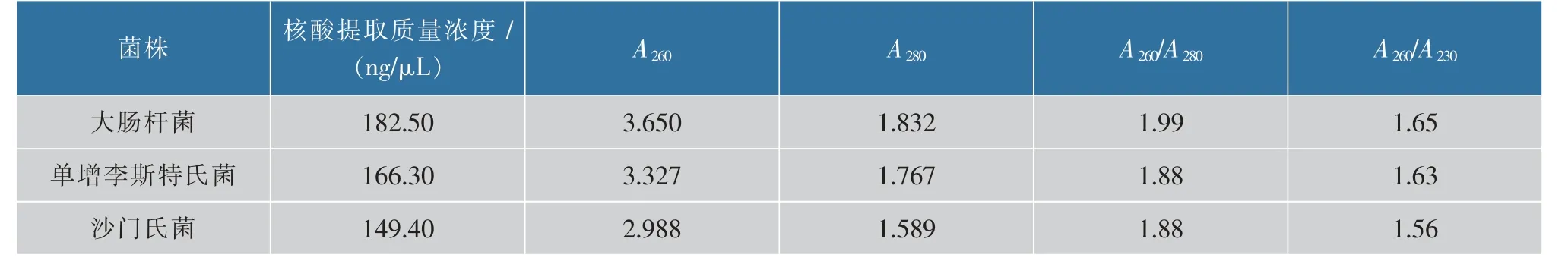
表2 3种食源性致病菌的提取质量浓度Table 2 Extraction efficiency of three food-borne pathogens
从芯片上收集的DNA,通过PCR扩增并进行琼脂糖凝胶电泳分析。图7为注入2 μL的DNA提取液的凝胶电泳结果,泳道1、2、3、4分别为阴性对照实验组、大肠杆菌的497 bp扩增子、单增李斯特氏菌116 bp扩增子及沙门氏菌443 bp的扩增子,证明了芯片上提取出的核酸满足后续实验要求。
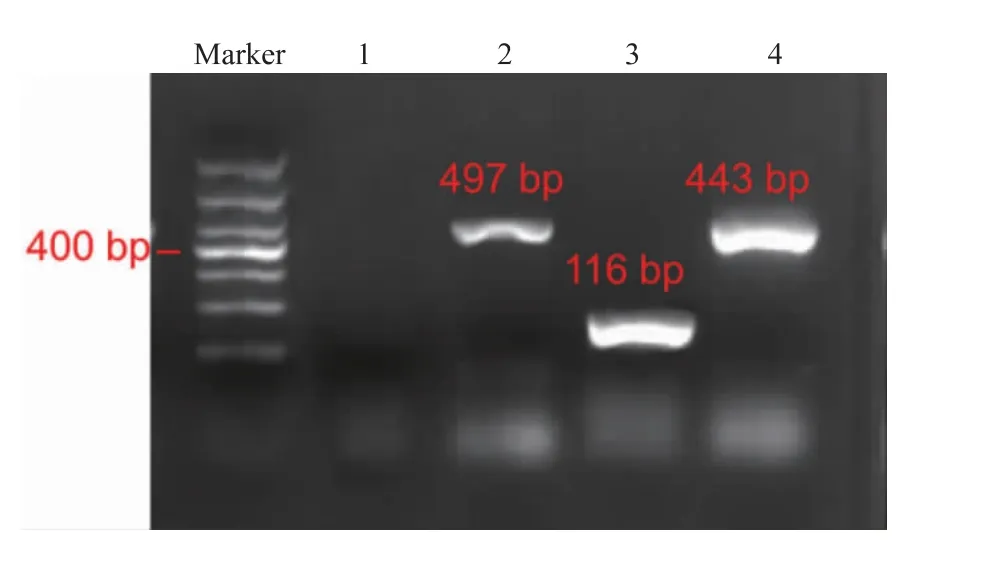
图7 3种食源性致病菌DNA经PCR扩增的电泳图Fig.7 PCR electrophoresis diagrams of three food-borne pathogens
2.5 芯片与其他核酸提取方法对比
将一些商品化的核酸提取方法与本文中提出的微流控芯片方法进行对比。苯酚氯仿抽提法使用了苯酚、氯仿等实验室常见的试剂,核酸提取成本低,但此方法毒性较大,且核酸的回收率较低。由于需要实验人员的操作,重复性较差,损失量较大,很难进行微量化操作。离心柱法比传统的苯酚氯仿抽提法提取率高,且能进行微量操作,但此方法需要进行反复离心,不便用于高通量、自动化的操作及现场检测。磁珠法能够配合96孔板核酸自动提取仪使用,实现自动化、高通量操作,且操作简单、安全无毒,但需要精密仪器,不利于现场检测。当微流控法与磁珠法相结合能够更加精准操控磁珠,通过在芯片上设计多个通道,实现各个反应单元相互隔离、互不干扰,实现高通量检测且试剂消耗量低、样品用量少。
3 结语
本文中设计了一种提取食源性致病菌核酸的微流控芯片,并通过对芯片进行亲水处理、核酸提取孵育时间、磁珠混合次数及洗脱时间等条件的优化,提高了核酸提取效率。此方法与手动磁珠提取法相比,核酸捕获、洗涤、释放均在芯片上进行,磁珠在裂解腔中固定,通过液体分批次释放流动到裂解腔,避免了微通道阀门中磁珠的捕获和丢失及阻塞微通道的问题,降低了试剂消耗量。通过调节磁珠与靶标序列的结合时间(核酸提取时间)及三维旋转磁铁的次数(磁珠混合次数),提高了目标序列的捕获速率和浓度,减少了在杂交过程中出现成簇和沉淀的情况,增加靶标结合位点,提高DNA提取量。此外,基于文中核酸提取的微流控芯片,还能够增加核酸扩增的模块,为今后集成式核酸提取及扩增的一体化芯片制备做准备。然而,对食源性致病菌进行核酸提取的微流控芯片也存在需要改进之处,如流体控制由泵驱动及磁铁旋转控制由手动操控,自动化程度还不够高,处理时间较传统核酸提取方法没有显著提高。下一步期望研制出小型一体化商用检测设备,将驱动、旋转、扩增检测等单元集成于一张芯片,使核酸检测人员不需要专业仪器培训即可在现场及资源不足的条件下进行精准病原体检测。
