超高效液相色谱-串联质谱法结合固相萃取净化测定牛奶中阿苯达唑及其主要代谢物残留量
2022-02-17贺习文雷浩赵雪宁马川高勤叶李易轩
贺习文,雷浩,赵雪宁,马川,高勤叶,李易轩
(陕西秦云农产品检验检测股份有限公司,渭南 714000)
阿苯达唑(ABZ)是一种咪唑衍生物类广谱驱虫药物,可用于驱除蛔虫、蛲虫、绦虫、鞭虫、钩虫、粪圆线虫等,凭借“高效低毒”的药理性成为最主要的驱肠道线虫药物,在全世界范围内被广泛使用[1,2]。ABZ在人和动物体内通过肝粒酶转化成阿苯达唑砜(ABZSN)和阿苯达唑亚砜(ABZSX)。ABZSN为主要杀虫成分,可对肠道线虫选择性及不可逆性地抑制寄生虫肠壁细胞胞浆微管系统的聚合,阻断其对多种营养和葡萄糖的摄取吸收,导致虫体内源性糖原耗竭,并抑制延胡索酸还原酶系统,阻止三磷酸腺苷的产生,致使虫体无法生存和繁殖[3~5]。
我国已逐步实现奶牛规模化养殖,相应的牛场中寄生虫病的问题也日渐突出。为了应对寄生虫病,ABZ等苯并咪唑类驱虫药物起到了重要作用,但同时药物极可能在奶牛体内代谢后残留在鲜奶中,导致乳品质降低的同时,还会对人类的健康产生一定的危害[6,7]。
虽然ABZ毒性较低,但母畜长时间使用会对胎儿有致畸作用和胚胎毒性。我国农业农村部和国际食品法典委员会都对牛奶中ABZ限量进行了规定,要求不得超过100μg/kg。目前,已有报道的有关ABZ及其代谢物的检测方法主要有高效液相色谱法[8~13]、酶联免疫法[14,15]及高效液相色谱-串联质谱法[16~20]等,但此类报道多是针对动物组织、阿苯达唑药片、动物血浆以及水产品等基质,难以适用于高蛋白的牛奶基质。本研究建立了适用于牛奶基质中ABZ及其代谢物的检测方法,采用含有1%乙酸的乙腈提取牛奶中ABZ及其代谢物,通过氮吹手段转换溶剂后,经C18固相萃取柱净化,使用超高效液相色谱-串联质谱仪进行测定,取得了良好的试验效果。
1 材料与方法
1.1 仪器、试剂及材料
Ultimate 3000型超高效液相色谱系统(Thermo Fisher Scientific公司,美国);TSQ Quantiva三重四级杆质谱仪(Thermo Fisher Scientific公司,美国);H1850R型冷冻离心机(湖南湘仪实验室仪器开发有限公司);CP224C型万分之一天平[奥豪斯仪器(常州)有限公司];MX-S型涡旋混合仪[大龙兴创仪器(北京)股份有限公司];KQ-100DB型数控超声波提取仪(昆山市超声仪器有限公司);MTN-4800A型氮吹仪(天津奥特赛恩斯仪器有限公司)。
阿苯达唑(ABZ,坛墨质检科技股份有限公司,纯度97.2%);阿苯达唑砜(ABZSN,阿尔塔科技有限公司,纯度99.0%);阿苯达唑亚砜(ABZSX,阿尔塔科技有限公司,纯度98.0%);乙腈(色谱纯,美国Sigma公司);甲醇(色谱纯,美国Sigma公司);冰乙酸(分析纯,天津市富宇精细化工有限公司);碳酸氢钠(分析纯,天津市大茂化学试剂厂);碳酸钠(分析纯,天津市大茂化学试剂厂);超纯水(杭州娃哈哈集团有限公司)。
1%乙酸的乙腈溶液:吸取冰乙酸10mL于1 000mL容量瓶中,用乙腈定容至刻度,摇匀。
0.1mol/L碳酸氢钠溶液:称取8.4g碳酸氢钠,用水溶解定容至1 000mL。
0.1mol/L碳酸钠溶液:称取10.6g碳酸钠,用水溶解定容至1 000mL。
碳酸盐缓冲溶液:将0.1mol/L碳酸氢钠溶液700mL和0.1mol/L碳酸钠溶液100mL混合,摇匀。
C18固相萃取柱,200mg/3mL(月旭科技有限公司)。
1.2 试验方法
1.2.1 色谱及质谱条件
色谱柱:Hypersil GOLDC18色谱柱(100×2.1mm,1.9μm);柱温:40℃;流动相:A为0.1%甲酸水溶液,B为乙腈;流速:0.2mL/min;梯度洗脱程序:0~2min,10%B;2~5min,10%B~80%B;5~7min,80%B;7~7.1min,80%B~10%B;7.1~10min,10%B;进样量:2μL。
离子源:电喷雾离子源;扫描方式:正离子扫描;监测方式:多反应检测(MRM);喷雾电压:3 500V;鞘气压力:35Arb;辅助气压力:10Arb;传输管温度:350℃;雾化器温度:150℃;各待测物质谱参数见表1。
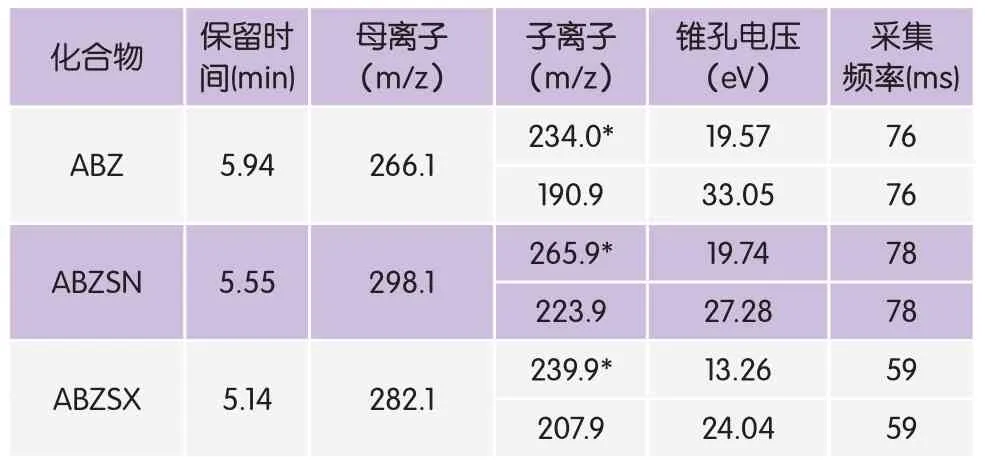
表1 目标化合物的质谱参数
1.2.2 样品处理
提取:准确称取2.00g牛奶试样,置于50mL具塞离心管中,加入10mL含1%乙酸的乙腈溶液,涡旋混合1min,超声提取10min,在4℃以8 000r/min离心5min,准确移取上清液3mL于10mL离心管中,在40℃氮气吹至近干,加入3mL碳酸盐缓冲溶液混匀。
净化:取C18固相萃取柱,先后用3mL甲醇、3mL水、3mL碳酸盐缓冲溶液活化,将上述样液全部转入C18固相萃取柱中,控制流速不超过1mL/min,待样液全部通过萃取小柱后,用5mL水淋洗,抽干30s,用5mL乙腈洗脱,收集洗脱液,在40℃下氮气吹干,用1mL甲醇复溶,过0.22μm滤膜后供超高效液相色谱-串联质谱仪测定。
1.2.3 标准溶液的配制
标准贮备液的配制:准确称取ABZ标准物质0.01078g、ABZSN标准物质0.01035g、ABZSX标准物质0.01065g,分别置于100mL棕色容量瓶中,用甲醇溶解并定容至刻度,配制成浓度分别为ABZ 104.8μg/mL、ABZSN 102.5μg/mL、ABZSX 104.4μg/mL的标准贮备液,于-18℃保存。标准混合中间液的配制:准确移取A B Z、ABZSN、ABZSX标准贮备液各100μL于10mL棕色容量瓶中,用甲醇稀释定容至刻度,配制成浓度分别为ABZ 1.048μg/mL、ABZSN 1.025μg/mL、ABZSX 1.044μg/mL的标准混合中间液,于-18℃保存。
2 结果与讨论
2.1 色谱、质谱条件的优化
2.1.1 流动相的选择
三种目标化合物(图1)在弱酸性环境下较稳定,且在酸性条件下易溶解,因此本研究在考虑流动相的配比时,水相优先考虑酸性水溶液,LC-MS常用的水相流动相为0.1%甲酸水溶液,可以很好地洗脱大多数化合物,同时可以更好地保护色谱柱,另外pH在2.6~2.7(20℃)之间,能够提供良好的酸性环境。
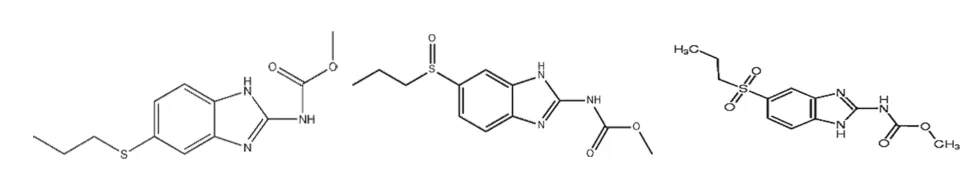
图1 3种目标化合物的化学结构式(左→右依次为ABZ、ABZSN、ABZSX)
有机相的选择上,考虑了常用的甲醇和乙腈两种有机试剂,采用甲醇作为有机相时,ABZ峰型被拉宽,且有很明显的拖尾现象,ABZSN和ABZSX峰型良好。采用乙腈作为有机相时,ABZ峰型明显改善,且在保证三种目标化合物分离效果的前提下,出峰时间比甲醇作为有机相时提前1~2min,综合考虑,选用乙腈作为有机相配比。
在洗脱方式上分别测试了等度及梯度洗脱,等度洗脱时ABZ洗脱较慢,有机相比例提高至60%时,ABZ洗脱较快,但ABZSN和ABZSX无法达到很好的分离效果。采用梯度洗脱后,三种化合物均能实现很好的分离,且洗脱时间明显缩短。
2.1.2 质谱条件的优化
将混合标准中间液以15μL/min的速率注入质谱仪,在正、负离子模式下同时观察质谱图的变化情况,在正离子扫描模式下,[M+H]+强度最大,因此采用正离子扫描模式,同时调节喷雾电压、鞘气压力、辅助气压力等质谱条件,使三种化合物的强度处于最大和最稳定状态,图2所示为3种目标化合物的总离子流图。
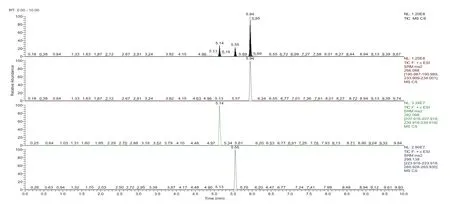
图2 3种化合物的总离子流图(50ng/mL)(上→下依次为ABZ、ABZSX、ABZSN)
2.2 方法学考察
2.2.1 线性范围
使用标准混合中间液配制成一系列的标准混合工作溶液,以优化后的条件对系列标准混合工作溶液进行分析,以浓度作为横坐标、目标化合物峰面积作为纵坐标绘制成标准工作曲线。结果表明,3种目标化合物在0.2~50ng/mL范围内呈良好线性关系,相关系数(R2)≥0.9987,表2为3种目标化合物的曲线方程、相关系数和线性范围。
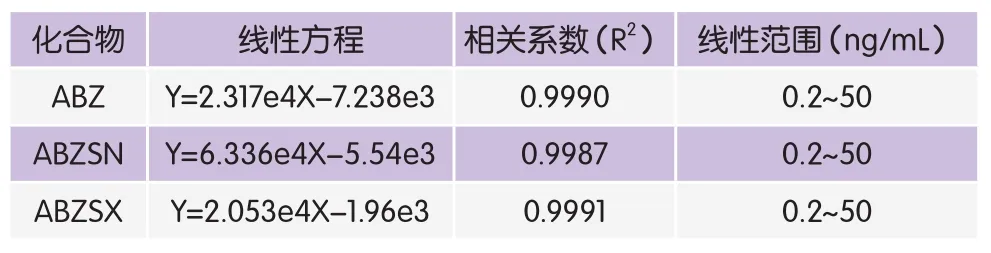
表2 目标化合物的曲线方程、相关系数和线性范围
2.2.2 检出限和定量限
以信噪比法来确定检出限和定量限。检出限(LOD)以3倍的信噪比计算,定量限(LOQ)以10倍的信噪比计算,通过不断减少向基质空白中加标量的方式来确定LOD和LOQ。结果表明,当3种目标化合物的加标量为0.5μg/kg时,响应值为3倍的信噪比,加标量为2μg/kg时,响应值为10倍的信噪比。目标化合物的检出限、定量限见表3。
2.2.3 回收率和精密度
使用空白基质分别进行三组不同浓度的添加回收试验,其中最低浓度用以验证检出限的回收率,中浓度用以验证定量限的回收率,同时添加一组高浓度用以验证方法的适用性和稳定性。此外,每个浓度各添加6份,连续测定3d,用测得的试验结果来计算日内变异系数(within-day precision)和日间变异系数(Day to day precision)。试验所得回收率和精密度见表3。
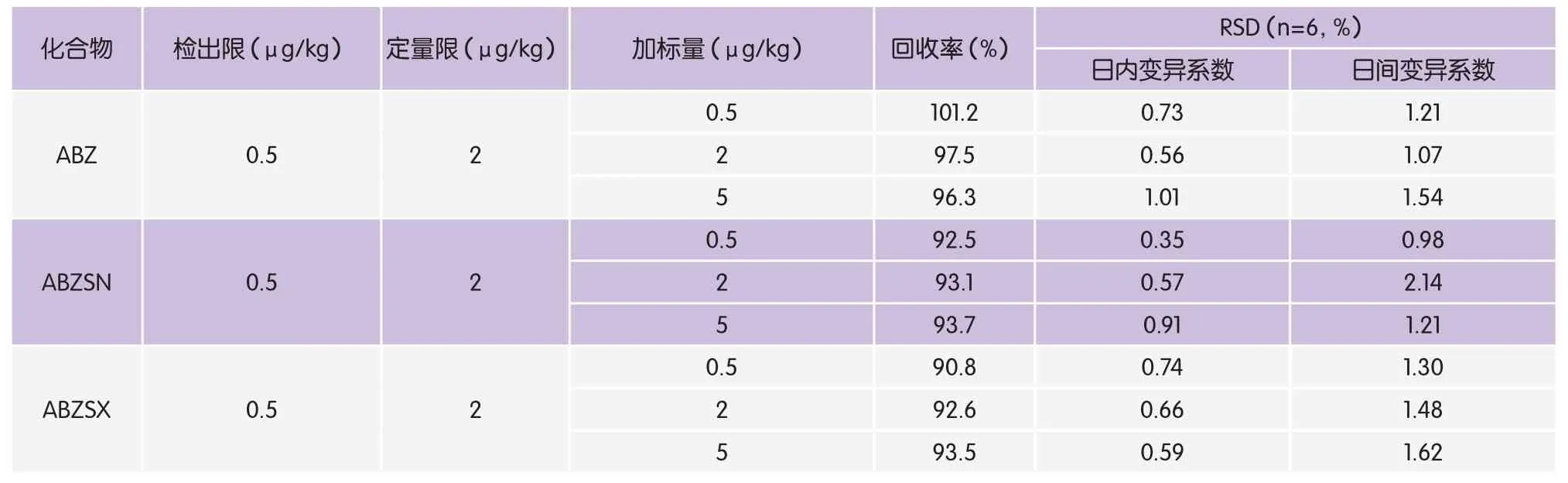
表3 目标化合物的检出限、定量限、回收率和精密度
从表3可以看出,3种目标化合物的回收率为90.8%~101.2%,日内变异系数为0.35%~1.01%,日间变异系数为0.98%~2.14%,证明本研究回收率和精密度良好。
2.3 实际样品测定
本研究共测定了23份从养殖场采集的牛奶样品,经测定23份样品中均未检出ABZ及其2种代谢物,本组数据反映出所采集的牛奶样品品质较好,奶牛未被使用阿苯达唑驱虫药或药物并未经代谢残留在牛奶中。
3 结论
本研究基于UPLC-MS/MS技术及固相萃取技术,建立了一种测定牛奶中ABZ及其2种代谢物的定量方法。经过试验证明,本方法具有良好的稳定性和重复性,且方法灵敏度高,具有较低的检出限和定量限,能够满足牛奶中ABZ及其2种代谢物的定量分析,同时能够为牛奶及其制品的质量监控提供数据支撑。
