TLR7 激动剂经lnc-DC/STAT3 而非lnc-THRIL 途径刺激肾癌患者PBMCs增强抗肿瘤作用①
2022-02-17何平林吴建军刁建军张汉超
吴 波 陈 林 何平林 叶 鑫 吴建军 陈 果 刁建军 张汉超 陈 亮
(成都医学院第三附属医院·成都市郫都区人民医院泌尿外科,成都 611730)
近些年,免疫治疗应用于晚期肾癌患者,免疫检查点抑制剂获批可作为晚期肾癌的二线治疗,对于晚期肾癌治疗方案不再单独局限于靶向药物治疗[1]。细胞毒性T 淋巴细胞(CTLs)具有直接杀伤肿瘤细胞和分泌抑癌细胞因子的能力,在肿瘤免疫治疗中发挥重要作用。肾肿瘤特异性CTL 反应需要激活抗原提呈细胞(APC),包括树突状细胞(DC)和巨噬细胞,在肾癌的免疫反应中起重要作用[2]。酪氨酸酶抑制剂(TKI)具有抑制肾肿瘤细胞生长的作用,而不具有直接的细胞毒性作用。因此,对于肾癌晚期患者的免疫治疗研究具有非常重要的临床意义。Toll 样受体的激动剂(Toll-like receptor 7,TLR7)是一类免疫应答调节剂。TLR7 的激活剂可诱导细胞内MyD88/NF-B 信号级联和强力的免疫反应,同时具有抗病毒和抗肿瘤作用,起到协同免疫反应的作用[3-4]。本课题组前期研究表明TLR7 激动剂能够有效增强肾癌患者外周血单个核细胞抗肿瘤活性,也证实IFN-γ、TNF-α 和 IL-2 对肿瘤细胞直接杀伤作用,同时对于细胞周期蛋白依赖激酶抑制剂(cyclin dependent kinase inhibitors,CDKIs)的负性调节影响,从而影响肾肿瘤细胞增殖[5]。已有研究证实TLR7 激动剂加强抗原DC 呈递作用,并提高抗原特异性 T 细胞的表达量[6]。TLR7 激活可增强CTLs杀伤性,明显抑制肿瘤细胞周期,抑制增殖、促进细胞凋亡[7];但是LR7 激动剂的作用机制还有待进一步研究。本研究拟探索lnc-DC 和lnc-THRIL 对肾癌患者PBMCs 的影响及作用机制,并进一步探索影响肾癌细胞增殖和侵袭等生物学行为改变的信号通路,为肾癌的免疫治疗提供新的思路和理论依据。
1 资料与方法
1.1 资料 病例:患者,男,58 岁,经左肾癌根治性切除术后,病理诊断为肾透明细胞癌,确诊时未发现感染炎症及其他并发症;研究方案通过医院伦理委员会审批,批件号:伦委批字号2018D2。胎牛血清(Gibco)、RPMI1640培养基、电化学发光增强型显影剂购自赛默飞世尔科技有限公司;TLR7特异性激动剂 gardiquimod 购自 Enzo Life Sciences 公司;Transwell 小室购自美国BD 公司;荧光定量PCR 仪购自美国AB 公司;反转录制备cDNA 购自赛默飞世尔科技有限公司;RIPA裂解液和蛋白酶抑制剂购自瑞士罗氏公司;GAPDH、P21、P27、STAT3 抗体购自美国Abcam 公司;Bio-Rad 电泳仪、转膜仪、PVDF 膜购自美国Bio-Rad公司。
1.2 方法
1.2.1 PBMCs 的分离、培养及刺激 患者签署知情同意书后,用乙二胺四乙酸抗凝管抽取该肾癌患者血液15 ml,置于水平离心机离心,1 500 r/min 离心10 min,离心半径10 cm,将上层血浆1.5 ml 冻存于EP管备用。剩余血液用PBS缓冲液稀释,淋巴细胞分离液混匀,梯度离心PBMCs,1 000 r/min 离心10 min,小心吸取离心管中血浆和淋巴细胞分离液界面的单个核细胞,用PBS洗涤2次,以含10%胎牛血清的1640 培养基培养并计数。TLR7 特异性激动剂gardiquimod按照操作说明书进行溶解,以10 mg/L的终浓度加入PBMCs中。
1.2.2 肾癌细胞分离和培养 取该患者术后的肾肿瘤组织标本,剪碎组织块,采用混合酶消化法分离原代细胞。传3~5 代肾癌细胞,细胞计数后将2.5×106个/ml 细胞悬液加入稀释的基质胶放置在Transwell 顶室中,小室孔径为0.4 μm,继续加入10%胎牛血清的1640 培养基1ml,待肿瘤细胞贴壁生长后换无血清培养基,加入gardiquimod 刺激4 h后的PBMCs 共同培养24 h。依据PBMCs 受shRNA(lnc-DC)、shRNA(lnc-THRIL)、shRNA(lnc-THRIL)不同处理,分为3组:对照组(gardiquimod刺激组+无shRNA组)、shRNA(lnc-DC)组和shRNA(lnc-THRIL),500 μl 10%FBS 的培养基加入含有趋化因子的基底外侧室中,37℃温育48 h 后,用棉签除去未迁移肿瘤细胞,4%多聚甲醛固定3 min,用0.1%结晶紫染色,测量OD值。
1.2.3 RNA 提 取 和 Real-time-PCR Total RNA 使用 Trizol 提取,RNA 反转录制备 cDNA 采用 High Capacity RNA-to-cDNA 试剂盒(Thermo Fisher),配制Real-Time PCR 反应体系,使用三步法程序进行PCR 反应,将反应体系置于荧光定量PCR 仪中,运行程序收集数据并分析结果。
1.2.4 Western blot 将待检测细胞用PBS 清洗后加入Roche 蛋白酶抑制剂和RIPA 裂解液;冰上孵育30 min后,移入1.5 ml EP管,12 000 r/min离心15 min取上清液并测定蛋白浓度,加入loading buffer 煮沸5 min。根据蛋白浓度调整上样量进行10%SDSPAGE 电泳,然后PDVF 膜半干转,并将膜放入由TBST 配制的5%BSA 中封闭1 h;然后孵育不同一抗(P21、P27、STAT3、pSTAT3、GAPDH)于4℃ 冰箱过夜。采用Image-Pro Plus 6.0 软件对Western blot 结果进行灰度值测定并统计分析。
1.2.5 流式细胞术检测 将肾癌细胞消化后,低速离心后去掉上清液,4℃PBS 清洗2 次;然后将细胞加入-20℃预冷的1.5 ml 70%乙醇EP 管中并在4℃冰箱孵育过夜。继续离心去掉上清液,用PBS洗涤2 次。将500 μl RNA 酶加入细胞液中,常温孵育1 h 充分降解RNA,离心去掉上清液后加入1 ml溴化乙啶和TritonX-100 避光孵育30 min。用流式细胞仪标准程序检测肾癌细胞周期,结果用细胞周期软件分析。
1.2.651Cr 释放试验测定gardiquimod 刺激PBMCs的抗肿瘤活性变化 将对照组、TLR7 激动剂后的lnc-DC 组和 lnc-THRIL 组 PBMCs 作为效应细胞,效应细胞用完全RPMI1640 培养液配制成1×107个/ml的细胞悬液备用。实验前24 h 传代肾癌细胞作为靶细胞,取1×105个/ml靶细胞,设置为效靶比40∶1、20∶1 和10∶1,同时设立自然释放孔和最大释放孔。作用时间为4 h,用γ 计数仪测量cpm 值,按以下公式计算各组的杀伤率:细胞杀伤活性(%)=(实验cpm-自放射cpm)(/靶细胞最大cpm-靶细胞自放射cpm)×100%。
1.3 统计学处理 用GraphPadPrism 软件对资料进行统计分析,计量资料均采用表示,统计方法采用单因素方差分析和SNK 法比较,以P<0.05 为差异有统计学意义。
2 结果
2.1 TLR7 激动剂对 PBMCs 中 lnc-DC 和 lnc-THRIL表达的影响 TLR7 激动剂gardiquimod 加入PBMCs后,采用 RT-PCR 检测 lnc-DC 和 lnc-THRIL 的 mRNA水平变化,如图 1 所示,TLR7 激动剂组 lnc-DC 表达明显高于对照组(P<0.05),TLR7激动剂组lnc-THRIL表达量与对照组无明显差异(P>0.05)。进一步通过 shRNA 转 染 PBMCs 并验 证 lnc-DC 和 lnc-THRIL的敲除率,如图1 结果所示:shRNA lnc-DC 组的lnc-DC 表达量较对照组和TLR7 激动剂组均明显降低(P<0.05),shRNA lnc-THRIL 组的 lnc-THRIL 较对照组明显降低(P<0.05),对应的引物序列见表1。
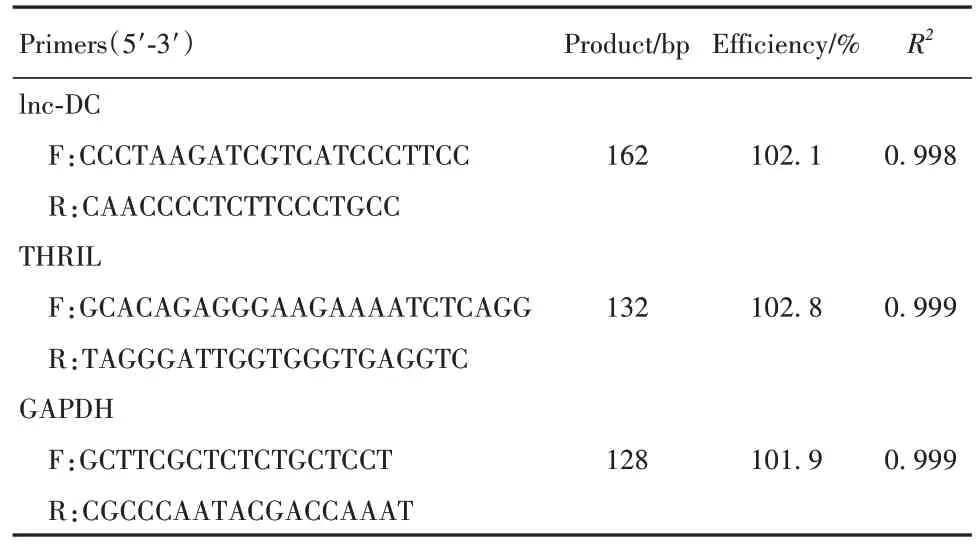
表1 PCR引物列表Tab.1 PCR primers list

图1 PBMCs 细 胞 lnc-DC 和 lnc-THRIL 的 mRNA 水 平表达量Fig.1 mRNA expression of lnc-DC and lnc-THRIL in PBMCs
2.2 TLR7 激动剂对肾癌细胞周期调节蛋白P21/P27 的表达影响 用TLR7 激动剂gardiquimod 刺激PBMCs 并分别转染 shRNA lnc-THRIL 和 shRNA lnc-DC,并进一步检测肾癌细胞周期调节蛋白表达量,如图 2 所示:Western blot 检测到 P21 在 TLR7 激动剂组和TLR7 激动剂+shRNA lnc-DC 组中无明显变化(P>0.05),与对照组相比,P21 在 TLR7 激动剂+shRNA lnc-THRIL 组中明显降低(P<0.05);与对照组相比,TLR7 激动剂组中P27 表达明显升高(P<0.05);与 TLR7 激动 剂 组比 较,TLR7 激 动剂 +shRNA lnc-DC 组和 TLR7 激动剂+shRNA lnc-THRIL组的P27表达均降低(P<0.05)。
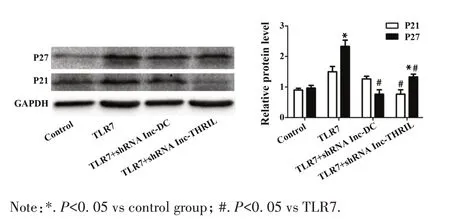
图2 肾癌细胞P27和P21的蛋白水平表达量Fig.2 Protein expressions of P21 and P27 in renal carcinoma cells
2.3 TLR7 激动剂对lnc-DC/STAT3 表达的影响进一步探究TLR7 激动剂对lnc-DC 下游分子STAT3的影响,如图3 所示:与TLR7 激动剂组相比较,STAT3 在 TLR7 激动剂+shRNA lnc-DC 组,TLR7 激动剂+shRNA lnc-THRIL 组表达均无明显差异(P>0.05);pSTAT3在TLR7激动剂+shRNA lnc-DC 组表达明显低于TLR7 激动剂组和TLR7 激动剂+shRNA lnc-THRIL组。
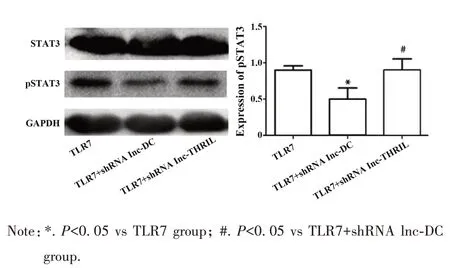
图3 肾癌细胞STAT3和pSTAT3的蛋白水平表达量Fig.3 Protein expressions of STAT3 and pSTAT3 in renal carcinoma cells
2.4 TLR7 激动剂和 lnc-DC 对 PBMCs 杀伤活性的影响 TLR7 激动剂可增强PBMCs 杀伤率,而通过shRNA 敲除 lnc-DC 和 lnc-THRIL 进一步验证 lnc-DC和lnc-THRIL 是否参与调节PBMCs 的杀伤率,如图4 所示:与TLR7 激动剂组相比较,TLR7 激动剂+shRNA lnc-DC 组的杀伤率明显降低(P<0.05),TLR7 激动剂+shRNA lnc-THRIL 组无明显改变(P>0.05);随着效靶比增高,PBMCs对肾癌细胞靶细胞杀伤率逐渐增加(P<0.05)。
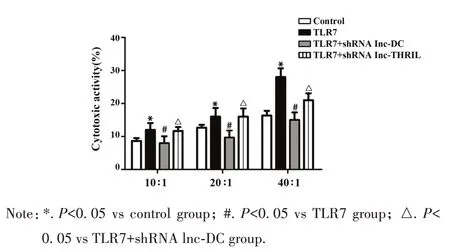
图4 在不同效靶比时PBMCs对肾癌细胞杀伤率的比较Fig.4 Cytotoxicity of PBMCs to renal carcinoma cells at different effector-target ratio
2.5 TLR7激动剂和lnc-DC对细胞增殖的影响 流式细胞术检测shRNA lnc-DC 和shRNA lnc-THRIL转染后PBMCs 和共同培养的肾癌细胞增殖,如图5所示:与对照组相比,TLR7 激动剂组明显抑制肾癌细胞增殖,以G1 期到S 期,肾癌细胞增殖指数下降明显,差异有统计学意义(P<0.05);肾癌细胞增殖指数在 TLR7 激动剂+shRNA lnc-DC 组和 TLR7 激动剂+shRNA lnc-THRIL组中的差异无统计学意义(P>0.05)。
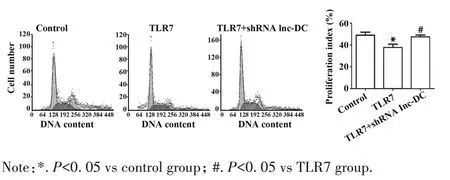
图5 流式细胞术检测肾癌细胞周期分布Fig.5 Flow cytometry to detect cycle distribution of renal carcionma cells
3 讨论
肾癌是泌尿系最常见的恶性肿瘤之一,但其发病机制极其复杂[8]。近些年发现肾癌的发生发展与免疫调节密切相关,免疫治疗在晚期肾癌的作用机制研究已取得突破性进展,免疫检查点抑制剂已获批用于晚期肾癌的二线治疗,这对于常规放化疗及靶向治疗无效的患者意义重大[9]。细胞因子诱导的杀伤细胞(CIK)是通过筛选PBMC 而获得特征性的多克隆T 淋巴细胞异质群体,具有杀瘤活性强和杀瘤谱广的特点[10]。本研究前期已证实TLR7 激动剂可增强PBMCs 抗肿瘤活性,可能通过Skp2/P27通路抑 制 肾 肿 瘤 细 胞 增 殖[5]。 但 是 ,TLR7 激 动 剂(gardiquimod)调节肾肿瘤细胞增殖相关信号通路的机制还有待进一步研究。
lncRNA 在泌尿系肿瘤中不仅参与复杂的致癌机制,还影响治疗耐药。有研究表明lncRNA 可依赖HIF 或不依赖HIF 途径调控肾癌的侵袭和转移扩散[11]。其他研究证实 lncRNAs 受 TLR7 调控,这些lncRNAs 的失调可显著改变DC 的成熟、IFN-Ⅰ和炎症细胞因子的产生、抗原递呈等,引起细胞免疫反应[12]。本研究也证实 lnc-DC STAT3 可影响树突状细胞的成熟和抗原呈递,改变PBMCs 抗肿瘤作用。研究表明在肾癌患者血清中存在一种可调节DC 分化的lncRNA,也拓宽了lncRNA 在肾癌发病中的可能机制,为肾癌分子研究和发现新的生物标志提供理论基础。
有研究表明DC 和CIK 共培养可以提高细胞毒效应,增强肿瘤的杀伤性和特异性,对于抑制肿瘤转移和复发起重要作用,从而发挥协同抗肿瘤作用[13]。
不同T 细胞群发挥免疫作用不同,为将来个体化免疫方案选择提供依据。成熟的树突状细胞将抗原呈递给细胞因子诱导的杀伤细胞CD4+或CD8+T淋巴细胞,从而发挥更强的细胞毒作用,达到抑制肿瘤的目的[14]。这与本研究结果相似,本研究结果发现敲除lnc-DC 可通过降低DC 刺激T 细胞活化能力,从而降低PBMCs 对肾癌细胞的杀伤作用。同时,本研究还通过敲除lnc-THRIL 检测STAT3、增殖相关分子,结果表明lnc-THRIL 无直接增强PBMCs的抗肿瘤作用。lnc-THRIL在其他癌种中也被发现,通过调控 TNF-α 参与肿瘤发生发展[15]。lnc-THRIL可能会通过抑制P21 的表达促进子宫内膜癌的发生,减少患者的生存时间[16]。而本研究结果表明p21无明显变化,也进一步说明lnc-THRIL 未参与肾癌患者PBMCs抗肿瘤。
其他研究还表明DC 可显著减少滋养细胞的侵袭,然而不是通过激活CD4+T细胞激发的炎症反应,而是通过成熟的DC 直接激活了p-STAT3 信号传导和增加金属蛋白酶-1(TIMP-1)和组织金属蛋白酶2(TIMP-2)抑制剂的活性,最终降低肾癌细胞的侵袭力[17]。同理,lnc-DC/STAT3 可通过激活 p-STAT3 改变金属酶活性,影响肾癌细胞侵袭能力,并且还可促进IL-17 生成,增强抗肿瘤活性,这与我们所得结果一致。通过敲除lnc-DC 可降低人单核细胞向DC分化的能力,降低DC刺激T细胞活化的能力。本研究发现了一种调节DC 分化的lncRNA,同时也拓宽了lnc-DC在肾癌中的可能作用机制。
