分泌anti-PD-L1及IFNα的间充质干细胞联合治疗小鼠黑色素瘤①
2022-02-17杨选明上海交通大学生命科学技术学院上海200240
林 浩 李 民 韩 萍 杨选明 (上海交通大学生命科学技术学院,上海 200240)
肿瘤及其周围的免疫细胞、免疫分子、细胞外基质、血管和淋巴网络等共同组成了免疫抑制性的肿瘤微环境,促进肿瘤的生长和转移,抑制抗肿瘤免疫细胞如T细胞和NK细胞的活化和效应功能,诱导肿瘤免疫抑制细胞如调节性T 细胞、肿瘤相关巨噬细胞、髓系来源的抑制细胞等,帮助肿瘤细胞逃避免疫监视[1-2]。因此,调节肿瘤微环境,改变其免疫抑制性是提高肿瘤治疗效果的关键之一[3-4]。
近年来,以免疫检查点治疗为代表的肿瘤免疫治疗在临床上取得巨大突破,但临床上仅有部分患者对免疫治疗有较好的响应,仍然许多患者对免疫治疗不响应或在初始响应后发生耐受性,因此,关于免疫检查点阻断治疗方案仍需继续改善[5-7]。PD-L1是细胞程序性死亡蛋白(programmed death-1,PD-1)的两个配体之一,广泛表达于造血与非造血干细胞,肿瘤细胞和肿瘤基质都能表达PD-L1,PD-1/PD-L1 是最知名的免疫检查点通路之一,在肿瘤环境中,PD-1和PD-L1 的结合可传递T 细胞负向调控信号,从而削弱T 细胞的抗肿瘤功能,anti-PD-L1 抗体可阻断PD-1和PD-L1的结合,解除T细胞的抑制信号,恢复T 细胞活化和效应功能,达到治疗肿瘤的效果[8-9]。PD-1/PD-L1 信号通路阻断抗体对多种肿瘤有治疗效果,但也有相当一部分患者对PD-1/PD-L1 抗体治疗缺乏响应,其中的原因与机制目前尚无定论,肿瘤组织缺乏足够的淋巴细胞浸润,肿瘤突变负荷较低,肿瘤微环境内PD-1/PD-L1表达水平低以及多种免疫抑制性细胞的作用均可能导致治疗效果不佳[10-13]。
IFNα是Ⅰ型干扰素家族成员,是最早被用于临床治疗的干扰素,也是目前临床上肿瘤免疫治疗最常用的细胞因子之一[14]。研究表明,IFNα可诱导肿瘤表面MHCⅠ分子表达,促进树突状细胞活化,其还可活化效应T 细胞、B 细胞、NK 细胞、巨噬细胞,诱导肿瘤细胞凋亡[15]。IFNα 通过调控淋巴细胞活性以及对肿瘤的浸润,可以调节免疫抑制性的肿瘤微环境,此外,IFNα 还可直接抑制肿瘤细胞增殖和血管生成,协同作用达到抗肿瘤的效果。然而,IFNα 高剂量及毒副作用是制约其临床应用的主要原因[16-18]。
间充质干细胞(mesenchymal stem cells,MSC)是一类多能干细胞,可以从骨髓、脂肪组织、胎盘、脐带等多种组织中分离出来,由于其易分离、易培养扩增、免疫原性低等特点在临床上有广泛用途[19-20]。既往研究表明MSC 存在特殊的归巢机制,外源性的MSC 具有向体内受损的组织、炎症部位以及肿瘤组织迁移的能力,因此MSC 可作为抗肿瘤药物的载体用于肿瘤治疗[21-22]。本研究以MSC 为载体,分别构建了能分泌 anti-PD-L1 蛋白和 IFNα4 蛋白的 MSC 细胞系,利用MSC 的归巢特性,联合肿瘤免疫检查点阻断抗体和细胞因子两种免疫治疗方法,靶向调控肿瘤微环境,从而提高治疗肿瘤的效果。
1 材料与方法
1.1 材料
1.1.1 实验动物 实验均采用雌性6~8周龄小鼠。C57BL/6 小鼠[体质量(17.0±1.1)g]购自北京维通利华实验动物技术有限公司。OT-Ⅰ转基因小鼠[体质量(17.8±0.5)g]购自美国 Jackson 实验室。NDG免疫缺陷小鼠[体质量(20.2±1.4)g]购自百奥赛图基因生物技术有限公司。小鼠的繁殖、饲养及实验均在恒温(20~26℃)、恒湿(50%~56%)的SPF级动物房进行。动物的培育和使用符合国际实验动物使用准则及上海交通大学实验动物伦理与使用委员会规则。
1.1.2 细胞与试剂 Lenti-293X 细胞购自美国Clontech 公司;MSC 细胞由上海隆耀生物科技有限公司馈赠;B16-OVA 细胞由美国芝加哥大学Hans Schreiber馈赠。表达质粒pCDH-EF1-MCS购自美国System Biosciences 公司;DMEM、α-MEM、RPMI 等液体培养基和双抗购自Hyclone 公司;胎牛血清购自美国Gibco 公司;分子克隆所用酶购自美国NEB 公司;CCK-8 溶液购自日本同仁公司;WB(Western blot)实验所用抗体购自美国 Sigma 公司;qPCR 实验所用试剂购自南京诺唯赞生物科技公司。
1.2 方法
1.2.1 细胞系的构建和培养 将anti-PD-L1(或IFNα4)及hFc 序列克隆到改造后的表达质粒pCDH-EF1-MCS-puro 上 ,构 建 出 pCDH-EF1-anti-PD-L1-Fc 及 pCDH-EF1-IFNα4-Fc 重组质粒并分别生产慢病毒,利用慢病毒感染MSC 细胞,通过puromycin 筛 选 后 获 得 MSC-anti-PD-L1-Fc 和 MSCIFNα4-Fc 两种细胞系。本实验所用的MSC 细胞均在37℃、5%CO2条件下培养,所用培养基为含15%胎牛血清、2 mmol/L L-谷氨酰胺、100 U/ml 青霉素和100 μg/ml链霉素的α-MEM细胞培养基。
1.2.2 细胞系的鉴定与表征 37℃恒温培养MSC、MSC-anti-PD-L1-Fc、MSC-IFNα4-Fc 3 种细胞,换液后24 h 收集上清,通过ELISA 实验检测Fc 融合蛋白含量;利用Protein A Beads富集3种细胞上清中的Fc蛋白并使用WB 进行检测,分析Fc融合蛋白对应条带。收集MSC-anti-PD-L1-Fc 的上清作为一抗,与表达PD-L1 的黑色素瘤B16-OVA 细胞共同孵育,流式检测B16-OVA 细胞表面PD-L1 的表达水平。收集MSC-IFNα4-Fc 细胞上清与B16-OVA 细胞共同孵育,利用流式细胞术检测B16-OVA细胞表面PD-L1和MHCⅠ分子表达水平。
1.2.3 细胞增殖-毒性实验 100 μl的 B16-OVA 细胞悬液置于96 孔板,每孔1×104个细胞。将培养板在37℃恒温培养箱预培养24 h,向培养板中加入等体积的MSC 细胞培养上清液和对照培养基,孵育24 h 后每孔加入10 μl CCK-8 溶液,摇床内孵育2 h后,酶标仪测定其在450 nm处的吸光值。
1.2.4 OT-Ⅰ-T 细胞杀伤实验 取OT-Ⅰ小鼠的脾脏,研磨后用红细胞裂解液1×ACK 裂解,中和后离心获得包含T 淋巴细胞的脾脏细胞,培养于含10%胎牛血清的RPMI 培养基中,将脾脏细胞、B16-OVA细胞及MSC 细胞系上清液加入96 孔板中共培养,48 h 后对B16-OVA 细胞计数并收集上清液,利用CBA检测上清液中IFN-γ的表达水平。
1.2.5 小鼠肿瘤生长与测量 取6~8周龄的小鼠,在其背部右侧皮下注射约7.5×105个B16-OVA 细胞,1 周后测量小鼠肿瘤体积[长(mm)×宽(mm)×高(mm)/2],并使用构建的MSC 细胞系在肿瘤所在位置皮下治疗,每周2次测量肿瘤体积。
1.2.6 MSC 细胞体内存续分析 对治疗后的C57BL/6 小鼠进行周期性静脉取血,ELISA 检测分析血液内Fc浓度。取约8周龄的NDG 小鼠,皮下接种7.5×105个B16-OVA细胞,1周后静脉注射1×106个MSC 细胞,取不同时间点的小鼠肿瘤组织并提取全基因组DNA,利用qPCR检测MSC细胞的DNA。
1.2.7 小鼠肿瘤微环境分析 利用MSC 细胞系治疗荷瘤小鼠7 d 后,称取约150 mg 肿瘤组织,尽可能剪碎后,利用含10%Liberase L、8%DnaseI和1%双抗的RPMI 培养基作为消化液挤压、研磨、消化,37℃摇床孵育约15 min 后利用EDTA 溶液和血清中和消化液,移液枪吹匀后转移至70 μm的滤膜过滤,利用含10%FBS的RPMI培养基冲洗,获得细胞悬液后离心并弃去上清,重悬细胞于PBS 缓冲液。加入不同的单克隆抗体组合于4℃孵育,流式分析肿瘤微环境中各类群免疫细胞。
1.3 统计学处理 两组间数据比较使用非成对双尾T检验,多组间数据比较使用单因素方差分析。误差条代表标准差或标准误。(统计学差异的意义用P表示,差异无统计学意义、P<0.05、P<0.01 和P<0.001分别以ns、*、**和***表示)。
2 结果
2.1 MSC 细胞系的构建与鉴定 ELISA 检测结果显示 MSC-anti-PD-L1-Fc 和 MSC-IFNα4-Fc 两种细胞系的上清中都有Fc 蛋白的表达(图1A),WB 检测结果与ELISA 结果相符(图1B)。流式分析可检测到与MSC-anti-PD-L1-Fc 的上清共同孵育的B16-OVA细胞表面PD-L1 的表达(图1C)。以上结果证明构建的两种MSC 细胞系都能在体外分泌Fc 蛋白,MSC-anti-PD-L1-Fc 细胞系分泌的上清具有anti-PDL1抗体功能。
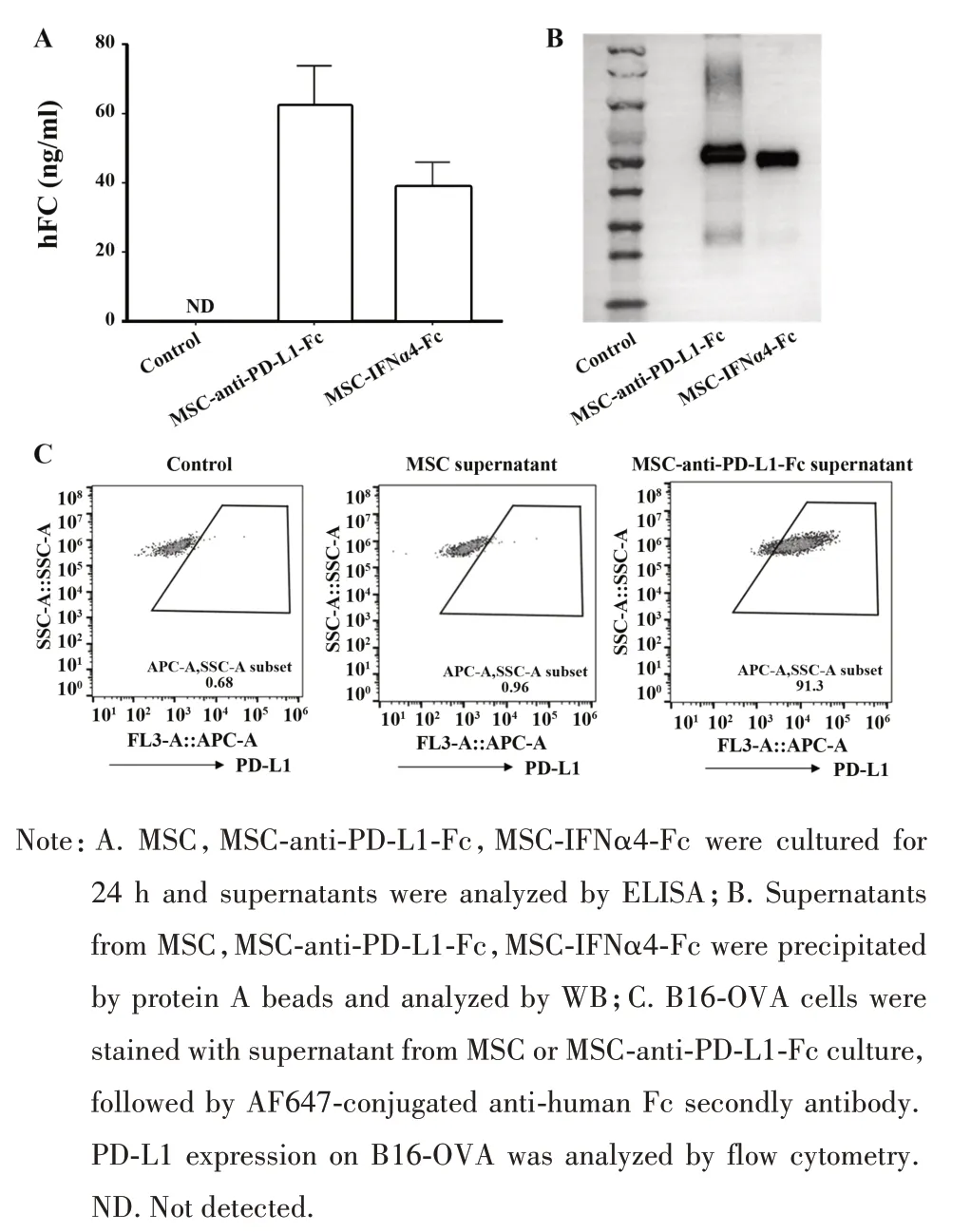
图1 改造分泌免疫调节分子的MSCs细胞系Fig.1 Engineering MSCs to secret anti-PD-L1-Fc and IFNα4-Fc
2.2 MSC 细胞系的体外功能验证 CCK-8 实验结果显示,相比对照组,加入MSC-IFNα4-Fc细胞上清的B16-OVA细胞生长受到显著抑制(P<0.001,图2A)。流式实验结果显示相比对照组,MSC-IFNα4-Fc细胞上清液可显著提升B16-OVA 细胞表面的PD-L1 及MHCⅠ的表达水平(图2B、C,P<0.001)。
OT-Ⅰ-T 细胞杀伤实验结果显示,无论是MSC-anti-PD-L1-Fc 细胞上清还是 MSC-IFNα4-Fc 细胞上清,都能显著增强OT-Ⅰ小鼠T 细胞对黑色素瘤细胞的杀伤能力,相比之下,MSC-IFNα4-Fc 细胞上清对OT-Ⅰ小鼠T 细胞的杀伤能力提升比MSC-anti-PD-L1-Fc 细胞上清更强(图2D),原因可能是IFNα4不仅能活化OT-Ⅰ小鼠T 细胞,还对B16-OVA 细胞的生长有直接抑制作用。OT-Ⅰ小鼠T 细胞与B16-OVA 细胞共培养上清流式检测结果表明,MSC-anti-PD-L1-Fc 和 MSC-IFNα4-Fc 细胞上清都能促使 T 细胞IFN-γ表达水平显著提高(P<0.001,图2E)。
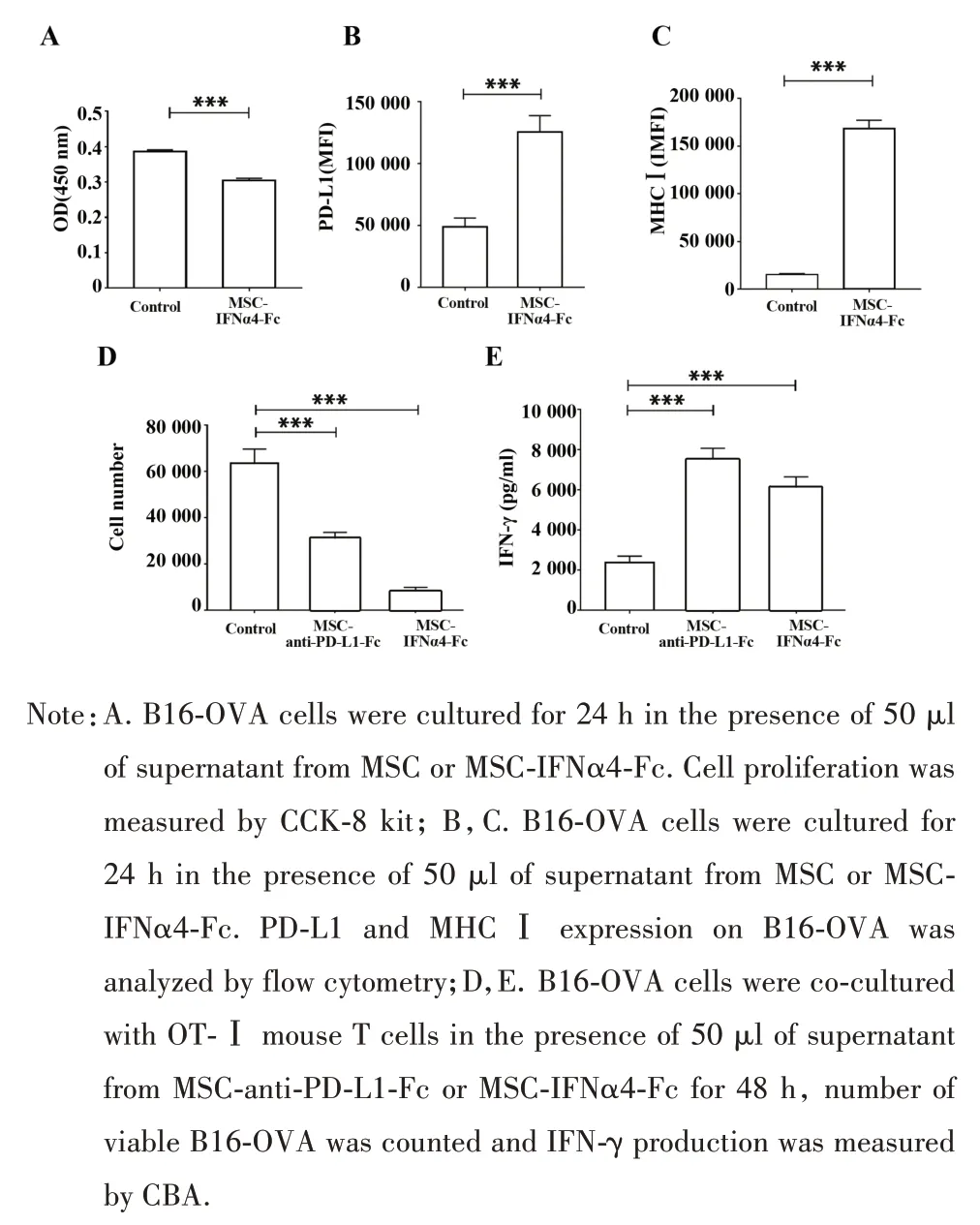
图2 MSC细胞系分泌免疫调控蛋白的体外功能研究Fig.2 Functional characterization of MSC-secreted IFNα4-Fc and anti-PD-L1-Fc in vitro
以上实验表明MSC-anti-PD-L1-Fc和MSC-IFNα4-Fc 两种细胞系在体外情况下可分泌有功能活性的an-PD-L1-Fc 和 IFNα4-Fc 蛋白,并且都能在体外刺激T 细胞活化,提升对小鼠黑色素瘤的杀伤能力,IFNα4-Fc 蛋白还能直接作用于黑色素瘤细胞,抑制肿瘤细胞生长。
2.3 MSC 细胞系的体内药效及分布 对治疗后的小鼠静脉取血,ELISA 检测分析血液内Fc 浓度,结果显示治疗后第3 天所有小鼠血液均检测到Fc,第8天时大部分小鼠血液内依然存在一定浓度的Fc(图3A),证明该治疗在小鼠体内有较好的持续性。

图3 MSCs细胞在体内的药效及分布Fig.3 In vivo duration of PD-L1-Fc and IFNα4-Fc secreted from MSCs
在NDG 小鼠B16-OVA 肿瘤模型中,利用qPCR检测是否存在MSC 细胞,结果显示在MSC 细胞治疗后的10 d 内,小鼠肿瘤组织中可检测到MSC 细胞(图3B),说明本研究中使用的MSC细胞具有向炎症性肿瘤环境迁移并在肿瘤内长期存续的能力。
2.4 MSC 细胞系的体内抗肿瘤活性研究 在C57BL/6 小鼠体内构建B16-OVA 肿瘤模型研究MSC-anti-PD-L1-Fc 和 MSC-IFNα4-Fc 在体内的抗肿瘤功能,实验结果显示MSC-anti-PD-L1-Fc 和MSCIFNα4-Fc 的联合治疗可显著抑制肿瘤的生长(P<0.001,图4A),相比于单独的MSC-anti-PD-L1-Fc 或MSC-IFNα4-Fc治疗,联合治疗对肿瘤生长抑制作用更加明显(P<0.05),相比对照组,接受MSC-anti-PDL1-Fc 或MSC-IFNα4-Fc 治疗的小鼠生存时间均显著延长(P<0.05),联合治疗组的效果更为显著(P<0.01,图4B)。流式分析小鼠肿瘤微环境中CD4+T细胞和CD8+T 细胞的比例,结果显示MSC 联合治疗可显著提升CD4+T 细胞和CD8+T 细胞浸润,单独治疗可以提升CD8+T 细胞浸润,但对CD4+T 细胞浸润提升不明显(图4C、D),由此推测MSC 联合治疗主要依赖CD8+T 细胞发挥抗肿瘤功能,联合治疗中anti-PD-L1和IFNα4具有协同作用,提升CD4+T细胞的浸润,因此能进一步提高治疗肿瘤的效果。
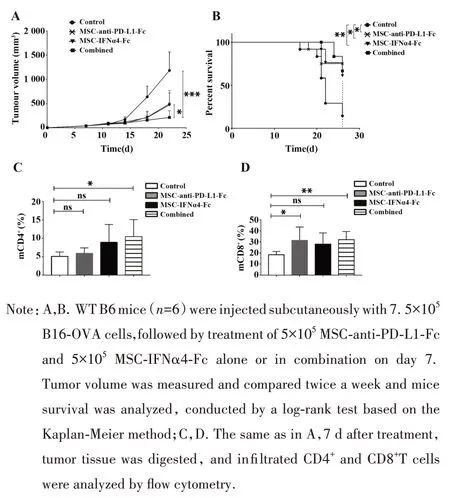
图4 MSC细胞系的体内抗肿瘤活性研究Fig.4 Anti-tumor activity of MSC-anti-PD-L1-Fc and MSC-IFNα4-Fc in vivo
3 讨论
随着对肿瘤研究的不断深入,研究者们意识到肿瘤的形成是一个动态的过程,在肿瘤发生发展的过程中,肿瘤细胞从被免疫系统识别监控,被清除或抑制,到和免疫系统彼此共存并持续对抗,最终发展成肿瘤细胞逃避免疫监控,迅速增殖并开始向周边组织侵袭和转移[23-24]。肿瘤免疫治疗是当下的研究热点,其通过活化机体免疫系统,恢复被抑制的抗肿瘤免疫反应达到治疗肿瘤的效果,理论上其相比于传统的化疗等治疗方式具有更好的靶向性和更低的副作用[25-27]。目前,以 PD-1/PD-L1 免疫阻断和CAR-T 细胞疗法为代表的免疫治疗在多种肿瘤中都显示了长期、显著的疗效,但这种良好的治疗效果往往只限于部分患者,大部分患者往往对免疫治疗响应不足甚至不响应,造成这一情况的机制目前尚在研究之中。肿瘤免疫治疗起效需要免疫细胞对肿瘤细胞的特异性识别,效应细胞的足量增殖及活化免疫细胞可对肿瘤组织的充分浸润[2]。肿瘤细胞通过免疫抑制的肿瘤微环境介导免疫逃逸和免疫耐受,改变抑制性的肿瘤微环境是恢复免疫系统抗肿瘤功能,提高免疫治疗效果的关键之一[3]。本研究利用改造的MSC 从免疫检查点阻断和细胞因子两个方面调节肿瘤微环境并活化免疫细胞,从而提高肿瘤治疗效果。
PD-1/PD-L1 通路抑制是目前临床上最常用的免疫检查点抑制之一,临床上只有一部分肿瘤患者响应PD-1/PD-L1 抗体治疗,有效的PD-L1 抗体治疗不仅需要肿瘤微环境中存在足够的PD-L1 抗体,而且需要足够的淋巴细胞浸润肿瘤组织[28]。IFNα 是临床上免疫治疗中常用的细胞因子,具有活化免疫细胞,调控肿瘤环境、抑制肿瘤细胞生长的功能,但其在体内半衰期较短,缺乏对肿瘤组织的靶向性,剂量过高时也会产生较强的毒副作用。本研究利用MSC 细胞联合PD-L1 抗体和IFNα 两种免疫治疗手段,综合二者的优势改善抑制性的肿瘤微环境,协同治疗肿瘤。MSC 细胞由于其低免疫原性和向肿瘤组织迁移的能力,是理想的肿瘤靶向治疗载体,课题组在基因水平改造MSC 细胞,使其具备分泌anti-PD-L1-Fc 和IFNα4-Fc 蛋白的能力。有研究表明,MSC 细胞具有免疫抑制和促进肿瘤生长功能,具体通过 IDO、iNOS 等机制实现,IDO 是一种具有免疫调节能力的酶,可分解色氨酸,并能通过代谢通路生成犬尿氨酸,色氨酸是T 细胞活化的必需氨基酸,而犬尿氨酸则对T细胞活化有抑制作用,人源的MSC 细胞能表达IDO 进而产生免疫抑制性[29-32],因此将MSC 用于肿瘤治疗可能会增强免疫抑制,影响治疗效果。本实验使用MSC 细胞取得了显著的抗肿瘤效果,一方面可能是因为本实验使用了IFNα-Fc 蛋白,研究显示干扰素蛋白转染后的MSC 细胞免疫抑制效果会减弱,免疫反应会由促肿瘤向抗肿瘤转变[33];另一方面,已有大量研究表明MSC 作为载体携带药效分子的抗肿瘤治疗具有可行性,这些药效分子通常有较强的治疗效果,相比之下MSC 自身潜在的促肿瘤效果可能会被覆盖[34-36]。在本研究中,anti-PD-L1-Fc 和 IFNα4-Fc 两种蛋白在肿瘤微环境中高表达,在肿瘤微环境的免疫调节中占主导地位,这种情况下,MSC 自身的免疫抑制作用可能比较有限;此外,本研究使用的MSC 细胞来源为脐带,相比其他MSC,脐带来源的MSC免疫抑制能力更弱,适用于肿瘤治疗[37]。
在体内和体外实验中,改造后的MSC 细胞都显示了抗肿瘤功能。在小鼠肿瘤模型中,MSC-anti-PD-L1-Fc 和MSC-IFNα4-Fc 两种细胞的联合治疗改善了肿瘤微环境,增加CD4+T 细胞和CD8+T 细胞的浸润,延长了小鼠的生存时间,相比单独治疗,联合治疗对肿瘤生长的抑制更加明显。联合治疗可综合两种治疗方法的优势,弥补单独治疗的局限性,肿瘤微环境中IFNα 的免疫调控能力可增加淋巴细胞对肿瘤的浸润,提升PD-L1 抗体的功能。IFNα 和anti-PD-L1共同作用,提升了对T淋巴细胞的活化能力。肿瘤环境中IFNα 会导致PD-L1 分子表达水平上调,在联合治疗中,PD-L1分子表达水平上调可能导致了MSC 分泌的anti-PD-L1-Fc 蛋白在肿瘤微环境中富集,提升了靶向抗肿瘤能力。MSC 细胞向肿瘤组织的归巢能力可确保anti-PD-L1-Fc和IFNα4-Fc蛋白能靶向进入肿瘤微环境发挥功能,降低毒副作用。通过MSC 细胞持续表达两种蛋白可以延长治疗持续时间,本实验中,经检测大部分小鼠血清中的重组蛋白可以存在超过1 周,相比传统细胞因子直接注射治疗,MSC 细胞治疗的方式药效时间更长。
综上所述,本实验以MSC 细胞为载体,通过基因改造方式分别构建了能表达anti-PD-L1-Fc 和IFNα4-Fc的MSC 细胞系,通过联合免疫检查点阻断治疗和细胞因子治疗两种免疫治疗方法调控肿瘤微环境,提升了对肿瘤的治疗效果。anti-PD-L1-Fc和IFNα4-Fc二者联合治疗可以综合双方的优势,并在一定程度上弥补单独治疗的局限性。本实验结果证明利用MSC 细胞作为载体的联合免疫治疗方式是可行的思路,并有望成为未来临床上提高肿瘤免疫治疗效果的新策略。
