蒜氨酸微丸-蒜酶肠溶双层片制备工艺优选及体外抗肿瘤作用评价*
2022-02-17方奕巍朱文涛陈金明
方奕巍,朱文涛,陈金明△
(1.赣南医学院第一附属医院,江西 赣州341000;2.江西青峰药业有限公司,江西 赣州 341000)
大蒜的主要有效成分为大蒜辣素[1−2],由蒜氨酸在蒜酶催化裂解作用下产生,具有抗肿瘤活性等多种物理学活性[3−5],但性质不稳定,在空气中易分解,故将蒜氨酸和蒜酶制备成新制剂[2],使其进入人体后生成大蒜辣素,从而发挥治疗作用。微丸表面圆整,粒径均匀,流动性良好,有利于包衣工艺,并可将包衣微丸压制成片,提高药物与胃肠道的接触面积,使药物吸收完全,从而提高生物利用度,且使用方便[6]。本研究中制备了蒜氨酸微丸−蒜酶肠溶双层片,并以人宫颈癌细胞株HeLa、人肝癌细胞株Bel−7402、人白血病细胞株HL−60、人正常肝细胞L02为研究对象,初步评价了蒜氨酸微丸−蒜酶肠溶双层片的体外抗肿瘤作用。现报道如下。
1 仪器、试药与细胞
1.1 仪器
DP30A型单冲压片机(北京新龙立科技有限公司);AT−7型溶出仪(瑞士Sotax公司);JBZ−200型挤出滚圆造粒机(辽宁医联新药研究所);小型流化床包衣机(沈阳药科大学制药厂);Waters e2695型高效液相色谱仪(美国Waters公司);YD−20KZ型硬度仪、FT−2000AE型脆碎度检查仪(天津市天大天发科技有限公司);BGZ−140型电热鼓风干燥箱(上海博迅实业有限公司);ME104E型电子天平(瑞士梅特勒−托利多公司,精度为万分之一);Varioskan Flash型连续光谱多功能酶标仪(美国Thermo Fisher公司)。
1.2 试药
蒜氨酸(由本实验室提取,纯度大于95%);蒜氨酸对照品(上海源叶生物科技有限公司,批号为YY91278,含量为98%);蒜酶(新疆埃乐欣药业有限公司,批号为201902012);微晶纤维素(MCC,Dupont Nutrition USA,批号为P119832791);低取代羟丙基纤维素(L−HPC,Shin−Etsu Chemical Co.,Ltd.,批号为5091344);交联聚维酮(PVPP,德国BASF公司,批号为75892806170);羧甲基淀粉钠(CMS−Na,安徽山河药用辅料有限公司,批号为181108);丙烯酸树脂(Eudragit®L30D−55,德国Degussa公司,批号为B150814348);羟苯乙酯(中国食品药品检定研究院,批号为100847−201604,含量为99.9%);甲醇(色谱纯,天津市康科德科技有限公司);甲酸(分析纯,上海凌峰化学试剂有限公司);其余试剂均为分析纯。
1.3 细胞
人宫颈癌细胞株HeLa、人肝癌细胞株Bel−7402、人白血病细胞株HL−60、人正常肝细胞L02均由江西中医药大学提供,均接种于15%灭活胎牛血清、100 U/mL青霉素及100 U/mL链霉素的1640培养液中,置5%饱和相对湿度、37℃的CO2孵箱中贴壁生长。
2 方法与结果
2.1 蒜氨酸分析方法[7-8]
2.1.1 外标溶液制备
取蒜氨酸对照品4.8 mg,精密称定,置100 mL容量瓶中,用纯水溶解并定容,即得质量浓度为48 µg/mL的蒜氨酸对照品溶液。
2.1.2 色谱条件
色谱柱:Kromasil C18反相柱(250 mm×4.6 mm,5 µm);流动相:磷酸盐缓冲液(pH=5)−甲醇(95∶5,V/V);流速:0.5 mL/min;柱温:25℃;检测波长:214 nm;进样量:20µL。
2.1.3 方法学考察
线性关系考察:取蒜氨酸对照品30.6 mg,精密称定,置50 mL容量瓶中,用流动相定容,即得质量浓度为612 µg/mL的对照品贮备液;依次量取对照品贮备液0.1,0.2,0.5,1.0,2.0,5.0,10.0,20.0 mL,并用流动相定容至50 mL容量瓶中,即得质量浓度分别为1.22,2.45,6.12,12.24,24.48,61.20,122.40,244.80 µg/mL的系列对照品溶液。按2.1.2项下色谱条件进样测定,以蒜氨酸的色谱峰面积(A)为纵坐标、质量浓度(C,µg/mL)为横坐标进行线性回归,得回归方程A=1.112×104C+123.5(r=0.999 8,n=8)。结果表明,蒜氨酸的质量浓度在1.22~244.80 µg/mL范围内与峰面积线性关系良好。
精密度试验:精密吸取质量浓度为61.20 µg/mL的对照品溶液适量,按2.1.2项下色谱条件连续进样测定6次,记录峰面积。结果蒜氨酸峰面积的RSD为0.73%(n=6),表明仪器精密度良好。
加样回收试验:取蒜氨酸10 mg,精密称定,平行3份,置20 mL容量瓶中,用流动相定容;准确移取该溶液各1 mL,置10 mL容量瓶中,分别加入线性关系考察项下质量浓度为612 µg/mL的对照品贮备液各0.1,1.0,3.0 mL,用流动相稀释并定容,按2.1.2项下色谱条件进样测定,记录峰面积,按外标法计算加样回收率。结果蒜氨酸的平均加样回收率为98.60%,RSD为0.86%(n=9)。
2.1.4 蒜氨酸浓度计算
蒜氨酸浓度按公式CX=AX×CS/AS计算,其中,CX为供试品溶液浓度,AX为供试品溶液峰面积,CS为对照品溶液浓度,AS为对照品溶液峰面积。
2.2 大蒜辣素分析方法[9]
2.2.1 内标溶液制备
取羟苯乙酯15.1 mg,精密称定,置50 mL容量瓶中,用60%甲醇溶解并定容,即得质量浓度为302 µg/mL的内标贮备液;移取5 mL内标贮备液,置50 mL容量瓶中,定容,即得质量浓度为30.2 µg/mL的羟苯乙酯内标溶液。
2.2.2 色谱条件
色谱柱:Kromasil C18反相柱(250 mm×4.6 mm,5 µm);流动相:甲醇−1%甲酸(70∶30,V/V);流速:1 mL/min;柱温:25℃;检测波长:242 nm;进样量:25µL。
2.2.3 大蒜辣素浓度计算
大蒜辣素浓度按公式CX=4.71×D×AX×CS/AS计算,其中,4.71为校正因子,CX为供试品溶液浓度,D为样品稀释倍数,AX为供试品溶液峰面积,CS为对照品溶液浓度,AS为内标峰面积。
2.3 蒜氨酸速释微丸制备
2.3.1 制备工艺
以MCC为填充剂,以2%十二烷基硫酸钠(SDS)溶液为润湿剂,加入适量崩解剂,采用挤出滚圆法制备蒜氨酸速释微丸,工艺参数设置为挤出频率30 Hz,滚圆频率40 Hz,滚圆时间30 s,60℃烘箱干燥12 h,以筛分法得到0.45~0.60 mm的丸芯,收集,称定质量,计算收率。
2.3.2 溶出试验
以蒜氨酸溶出度为考察指标,采用2020年版《中国药典(四部)》0931溶出度与释放度测定法,设置转速为100 r/min,温度为(37±0.5)℃。取适量微丸,置装有溶出介质的溶出杯中,以人工肠液(pH 6.8磷酸盐缓冲液)为释放介质,分别测定溶出10,20,30,45,60,90 min时在人工肠液中的累积释放率。
2.3.3 工艺优选
崩解剂选择:以MCC为稀释剂,与蒜氨酸质量比为1∶1(m/m),不加入崩解剂或加入5%CMS−Na,L−HPC,PVPP,混匀,按2.3.1项下方法制备蒜氨酸速释微丸,按2.3.2项下方法测定其在人工肠液中的累积释放率。结果以CMS−Na为崩解剂时,药物释放最快,故选择CMS−Na为速释微丸的崩解剂。详见图1 A。
崩解剂用量选择:以MCC为稀释剂,与蒜氨酸质量比为1∶1(m/m),以2%SDS溶液为润湿剂,以CMS−Na为崩解剂,含量分别为3%,5%,7%,按2.3.1项下方法制备速释微丸,按2.3.2项下方法测定其在人工肠液中的累积释放率。结果崩解剂用量为3%时累积释放率最小,用量为5%时的累积释放率与用量为7%时的曲线类似,故崩解剂用量选择5%。详见图1 B。
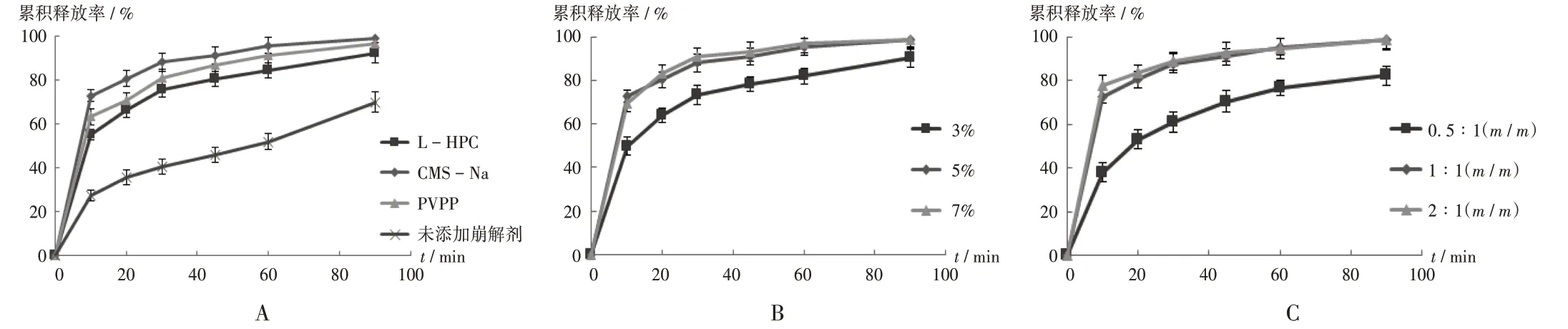
A.崩解剂B.崩解剂用量C.MCC与蒜氨酸质量比图1蒜氨酸速释微丸工艺优选(n=6)A.Disintegrating agents B.Disintegrating agent dosage C.Mass ratio of MCC to alliinFig.1 Process optimization of alliin rapid release pellets(n=6)
MCC与蒜氨酸质量比选择:以MCC与蒜氨酸质量比为筛选对象,分别为0.5∶1(m/m)、1∶1(m/m)、2∶1(m/m),以5% CMS−Na为崩解剂,以2% SDS溶液为润湿剂,混匀,按2.3.1项下方法制备速释微丸,按2.3.2项下方法测定其在人工肠液中的累积释放率。结果MCC与蒜氨酸质量比为1∶1(m/m)和2∶1(m/m)时的累积释放率曲线类似,且均高于质量比为0.5∶1(m/m)时的累积释放率,从增加微丸中主药蒜氨酸的占比考虑,最终选择MCC与蒜氨酸质量比为1∶1(m/m)。详见图1 C。
2.3.4 验证试验
按拟订优化条件,以MCC与蒜氨酸质量比为1∶1(m/m),以5% CMS−Na为崩解剂,以2% SDS溶液为润湿剂,采用挤出滚圆法连续制备3批蒜氨酸速释微丸,筛分法得到0.45~0.60 mm的丸芯,收集,称定质量,得其平均收率为(96.41±2.10)%(n=3),在人工肠液中1.5 h的累积释放率为(93.72±4.14)%(n=3),制备的微丸表面光洁、圆整,呈淡黄色。
2.4 蒜氨酸速释微丸肠溶包衣
以丙烯酸树脂(型号为Eudragit®L30D−55)为肠溶衣膜材料,以柠檬酸三乙酯为增塑剂,以滑石粉为抗粘剂,选择粒径为0.45~0.60 mm的蒜氨酸速释微丸,分3批分别配制包衣液,使包衣增重分别为5%,10%,15%(m/m),采用流化床包衣技术包制肠溶衣,制备蒜氨酸微丸,工艺参数设置为鼓风频率30 Hz,热风温度30~35℃,包衣液流速1.2 mL/min,物化压力1.0 MPa。按2020年版《中国药典(四部)》0931溶出度与释放度测定法,取适量蒜氨酸微丸,置转篮中,设置转速为100 r/min,介质温度为(37.0±0.5)℃,以人工胃液(pH 2.0)为释放介质,2 h后加入定量0.2 mol/L磷酸钠溶液,模拟人工肠液(pH 6.8),测定蒜氨酸微丸在人工胃液中2 h和人工肠液中1 h内的累积释放率。详见图2。可见,1)包衣增重10%和15%蒜氨酸微丸在人工胃液中2 h的累积释放率均小于5%,二者累积释放率曲线类似;包衣增重5%蒜氨酸微丸的累积释放率为(11.32±2.44)%(n=6)。为减少主药蒜氨酸在胃液中因释放而造成的损失,包衣增重10%和15%的条件优于包衣增重5%。2)包衣增重5%和10%蒜氨酸微丸在人工肠溶液中1 h的累积释放率曲线类似,累积释放率分别为(92.31±4.85)%和(89.72±4.52)%(n=6),包衣增重15%的累积释放率为(78.3±4.5)%(n=6)。为提高主药蒜氨酸在人工肠液中的释放率,包衣增重5%和10%的条件优于包衣增重15%,故包衣增重选择10%。

图2 包衣增重对蒜氨酸微丸中药物累积释放率的影响(n=6)Fig.2 Effect of coating weight gain on cumulative drug release rate in alliin pellets(n=6)
2.5 蒜氨酸微丸-蒜酶肠溶双层片制备
2.5.1 制备工艺
本研究中以MCC为填充剂,以CMS−Na为崩解剂,取处方量蒜酶层粉末,填入冲模中,以8 mm平头冲预压;再填入处方量蒜氨酸微丸层,以8 mm平头冲二次压成双层片,片面平整,无粘冲现象。当蒜氨酸−蒜酶的质量比(m/m)为1∶(0.5~1.5)时,大蒜辣素产率达到最高值[10],故表1中蒜氨酸∶蒜酶的处方比例符合要求。

表1 蒜氨酸微丸-蒜酶双层片处方(mg/片)Tab.1 Formulation of Enteric-Coated Alliin Pellets-Alliinse Bilayer Tablets(mg/tablet)
2.5.2 溶出试验
以大蒜辣素产率为考察指标,按2020年版《中国药典(四部)》0931溶出度与释放度测定法,设置转速为100 r/min,温度为(37±0.5)℃,取蒜氨酸微丸−蒜酶双层片,置装有人工肠液(pH 6.8)的溶出杯中,分别吸取溶出5,10,15,30,45,60 min时的溶出液1 mL,加入1 mL质量浓度为30.20µg/mL的羟苯乙酯内标溶液,混匀,按2.2项下方法测定大蒜辣素的含量,得到人工肠液中1 h内的累积大蒜辣素产率。
2.5.3 工艺优选
蒜酶层中MCC用量选择:蒜酶吸湿性较强,流动性较差,可通过加入一定量的MCC加以改善。根据前期预试验结果,当MCC用量大于每片22 mg时蒜酶的流动性方可符合压片要求,将MCC用量上限控制在每片172 mg,使片剂总质量控制在每片200~300 mg。按表1处方压片,MCC用量分别为每片22,72,122,172 mg,使片剂总质量分别为每片150,200,250,300 mg。以大蒜辣素产率为评价指标,按2.5.2项下方法测定。详见图3。可见,溶出0~30 min内,随着MCC用量的增加,大蒜辣素产率呈递增趋势;溶出超过30 min时,MCC用量为每片72,122,172 mg大蒜辣素产率的曲线几乎重合;溶出60 min时,MCC用量为每片22 mg压制的双层片的大蒜辣素产率最低,为(79.60±4.51)%。为增加片剂中主药蒜酶占比,减少辅料添加量,故选择MCC的用量为每片72 mg。

图3 蒜酶层中MCC用量对大蒜辣素产率的影响Fig.3 Effect of MCC dosage in alliinase layer on the yield of alliin
肠溶包衣温度选择:选用Eudragit®L30D−55为肠溶衣膜材料,以柠檬酸三乙酯为增塑剂,以滑石粉为抗粘剂,使包衣增重为10%(m/m),采用流化床包衣技术对蒜氨酸微丸−蒜酶双层片进行包衣,参数设置为鼓风频率30 Hz,包衣液流速0.6 mL/min,物化压力1.0 MPa,分别在热风温度为25,30,35℃下包衣,按2.5.2项下方法测定蒜氨酸微丸−蒜酶肠溶双层片中大蒜辣素在人工肠液1 h的产率。结果分别为(86.92±2.44)%、(78.34±3.73)%、(66.52±2.90)%(n=3)。可见,大蒜辣素的产率随包衣温度的升高而降低,这与蒜酶的活性随温度升高而降低,导致大蒜辣素生成减少有关。3种温度下所得包衣片均为白色,且富有光泽,表面光滑,故选择包衣温度为25℃。
2.5.4 验证试验
按以上优选工艺,MCC与蒜氨酸质量比为1∶1(m/m),以5% CMS−Na为崩解剂,以2% SDS溶液为润湿剂,采用挤出滚圆法连续制备3批蒜氨酸速释微丸,筛分法得到0.45~0.60 mm的丸芯,收集;按2.4项下方法包衣增重10%,得3批蒜氨酸微丸;以上3批蒜氨酸微丸按2.5项下方法压片、包衣制得3批蒜氨酸微丸−蒜酶双层肠溶片,每批100片。所得片剂均为白色,且富有光泽,表面光滑;制得片剂的硬度为39.2~44.8 N,脆碎度不超过0.4%;片剂的含量均匀度分别为4.94,5.18,3.61,均小于15.0,符合2020年版《中国药典(四部)》通则0941规定。
2.6 蒜氨酸微丸-蒜酶肠溶双层片溶出试验
按优选工艺,制备3批蒜氨酸微丸−蒜酶肠溶双层片,以大蒜辣素产率为考察指标,同2.5.2项下方法测定,首先采用人工胃液(pH 2.0)为释放介质,2 h后加入定量0.2 mol/L磷酸钠溶液,模拟人工肠液(pH 6.8),测定大蒜辣素在人工胃液中2 h和人工肠液中1 h内的产率。详见图4。可见,制备的3批蒜氨酸微丸−蒜酶肠溶双层片中大蒜辣素产率曲线几乎重合,说明制备工艺的重复性较好;3批片剂在2 h内人工胃液中的大蒜辣素产率均低于5%,1 h内人工肠液中大蒜辣素产率分别 为(88.51±4.80)%、(85.20±4.53)%、(86.34±2.62)%(n=6),均高于85%,符合2020年版《中国药典(四部)》规定。

图4 蒜氨酸微丸-蒜酶肠溶双层片在人工胃液和人工肠液中的大蒜辣素产率(n=6)Fig.4 The yield of alliin of Enteric-Coated Alliin Pellets-Alli⁃inse Bilayer Tablets in artificial gastric juice and artificial intesti⁃nal juice(n=6)
2.7 体外抗肿瘤作用
取蒜氨酸微丸−蒜酶肠溶双层片6片,置100 mL人工肠液中,按2.5.2项下方法测定累积释放率,30 min后开始取样,测得药液中大蒜辣素的质量浓度为1 318.91 µg/mL,此药液经1640培养液稀释,得质量浓度分别为131.89,109.91,87.93,65.95,43.96,21.98µg/mL的系列试验药液[10−11],经0.22µm微孔滤膜滤过,除菌,测定所得药液对肿瘤细胞的抑制作用。
取对数生长期Bel−7402,HL−60,HeLa,L02细胞,以1×105的细胞浓度在96孔培养板中培养,待细胞贴满孔壁时加入系列试验药液,分别为Bel−7402组、HL−60组、HeLa组、L02组。采用噻唑蓝(MTT)比色法测定肿瘤细胞的抑制率,经药液作用后的细胞与0.5 mg/mL MTT于37℃共同孵育4 h,吸弃上清液,加入二甲基亚砜,完全溶解后使用酶标仪于492 nm波长处测定吸光度(A),细胞生长抑制率(%)=(1−A实验组/A空白对照组)×100%。数据以±s表示,行t检验。P<0.05为差异有统计学意义。结果见表2。可见,蒜氨酸微丸−蒜酶肠溶双层片在人工肠液中生成大蒜辣素溶液,该药液对人正常肝细胞L02的影响很小,抑制率最高不超过10%;以L02组为对照,对HL−60,Hela,Bel−7402肿瘤细胞的抑制作用均显著增强(P<0.01),且抑制强度由大到小排序为Bel−7402>Hela>HL−60(P<0.05);对L02,HL−60,Hela,Bel−7402肿瘤细胞的抑制率随着药液浓度的增加而增大,且抑制效应呈浓度依赖性。

表2 不同质量浓度大蒜辣素蒜氨酸微丸-蒜酶肠溶双层片对肿瘤细胞的生长抑制率比较(%,n=6)Tab.2 Comparison of growth-inhibitory rate of Enteric-Coated Alliin Pellets-Alliinse Bilayer Tablets on tumor cells(%,n=6)
3 讨论
蒜氨酸储存过程中与蒜酶相遇后不稳定,易发生催化反应,生成大蒜辣素[1−2],而大蒜辣素极不稳定。通过制备成肠溶微丸,可避免蒜氨酸与蒜酶发生反应。蒜酶性质不稳定,易吸潮,遇酸及有机溶剂易变性失活[11−12]。蒜氨酸微丸−蒜酶双层片压制成功后,通过包肠溶衣隔绝胃液,防止蒜氨酸和蒜酶进入肠道前丧失活性,避免蒜酶被胃酸破坏,提高制剂的稳定性和活性成分大蒜辣素的产率。包衣过程中要注意保证较低的温度,以最大限度地保留蒜酶的活性,故最终选择双层片的包肠溶衣温度为25℃。
双层片包衣后制备成肠溶双层片,连续考察了大蒜辣素在人工胃液中2 h和人工肠液中1 h的产率,通过包肠溶衣的方式,使蒜氨酸进入肠道后可大量释放,进而在蒜酶催化下生成大量大蒜辣素。在人工胃液中,主药蒜氨酸损失较小,大蒜辣素产率不超过5%。
本研究中评价了制备的蒜氨酸微丸−蒜酶肠溶双层片的体外抗肿瘤作用,模拟了肠溶片进入肠道后的崩解释放情况。结果显示,双层片崩解释放生成的溶出液(主要为大蒜辣素)对L02,HL−60,Hela,Bel−7402肿瘤细胞均有抑制作用,表明其被肠道所吸收而产生药效。
综上所述,优选的蒜氨酸微丸−蒜酶肠溶双层片制备工艺稳定、合理,体外溶出曲线良好,体外抗肿瘤作用明显,药物的稳定性提高,为该药物的中试研究和工业化生产奠定了基础。
