抗新型冠状病毒小分子化合物研究进展
2022-02-17徐向荣姚雷
徐向荣,姚雷
(1.烟台大学校医院,山东 烟台264005;2.烟台大学药学院,山东 烟台 264005)
新型冠状病毒肺炎(COVID−19)由严重急性呼吸综合征冠状病毒2(SARS−CoV−2)导致,至今仍在全球肆虐。尽管紧急使用的多款疫苗对遏制疫情有一定作用,但病毒不断变种,仍需开发新型小分子化合物药物来预防和治疗COVID−19。病毒感染主要涉及病毒吸附并穿入宿主细胞、病毒的复制及组装、成熟病毒的释放等阶段,在上述阶段采用药物干预可有效控制病毒的感染和传染。目前,抗冠状病毒(CoV)小分子化合物药物的开发策略主要有3种:一是通过虚拟筛选方式,从天然产物或合成化合物库中筛选出对特定病毒靶点有潜在作用的化合物;二是对先导化合物进行结构修饰改造,或从头设计,发现活性较强且具有良好药代动力学(简称药动学)性质的候选化合物;三是老药新用,增加已上市药物的适应证。在此,采用计算机检索SciFinder、PubMed、中国知网、万方、维普等数据库中关于抗SARS−CoV−2小分子化合物的相关文献,检索时限为2019年1月至2021年3月,中英文关键词为“COVID−19”“SARS−CoV−2”“small molecule”“新型冠状病毒”,综述了SARS−CoV−2感染各阶段药物的作用靶点及小分子抑制剂的研究进展,为加速新型抗病毒药物的开发提供参考。
1 干扰病毒侵入
血管紧张素转换酶2(ACE2)在SARS−CoV−2感染人体过程中扮演了关键角色[1]。SARS−CoV−2外壳上的刺突蛋白与ACE2结合后可进入人体细胞,引发肺炎,还可能会损伤肝功能及造成心肌损伤[2]。因此,通过与刺突蛋白或ACE2结合,进而阻断病毒与ACE2的结合是预防和控制COVID−19的有效途径[3]。
2020年初,中药制剂在抗击COVID−19疫情中发挥了重要作用。CHEN等[4]证实,中药连花清瘟制剂中的连翘酯苷(1)、芦荟大黄酸(2)、绿原酸(3)等多酚类物质对ACE2具有强烈的抑制作用。LUO等[5]等报道,甘草酸(4)可通过抑制ACE2及下调促炎性细胞因子的表达而抑制病毒的吸附及穿入。CARINO等[6]和CHEN等[7]报道,白桦脂酸(5)、齐墩果酸(6)、五没食子酰葡萄糖(7,PGG)等天然及半合成甾体类化合物可与刺突蛋白受体结合区(RBD)结合,从而阻断病毒与ACE2结合。SILVA ANTONIO等[8]通过虚拟筛选中药天然产物及代谢物发现,黄芩苷(8)、柚皮素(9)、橙皮素(10)等11种黄酮类和二氢黄酮类物质等有抑制ACE2的作用。同时发现,糖基化可增强苷元的活性,提取混合物的活性也显著高于单一纯物质。鉴于此类天然产物毒副反应较低,故有学者建议用于日常环境及防护器具的消杀。10种刺突/ACE2抑制剂的化学结构式见图1。
除了从天然产物中寻找ACE2抑制剂外,CAO等[9]还利用计算机从头设计了小分子蛋白LCB1和LCB3的氨基酸序列,分别为DKEWILQKIYEIMRLLDEL⁃GHAEASM RVSDLIYEFMKKGDERLLEEAERLLEEVER和NDDEL HMLMTDLVYEALHFAKDEEIKKRVFQLFE⁃LADKAYKNNDRQKLEKVVEELKELLERLLS,其中LCB1的效力为迄今报道的最有效单抗的6倍,目前正在啮齿动物中评估LCB1。
2 干扰病毒复制
SARS−CoV−2主蛋白酶(Mpro)又称3C样蛋白酶(3CLpro),是一种多聚蛋白裂解成病毒所必需的功能性蛋白酶。故通过抑制Mpro的活性,可抑制病毒的复制,从而达到抗病毒的目的。
1)合成肽类Mpro抑制剂
SARS−CoV−1和SARS−CoV−2的Mpro序 列相似性为96%,活性中心完全一致。HOFFMAN等[10]研究SARS−CoV−1的晶体结构发现,化合物11和化合物12(半数有效浓度为5µmol/L)的抗病毒作用均较好。其中的酮基团主要与病毒Mpro中的半胱氨酸−145形成四面体过渡态,2−吡咯烷酮基团与谷氨酸−166形成氢键。体内试验表明,化合物12的血浆稳定性良好,清除率低,适于进一步开发成抗SARS−CoV−2药物[11]。
QIAO等[12]根据治疗丙型肝炎病毒感染的蛋白酶抑制剂波普瑞韦和替拉瑞韦的结构,设计合成了32个含有2−吡咯烷酮结构的双环脯氨酸衍生物,体外试验证明,均可抑制病毒的复制[半数生长抑制浓度(GI50)为7.6~748.5 nmol/L]。其中,效果较好的化合物13和化合物14在SARS−CoV−2感染的转基因模型小鼠中,可大大降低小鼠肺部的病毒载量,改善肺部病变程度,同时这2种抑制剂在大鼠体内也表现出了良好的药动学特性和安全性。分子对接试验结果显示,2−吡咯烷酮基团与病毒Mpro中的组氨酸−163和苯丙氨酸−140形成氢键作用,醛基与半胱氨酸−145作用。ZHANG等[11]设计合成了系列2−吡咯烷酮类化合物,作为CoV Mpro的广谱抑制剂。化合物15对重组CoV Mpro的抑制活性较好[半数抑制浓度(IC50)为1.95µmol/L]。以环己烷代替化合物15中苯丙氨酸的苯环,得到化合物16,其在被病毒感染的Huh7细胞中也表现出了良好的抗中东呼吸综合征(MERS−CoV)与抗SARS−CoV活性。进一步优化化合物16的结构发现,肉桂酰胺侧链成环可得到含有吡啶酮的化合物17和化合物18,尽管抗病毒活性略降低,但化合物17和化合物18表现出了更好的吸收−分布−代谢−排泄(ADME)性质。然而,去掉化合物18中的叔丁氧羰基保护基后,由于其产物无法透过细胞膜,故失去了抑制病毒复制的作用[13]。
FRECER等[14]通过建立三维定量构效关系模型,优化化合物18中的2−吡咯烷酮基团,发现引入2,4−咪唑二酮基团(化合物19和化合物21),可提高化合物的抗病毒作用。在P3和P1′部位引入含有杂原子的芳香环(化合物20和化合物21),增加了化合物与酶的氢键的结合能力,抗病毒活性也显著提高。分子对接试验结果显示,化合物21比化合物18多了6个氢键(分别来源于乙内酰脲、苯并噻嗪、甲酚基团)作用。
PANT等[15]报道了4种肽样小分子病毒抑制剂,含有α,β−不饱和酯的化合物22和化合物24、酮基的化合物23和化合物25等,可与Mpro中的半胱氨酸−145、谷氨酸−166、谷氨酰胺−192等氨基酸残基结合。
合成肽类Mpro抑制剂化学结构式见图2。
2)具有抗SARS−CoV−2作用的化合物
TON等[16]筛选出了1 000余种潜在Mpro抑制剂,其中新型化合物585种。活性较好的化合物均含有1−苯基−5−氨基吡唑结构单元,如化合物26和化合物27。分子对接试验结果显示,化合物26中苯环与Mpro的P2部分产生疏水作用,哌啶酮基团则与半胱氨酸−145和亮氨酸−141形成2个氢键。
BUNG等[17]采用人工智能方法,针对Mpro靶点,从头设计并筛选出了31个潜在抗CoV的新化学实体,其中预测活性最好的化合物28至化合物30均含有1个双环或三环体系,同时含有酰胺等极性基团。
IBRAHIM等[18]报道了4种含有双二氧戊环结构的醛糖酸衍生物,即化合物31至化合物34,对Mpro亲和性均较高(结合能>−56 kcal/mol,1 kcal=4.148 kJ)。其中,二氧戊环中的氧原子与Mpro中的组氨酸−163及甘氨酸−143氨基酸残基形成氢键。由于含有磺酰胺结构中的芳香杂环结构可与Mpro中的谷氨酸−166残基形成氢键,故化合物33和化合物34的活性高于化合物31和化合物32。理化性质及类药性预测结果均显示,该类化合物可作为治疗SARS−CoV−2的候选化合物。
虚拟筛选出的具有抗SARS−CoV−2作用的化合物化学结构式见图3。
3)作用Mpro的天然产物
通过虚拟筛选及体外筛选,SAYED等[19]、BHARADWAJ等[20]、CHOUDHRY等[21]报道了多种天然黄酮类化合物,如2,3−二氢穗花杉双黄酮(化合物35)、罗汉松双黄酮B(化合物36)、芦丁(化合物37)、槲皮苷−3−O−α−L−吡喃阿拉伯糖苷(化合物38)、黄芩素(化合物39)、Penimethavone A(化合物40)、(+)−Anthraben⁃zoxocinone(化合物41),均可与Mpro结合,从而强烈抑制Mpro的活性。MHATRE等[22]报道了没食子儿茶素没食子酸酯(化合物42,EGCG)和茶黄素−3,3′−双没食子酸酯(化合物43,TF3)等茶多酚类物质可与病毒复制过程中的多个靶点结合,可进一步开发成预防和治疗CoV的药物。
NOVAK等[23]通过虚拟筛选,从5 543个微生物天然产物图集中发现8个化合物具有良好吸收−分布−代谢−排泄−毒性(ADMET)性质如天然核苷Futalo⁃sine(化合物44)和吲哚生物碱类化合物(化合物45和化合物46),既可与Mpro的催化活性区结合而抑制酶的活性,又可和Mpro结构中的Ⅱ区和Ⅲ区中间的沟槽结合,抑制酶的聚合及成熟。
作用于Mpro的天然产物化学结构式见图4。
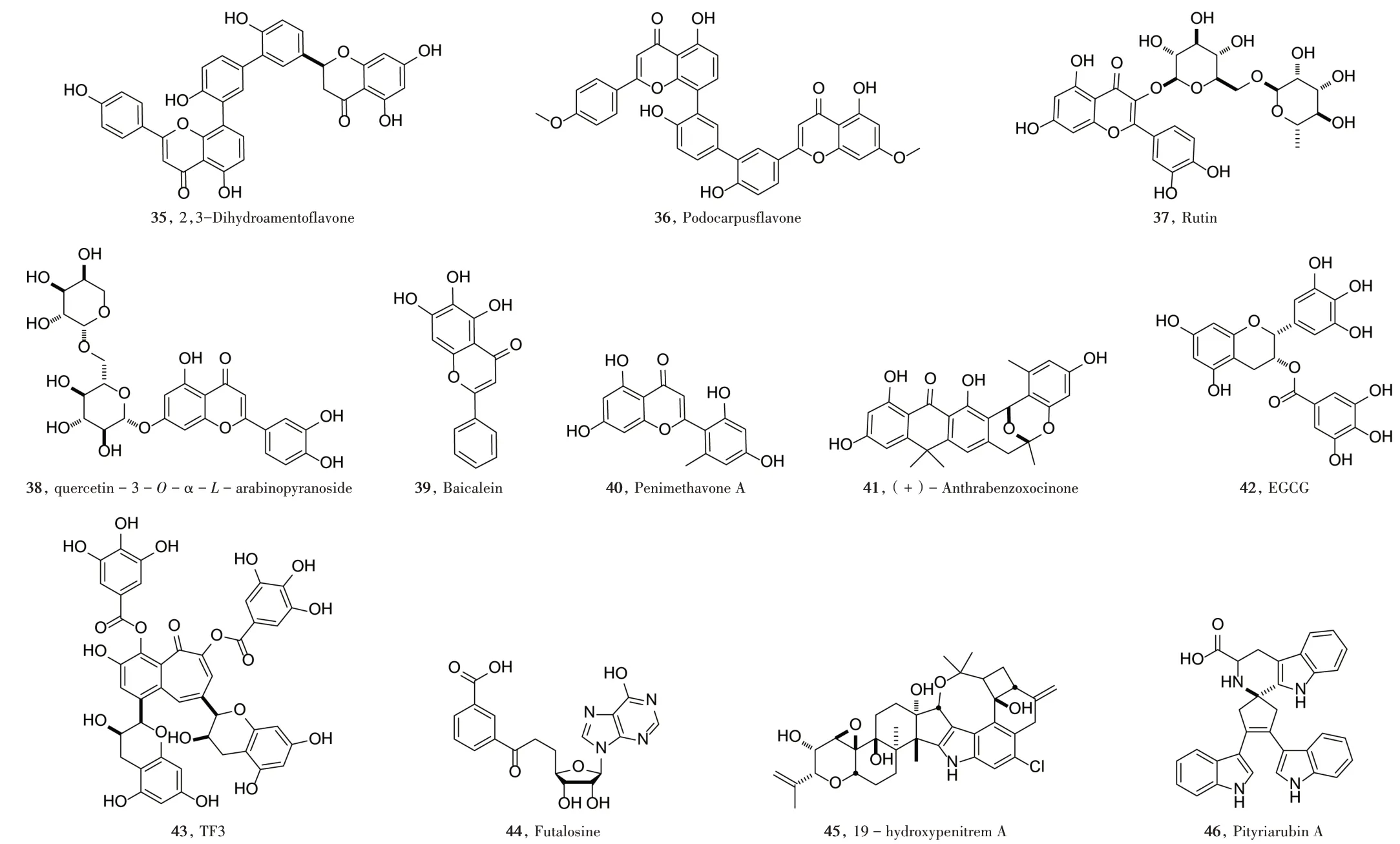
图4 作用于Mpro的天然产物化学结构式Fig.4 Chemical structures of natural products acting on MPRO
4)抑制病毒复制的化合物
SARS−CoV−2含有16个非结构蛋白(NSP),其中NSP3,NSP9,NSP10,NSP12,NSP15,NSP16在病毒的复制过程中发挥着重要作用。PARIDA等[24]从印度的草药中发现了9种天然产物,如醉茄素A(化合物47,Witha⁃ferin A)可选择性地抑制病毒的NSP,达到抗病毒作用。MIRZA等[25]利用NSP12(RNA依赖性RNA聚合酶)及NSP13(解螺旋酶)的晶体结构,虚拟筛选出了具有开发成广谱抗病毒药物潜力的先导化合物,如化合物48和化合物49均在NSP12的活性中心;采用和瑞德西韦一致的结合方式,与丝氨酸−759、赖氨酸−798、丝氨酸−814、天冬氨酸−623、精氨酸−553等残基形成氢键。SARS−CoV−2的类木瓜蛋白酶(MLpro)在病毒的复制过程中与Mpro作用一致,MIRZA等[25]预测含有苯并噻唑结构的化合物50可显著抑制MLpro。体外试验中,化合物50对Jurkat和MOTL−4细胞的IC50分别为9.67µmol/L和11.8µmol/L[26]。
SCHUMANN等[27]发现,5−氨基−2,3−二氢−1,4−二氮杂萘二酮(化合物51,MP1032)均具有多种药理学作用,抑制SARS−CoV−2作用较强,1 mmol/L MP1032可抑制70%病毒的复制,2 mmol/L MP1032可100%抑制病毒的复制。在体内的安全性方面,口服MP1032 3个月,未出现严重药品不良反应,但其抗病毒的分子机制仍需进一步确证。
抑制病毒复制的化合物化学结构式见图5。
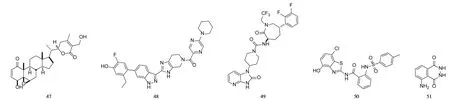
图5 抑制病毒复制的化合物化学结构式Fig.5 Chemical structures of compounds inhibiting virus replication
3 老药新用
3.1 具有抗SARS-CoV-2作用的抗病毒药物
目前,各国的医药学家通过筛选临床研究各阶段的药物和候选化合物发现,部分药物具有治疗COVID−19的潜能[28−29],包括抗病毒药物可比司他(化合物52)、利托那韦(化合物53)、洛匹那韦(化合物54)、达芦那韦(化合物55)、奈非那韦(化合物56)、沙奎那韦(化合物57)、替拉那韦(化合物58)、芦平曲韦(化合物59)、茚地那韦(化合物60)、比卡格韦(化合物61)、埃替格韦(化合物62)和Tegobuvir(化合物63)。上述药物的化学结构式、用途及作用靶点见图6。

图6 具有抗SARS-CoV-2作用的抗病毒类药物化学结构式、用途及作用靶点Fig.6 Chemical structures,application and action targets of anti-viral drugs with anti-SARS-CoV-2 action
3.2 具有抗SARS-CoV-2作用的抗微生物类药物
奥昔康唑(化合物64)、丝他康唑(化合物65)、酮康唑(化合物66)、艾沙康唑(化合物67)、伊曲康唑(化合物68)和普卢利沙星(化合物69)等抗真菌药物和抗菌药物具有抑制SARS−CoV−2 Mpro活性的作用。DU⁃ROJAIYE等[30]和ZHAO等[31]指出,头孢呋辛酯(化合物70)和四环素(化合物71)等抗菌药物可通过与病毒刺突RBD的酪氨酸与甘氨酸残基作用,阻断与ACE2结合;或与病毒复制组装过程中的Mpro和NSP12等靶点结合,抑制病毒复制,从而发挥预防和治疗COVID−19的作用。同时,2种药物自身的抗菌及抗炎作用可明显减少患者在重症监护病房的停留时间及呼吸机的使用时间。上述药物的化学结构式、用途及作用靶点见图7。

图7 具有抗SARS-CoV-2作用的抗微生物类药物化学结构式、用途及作用靶点Fig.7 Chemical structures,application and action targets of anti-microbial drugs with anti-SARS-CoV-2 action
3.3 具有抗SARS-CoV-2作用的精神类药物
部分精神类药物通过作用于中枢神经系统各靶点发挥药理作用,也具有潜在抗SARS−CoV−2的作用。如作用于4−氨基丁酸(GABA)受体,用于治疗失眠的佐匹克隆(化合物72);作用于食欲素受体,用于睡眠障碍的莱博雷生(化合物73);作用于5−羟色胺、多巴胺、去甲肾上腺素等受体,用于治疗精神、神经疾病的药物,如舍吲哚(化合物74)、匹莫齐特(化合物75)、氯噻平(化合物76)、度洛西汀(化合物77)、瑞波西汀(化合物78)、匹莫范色林(化合物79)、美噻吨(化合物80)、苯海索(化合物81);作用于大麻素受体1,用于治疗肥胖的药物利莫那班(化合物82);作用于酸敏感钾离子通道的呼吸兴奋剂多沙普仑(化合物83);用于治疗癫痫的谷氨酸盐受体拮抗剂吡仑帕奈(化合物84)。上述药物的化学结构式、用途及作用靶点见图8。

图8 具有抗SARS-CoV-2作用的精神类药物化学结构式、用途及作用靶点Fig.8 Chemical structures,application and psychotropic of anti-psychotic drugs with anti-SARS-CoV-2 action
3.4 具有抗SARS-CoV-2作用的其他类药物
组胺H1受体拮抗剂如依巴斯汀(化合物85)、非索非那定(化合物86)、氯马斯汀(化合物87),以及M胆碱受体拮抗剂如哌仑西平(化合物88)、羟苄利明(化合物89),均具有潜在抗SARS−CoV−2作用。RIVA等[32]发现,激酶抑制剂阿匹莫德(化合物90)除可有效抑制埃博拉病毒、拉沙病毒、马尔堡病毒外,还可抑制SARS−CoV−2病毒。用法用量为每次125 mg,每日2次,患者耐受性良好。ISGRO等[33]报道,利尿酸(化合物91)可有效且不可逆地抑制SARS−CoV−2 Mpro。分子对接试验结果表明,利尿酸中的α,β−不饱和酮结构可与Mpro活性部位中的半胱氨酸−145氨基酸残基发生迈克尔反应,形成共价键;羧酸基团可与酪氨酸−54形成氢键。但由于利尿酸的强利尿特性,在治疗COVID−19时需严格控制,防止血栓等不良反应发生。VATANSEVER等[34]发现,钾离子通道开放剂苄普地尔(化合物92)可升高胞内体pH,抑制病毒进入人体细胞,同时抑制Mpro的活性,干扰病毒复制。上述药物化学结构式、用途及作用靶点见图9。

图9 具有抗SARS-CoV-2作用的其他类药物化学结构式、用途及作用靶点Fig.9 Chemical structures,application and action targets of other drugs with anti-SARS-CoV-2 action
4 结语
目前,各种COVID−19疫苗包括灭活型及mRNA型疫苗开始在世界范围内使用。同时,各种病毒中和抗体及嵌合型病毒颗粒等新型疫苗也在紧张地研发中[35]。COVID−19疫苗的应用大大降低了SARS−CoV−2的感染率,但对COVID−19感染患者尚无有效治疗作用。虽然临床应急开发了植物药单独或与中西药联合治疗,以及运用老药新用的策略,但植物药活性较低,有效成分及机制不明确,老药不良反应较多。此外,变异株病毒不断出现,使疫情的控制更加困难。相对于大分子生物药(疫苗)来说,抗CoV小分子药物易于存储,服用方便,成本低,且不良反应少。因此,迫切需要作用机制明确、疗效良好、针对SARS−CoV−2的特效小分子药物。本研究中通过研究病毒结构及复制组装过程中的主要靶点,进一步揭示病毒变异规律,发现变异病毒及野生病毒复制共同作用的靶点。同时,利用现代化人工智能及计算机辅助药物设计技术,结合传统先导化合物优化策略,可加速抗CoV小分子化合物药物的研发。
