HSIL宫颈冷刀锥切术后切缘阳性的临床处理及转归
2022-02-17王武亮王利君
袁 博 王武亮 赵 虎 王利君
随着宫颈癌筛查的普及及大众对宫颈癌疫苗关注度的增高,临床上宫颈的高级别鳞状上皮内病变(high-grade squamous intraepithelial lesion,HSIL)越来越多见。根据美国阴道镜、宫颈病理学会(American Society for Colposcopy and Cervical Pathology,ASCCP)指南的建议:对于宫颈低级别鳞状上皮内病变的患者可以随访观察,而宫颈高级别鳞状上皮内病变的患者可采取手术治疗,一般选择宫颈锥切术,它可在进一步了解病变程度的同时切除现有的病变[1]。但临床上经常遇到锥切术后切缘阳性的患者,部分患者因惧怕疾病进展选择再次行宫颈锥切术或子宫切除术,但往往术后病理无病灶残留。这不禁引起我们思考,HSIL宫颈锥切术后切缘阳性的患者是否需要再次手术?不手术疾病会进展吗?锥切术后病灶残留的高危因素有那些?如何能避免或减少病灶的残留?本研究收集了笔者医院2013年1月~2018年1月5年间因HSIL行宫颈冷刀锥切术后切缘阳性患者的临床资料及术后处理措施,行回顾性分析,以期寻找适合此类患者的临床处理方法。
资料与方法
1.研究对象:收集2013年1月~2018年1月在笔者医院就诊的宫颈高级别鳞状上皮内病变(HSIL)行宫颈冷刀锥切患者的临床资料,共1764例。术前笔者医院患者均经阴道镜活检,结果由两位副高级职称以上病理医师确诊,术前外院病理均经笔者医院病理科会诊确认。其中切缘阳性患者286例,患者平均年龄38.7(23~54)岁,其中切缘为HSIL患者241例,切缘为宫颈浸润癌45例(其中ⅠA1期26例,ⅠA2期15例,ⅠB1期4例,本研究不包括切缘为宫颈浸润癌的患者)。
2.手术方法:术中用卢戈碘稀释1/4浓度,涂抹到宫颈上,宫颈3点、9点处注射垂体后叶素稀释液各3ml(垂体后叶素6U+0.9%NaCl注射液20ml)减少创面出血,使用23号圆手术刀片,沿碘不着色区外缘3~5mm处垂直切入,锥形向下切除,锥高1.5~2.5cm(根据转化区的类型),残余宫颈创面采用Sturmdoff法缝合止血成型。在切下来标本的12点外切缘处缝线标记后甲醛固定,送笔者医院病理科检查。
3.判定切缘阳性及病变残留的标准[2]:切缘阳性:第1次锥切的标本,只要有1处可见病变,或切缘与病变的距离<1mm,无论内切缘还是外切缘,均判定为切缘阳性。病变残留:第2次术后残存宫颈组织中仍有HSIL或浸润癌病灶。患者最终诊断:两次手术术后病理中最高病变级别作为最终诊断。总结患者手术前后的临床资料如标本切缘阳性率及术后随访疾病复发情况。
4.锥切术后切缘阳性的处理:根据患者有无生育要求、年龄、意愿,充分与患者沟通各种处理优缺点及可能风险,患者自愿选择进一步处理方案。包括:①再次宫颈锥切术(术后3个月施术);②全子宫切除(术后1周内施术);③暂不行再次手术,术后密切随访。包括人乳头瘤病毒(human papilloma virus,HPV)及宫颈细胞学(thinprep cytology test,TCT)检查,阴道镜检查,必要时宫颈活检或加做宫颈管搔刮。①②术后每6个月复查TCT、HPV,③术后每4~6个月复查TCT、HPV、阴道镜和(或)ECC。①②③连续2次复查TCT、HPV均为阴性者转常规筛查。随访时间截至到2020年6月,最短30个月,最长90个月。术后复发指术后随访过程因TCT、HPV异常,在阴道镜下活检组织病理提示为HSIL或宫颈浸润癌。
5.统计学方法:采用SPSS 23.0统计学软件对数据进行处理分析,应用Logistics多因素分析回归模型计算影响病灶残留的相关风险因素。标本切缘阳性、切缘类型及手术方式和病灶残留的比较采用χ2检验。不同的临床处理措施与术后疾病复发的比较采用χ2检验,以P<0.05为差异有统计学意义。
结 果
1.HSIL患者宫颈冷刀锥切术后病变残留的危险因素分析:5年间在笔者医院接受宫颈冷刀锥切的宫颈HSIL患者共1764例,患者年龄23~54岁,平均年龄38.7岁。HPV16感染856例,HPV18感染357例,其他高危型别感染551例,混合感染473例。Ⅰ型转化区1023例,Ⅱ型转化区436例,Ⅲ型转化区305例。切缘阳性患者共286例,其中切缘为HSIL的患者241例(84.3%);切缘为宫颈浸润癌的45例(15.7%),切缘阳性率分别为13.7%(241/1764)和2.6%(45/1764);宫颈锥切术后病理升级率为2.6%。为了解二次手术后病变残留患者的年龄、术前HPV感染的类型、切缘是否阳性、阴道镜下转化区的类型对病变残留的影响,通过Logistic多因素分析回归模型分析发现,切缘是否为阳性对病变残留的影响差异有统计学意义(P<0.05);Ⅲ型转化区增加病变残留的风险(P<0.05)。年龄、术前HPV感染的类型不是高危因素,对病变残留影响差异无统计学意义(P>0.05),详见表1。

表1 HSIL宫颈冷刀锥切术后病变残留的危险因素分析
2.宫颈冷刀锥切术后切缘的类型及再次手术的方式与病灶残留的关系: 1764例患者中,切缘为HSIL的患者241例,切缘阴性的患者1478例。其中切缘为HSIL患者中有157例行二次手术(子宫切除90例,再次锥切67例),再次手术后病变残留率为14.0%(22/157),切缘阴性的患者中有165例行子宫切除术,术后病灶残留率为1.8%(3/165), 二者比较差异有统计学意义(χ2=16.706,P<0.001)。切缘为HSIL再次手术的157例患者中,再次宫颈锥切患者术后病灶残留8例,残留率为11.9%(8/67),子宫切除术后病灶残留14例,残留率为15.6%(14/90),二者比较差异无统计学意义(χ2=0.417,P>0.05)。二次手术后病灶残留与切缘类型的关系及切缘阳性的患者再次手术方式与病灶残留的关系详见表2、表3。

表2 二次手术后病灶残留与切缘类型的关系(n)

表3 切缘阳性的患者再次手术方式与病灶残留的关系(n)
3.切缘阳性患者不同处理方式与复发率的关系: 241例切缘为HSIL的患者,90例行全子宫切除,67例行两次宫颈锥切手术。84例切缘为HSIL的患者未行二次手术,行定期随访,每4~6个月复查TCT、HPV、阴道镜及ECC。行二次手术的患者术后每6个月行TCT、HPV,所有患者连续两次复查TCT、HPV均为阴性者转常规筛查。随访时间截止到2020年6月,中位随访时间45个月(最短30个月,最长90个月)。子宫切除组2年内复发率为8.9%(8/90),2年以上复发率15.9%(13/82);再次宫颈锥切手术组2年内复发率为16.4%(11/67),2年以上复发率19.6%(11/56),随访组2年内复发率为19.0%(16/84),2年以上复发率22.1%(15/68),三者比较差异无统计学意义,详见表4。
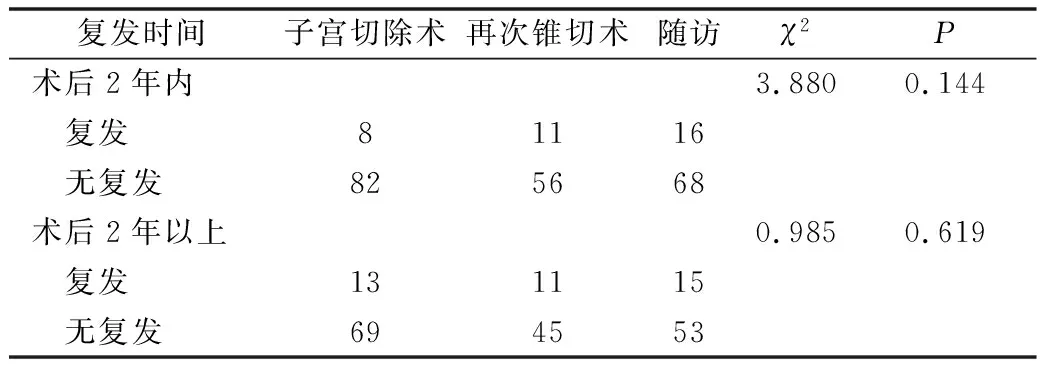
表4 临床不同处理方式与疾病复发的关系(n)
讨 论
1.HSIL患者采取宫颈冷刀锥切治疗时应根据不同转化区采取不同切除范围,力求无病变残留:宫颈病变行宫颈锥切术后切缘阳性是临床工作中经常碰到的情况,有研究显示,HSIL锥切术后切缘阳性率高达23%[3]。本研究中切缘阳性率为16.2%,稍低于文献的报道。切缘阳性与采取的手术方式、转化区类型、病变的程度以及病变的面积等因素有关[4]。大部分的研究表明,切缘阳性是宫颈锥切术后病灶残留的危险因素,与本研究结果一致。HSIL锥切后切缘阳性的残留率明显高于切缘阴性者,但因宫颈病灶呈分布跳跃性,即使切缘阴性,也不能完全排除病灶残留的可能[5,6]。本研究得出另一结论,Ⅲ型转化区也是宫颈冷刀锥切术后病灶残留的危险因素,考虑可能与转化区内移手术切除范围不足有关。因此,HSIL患者采取宫颈冷刀锥切治疗时应根据不同转化区采取不同切除范围,力求无病变残留。
2.锥切术后切缘阳性再次手术方式与病变残留的关系: 钱晓月等[7]研究发现,锥切术后切缘病变程度越重, 残留病变率也随之升高。本研究结果表明,宫颈锥切切缘阳性的患者二次手术后病灶残留率为10.4%,明显高于切缘阴性的患者(1.8%),差异有统计学意义。因此本研究认为应区别对待其后续随访、治疗。有文献报道,对于年龄≥50岁、锥切后内切缘为阳性、阴道镜下评估不满意、病变累及多个象限的患者,临床推荐再次手术治疗,手术即可再次行诊断性宫颈锥切术,或治疗后残存宫颈组织较小而再次锥切困难时也可行子宫切除术,以降低术后病变残留的可能[8]。本研究结果显示,二次手术的具体手术方式与病灶残留多少无关,子宫切除术较宫颈锥切术术后观察到切除手术标本病灶残留率无明显差别。因此,对于有生育要求或年轻的患者,沟通后如要求再次手术的应选择创伤小的宫颈锥切术。对于无生育要求、年龄≥50岁、再次锥切术难以实施的患者也可考虑行子宫切除术,可减少一部分患者随访过程中的心理负担,并避免日后子宫上各种病变的发生。
3.年轻或有生育要求的患者锥切术后切缘阳性一定要再次手术吗?陈忆等[9,10]研究发现,HSIL宫颈锥切后切缘阳性和病灶残留的患者更容易出现疾病的复发和进展,因此术后应加强随访。有文献报道,HSIL患者宫颈锥切后疾病的复发和进展多数发生在治疗后的2年内,与HPV持续感染有关[11~13]。本研究得出结论,子宫切除组2年内复发率为8.9%,2年以上复发率为15.9%;再次宫颈锥切手术组2年内复发率为16.4%,2年以上复发率为19.6%,随访组2年内复发率为19.0%,2年以上复发率为22.1%,三者比较差异无统计学意义。说明锥切术后切缘阳性的患者再次复发与采取的进一步处理措施无明显关系,且子宫切除与再次锥切病变残留率比较差异无统计学意义,对于切缘阳性的患者可以采取更为微创的治疗措施或者对于有生育要求的患者可密切随访。特别是针对年轻和(或)有生育要求的患者,可充分沟通后采取随访观察,避免或减少再次锥切或子宫切除给患者造成后续对生育及心理的影响。有研究者建议对于宫颈锥切术后切缘阳性的患者术后4~6个月可重复TCT及ECC的联合检查,如组织病理学诊断为疾病复发,可采用重复的诊断性锥切术或全子宫切除术[14,15]。子宫锥切术后HPV阳性规范化管理专家共识也指出,对于宫颈锥切术后HPV阳性的患者,首先要了解残留宫颈是否有病变及病变的部位及性状,采用再次宫颈锥切或子宫切除术并不是最佳选择[16]。宫颈锥切术后再次行HPV或HPV、TCT联合筛查的时间为术后6个月,术后经充分评估,当组织学确诊为复发或持续性的宫颈鳞状上皮高级别病变时,可考虑再次手术。
综上所述,宫颈锥切术后切缘阳性再次手术后病灶残留率低,并且随访再次手术患者短期、长期复发结局无明显差别。因此,对于HSIL宫颈冷刀锥切术后切缘阳性的患者决定是否需要再次手术,应根据病理类型、年龄、有无生育要求等因素谨慎决策。
