JMJD3和CD163在乳腺癌中的表达及其临床意义
2022-02-17吕珊妹董学君
吕 娟 吕珊妹 董学君
乳腺癌的发生率在女性恶性肿瘤中居首位,是女性癌症死亡的主要原因[1]。尽管现有的筛查方法和治疗手段已显著改善了乳腺癌的预后,但仍有众多患者死于耐药和转移[2]。因此,寻找乳腺癌发生、发展的机制和根源,确定新的治疗靶点,寻求新的干预策略对于提高乳腺癌的疗效和预后具有重要意义。巨噬细胞来源于血液循环系统中的单核细胞,在不同的环境或信号刺激下发生不同性质的活化,产生两种不同的类型,包括经典活化的巨噬细胞(M1型巨噬细胞)和替代活化的巨噬细胞(M2型巨噬细胞)。肿瘤组织中的巨噬细胞(tumor-associated macrophages,TAMs)主要为M2型巨噬细胞,TAMs在乳腺癌组织中占间质细胞的50%~80%,乳腺癌的不良预后与TAMs的浸润密切相关[3]。CD163常作为M2巨噬细胞的标志物。JMJD3(jumonji domain-containing protein 3)是含JmjC结构域组蛋白去甲基化酶家族成员之一,它可以特征性地降低组蛋白H3K27me2(dimethylation of histone H3 lysine 27)和H3K27me3(trimethylation of histone H3 lysine 27)的甲基化水平,从而上调基因的表达,在细胞的分化、衰老、胚胎发育及肿瘤发生、发展等生理活动中有着重要的作用[4]。JMJD3在乳腺癌中的表达,以及JMJD3与M2型巨噬细胞之间的关系,目前报道较少。本研究收集了47例乳腺癌组织标本,利用免疫组化法检测了乳腺癌组织中JMJD3和CD163的表达,并分析了其与乳腺癌临床病理特征的相关性,以丰富对乳腺癌发生、发展机制的认识。
对象与方法
1.病例资料:收集绍兴市人民医院2015年1月~2016年12月收治的乳腺癌术后癌组织和癌旁组织石蜡标本47对,并收集相关临床资料,所有标本均经知情同意,并经笔者医院医学伦理学委员会审核。患者术前均未接受化疗或放疗。按照2012年WHO乳腺癌组织病理分级分类法对其进行分组。所有标本均经绍兴市人民医院病理科确诊。
2.主要试剂:anti-JMJD3兔抗人多克隆抗体(ab38113)、anti-CD163兔抗人单克隆抗体(ab182422)购自英国Abcam公司。二抗及二氨基联苯胺(DAB)显色试剂盒购自北京索莱宝科技有限公司。
3.免疫组织化学染色:主要步骤如下:石蜡标本经切片、烤片、脱蜡和水化;封闭内源性过氧化物酶;柠檬酸钠溶液煮沸,进行抗原修复暴露抗原决定簇;5%羊血清室温30min,封闭非特异性蛋白;一抗37℃孵育2h;二抗孵育30min;DAB显色3~10min;苏木精复染1~2min;脱水,中性树脂封片。
4.免疫组化结果判断:JMJD3的阳性信号为棕褐色颗粒状,主要位于乳腺癌组织的细胞核内。JMJD3结果判定:①依据标本的染色程度:阴性0分,淡黄色1分,浅褐色2分,深褐色3分;②依据阳性细胞数量:阳性细胞总数在0~25%为1分,26%~50%为2分,51%~75%为3分,76%~100%为4分。两者相加,总分在1~3分为低表达组,4~7分为高表达组。CD163在组织切片中定位于巨噬细胞的细胞膜,胞质也有着色,阳性细胞呈巢状分布于乳腺癌癌间质,亦有呈星形散在浸润于乳腺癌癌巢。CD163结果判定:首先在低倍镜下选取视野中巨噬细胞最密集的5个区域,在高倍镜下(×400)计数,最后取5个视野总和的平均值进行统计。
5.统计学方法:采用SPSS 21.0统计学软件对数据进行统计分析,JMJD3在乳腺癌中的表达与病理特征之间的关系采用χ2检验,CD163在乳腺癌中的表达与病理特征之间的关系采用t检验,CD163与JMJD3之间的相关性分析采用Spearman相关性分析,以P<0.05为差异有统计学意义。
结 果
1.乳腺癌组织中JMJD3与CD163的表达:JMJD3主要在乳腺癌组织中表达,主要定位于细胞核,在乳腺癌组织中呈棕褐色,在乳腺癌中的阳性表达率明显高于癌旁组织,差异有统计学意义(P=0.000),详见图1。CD163主要定位于乳腺癌组织间隙,呈巢状分布,亦有星形散在浸润于乳腺癌癌巢组织,在乳腺癌中的阳性表达数102.6±52.3,明显高于癌旁组织29.7±9.6,差异有统计学意义(P=0.000),详见图1。

图1 免疫组化检测JMJD3和CD163在乳腺癌及癌旁组织中的表达情况(免疫组化,×400)
2.JMJD3和CD163与乳腺癌临床病理特征之间的关系:在乳腺癌组织中,JMJD3与乳腺癌的TNM分期呈正相关,TNM分期越高,JMJD3的表达量越高(P=0.012);JMJD3表达量与雌激素受体(estrogen receptor, ER)(P=0.032)、孕激素受体(progesterone receptor, PR)(P=0.005)表达有关,ER、PR表达阴性的患者,JMJD3的表达更高;JMJD3的表达与淋巴结转移有关,发生淋巴结转移的患者JMJD3表达更高(P=0.000),详见表1。在乳腺癌组织中,CD163的表达与TNM呈正相关(P=0.014),与PR阴性表达有关(P=0.001),并且与淋巴结转移有关(P=0.001),详见表1。
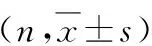
表1 乳腺癌组织JMJD3和CD163表达与肿瘤特征的关系
3.乳腺癌中JMJD3与CD163的相关性分析:采用Spearman相关性分析显示,乳腺癌组织中JMJD3的表达与CD163的表达呈正相关(r=0.635,P=0.000)。
讨 论
JMJD3在肿瘤中发挥抑癌或者致癌的双重作用[4~6]。JMJD3在淋巴瘤、肝癌、肾癌、宫颈癌等恶性肿瘤中高表达,并通过促进肿瘤的增殖、转移、抗凋亡及调控肿瘤微环境发挥促进肿瘤发展的作用;在结肠癌、肺癌及神经胶质瘤中表达水平较低,能够促进干细胞的分化和细胞凋亡,发挥抑制肿瘤发展的作用。在胶质瘤的研究中发现,JMJD3可增加SNAI1的表达,促进胶质瘤的迁移和侵袭[7]。JMJD3在肺癌中表达显著上升,并且在Ras激活的肺癌细胞中促进TGF介导的Smad激活和EMT[8]。IFN/STAT1/JMJD3轴可诱导ZEB1的表达,并增强肺癌的侵袭能力[9]。利用JMJD3的抑制剂GSK-J1作用于头颈部鳞状细胞癌细胞,可使细胞增殖受抑制,并诱导细胞凋亡[10]。JMJD3在弥漫大B细胞淋巴瘤的组织和细胞系中表达升高,并可激活NF-κB通路、上调BCL2表达而抗凋亡[11]。抑制JMJD3可减少肿瘤细胞的增殖并促进细胞凋亡,抑制肿瘤干细胞的分化[12]。本研究发现,JMJD3在乳腺癌组织中的表达显著高于癌旁组织,其表达与乳腺癌的TNM分期、ER、PR及淋巴结转移有关:TNM分期越高,JMJD3的表达越高;ER和PR表达阴性的患者,JMJD3的表达更高;有淋巴结转移的患者乳腺癌组织中JMJD3的表达明显升高,这些结果提示JMJD3的表达可能与乳腺癌的进展和不良预后相关。
乳腺癌的不良预后与TAMs的浸润密切相关。在一项纳入4541例乳腺癌患者的Meta分析中发现,TAMs高密度浸润与乳腺癌患者低生存率有关[13]。
使用纳米颗粒双重抑制集落刺激因子1受体(CSF1R)和MAPK途径可诱导TAMs向M1型极化,抑制乳腺肿瘤的生长[14];载有CSF1R和SHP2(src homology region 2 domain phosphatases-2)抑制剂的纳米颗粒靶向M2型巨噬细胞,可将M2巨噬细胞复极化为M1表型,表现更强的细胞毒活性和吞噬作用,在乳腺癌小鼠模型中显示出更强的抗肿瘤功效[15]。Chen等[16]利用质谱分析发现,M2型巨噬细胞分泌的CHI3L1在体内外均促进乳腺癌细胞的转移。CD163是目前公认的M2型巨噬细胞表面标志物之一,本研究在乳腺癌中检测CD163的表达结果发现,CD163在乳腺癌组织中的表达显著高于癌旁组织,其表达与TNM分期、PR阴性及淋巴结转移有关,提示乳腺癌组织中有大量的M2巨噬细胞浸润,并且其表达可能与乳腺癌的不良预后有关。采用Spearman相关性分析发现,乳腺癌组织中JMJD3的表达与CD163的表达呈显著正相关,推测M2型巨噬细胞可能促进乳腺癌中JMJD3的表达,进而促进乳腺癌的发展和不良预后。
综上所述,本研究发现,JMJD3在乳腺癌组织中表达上调,CD163在乳腺癌间质中表达明显升高,两者表达呈显著的正相关,且两者表达均与乳腺癌的TNM分期、PR阴性及淋巴结转移有关。M2型巨噬细胞可能通过促进乳腺癌中JMJD3的表达,调控乳腺癌的发展,导致乳腺癌的不良预后,具体机制有待于后续开展更深入的研究。
