1例部分D表型献血者RhD抗原表位及分子机制研究*
2022-02-17李明浩杨佳璇李艾静朱自严叶璐夷
李明浩 杨佳璇 李艾静 朱自严 叶璐夷
RH血型系统的D抗原是免疫原性最强、最具多态性、最复杂的红细胞血型抗原之一,在临床输血中具有重要的临床意义。D抗原由RHD基因编码的RhD蛋白携带,单克隆抗体已确定至少有30种抗原表位[1]。RhD蛋白由位于1号染色体短臂的RHD基因编码,其跨红细胞膜12次,N末端和C末端位于膜内并形成6个膜外结构域[2]。
除常见的D阳性和D阴性表型外,还存在D变异型,包括弱D、部分D和DEL等。通常认为,弱D表型表现为D抗原表达的减弱,部分D表型表现为D抗原表位的改变。但是两者的界限并不明确,仅利用血清学无法区分,目前基因测序是鉴定D变异型较好的方法。RHD-CE-D基因融合、胞外环单个氨基酸或多个氨基酸位点突变[3]都会导致D抗原表位缺失或影响胞外环的3D构象,表现为部分D。部分D表型个体因缺失了某些D抗原表位,在接受正常RhD阳性血液时可产生针对所缺表位的抗体,继而导致严重的输血反应;而部分D表型献血者的血液制品输注给D阴性个体也有一定的几率产生抗-D抗体。因此,部分D表型新RHD基因突变的发现对于预测输血或妊娠中抗-D同种异体免疫的潜在风险有重要的意义。
我们通过对1例D变异型献血者样本开展血清学及基因水平研究,发现其RHD基因存在c.492C>G位点突变,从而导致RhD蛋白第3个胞外环编码氨基酸天冬氨酸被谷氨酸替代,表现为部分D表型。该突变类型目前国际上仅发现1例,国内属首次报道。对于RHD基因合子型的检测,过去曾报道过的方法包括传统的RFLP-PCR[4],实时定量PCR[5]以及最新的定量技术数字PCR[6]等。本研究采用最近发展起来的数字PCR技术应用于RHD基因合子型的检测,相对于实时定量PCR方法提高了精确度。
材料与方法
1 标本来源 血液样本来自1例上海市血液中心无偿献血者,初筛为RhD阴性,ABO血型为A。随机已知RHD基因型DNA样本来自本实验室保存。该样本相关项目已通过上海市血液中心医学伦理审查委员会审批(编号:SBC-IRB-2019-19)。
2 方法
2.1 检测试剂:单克隆IgM/IgG抗-D 试剂(均购自上海血液生物医药公司;IgM抗-D,克隆号Rum-1;IgG抗-D,克隆号MS-26);IgG抗-D为2种不同来源的多克隆人源抗-D血清;单克隆IgM抗-C、抗-c、抗-E、抗-e(均购自上海血液生物医药公司;抗-C,克隆号MS-24;抗-c,克隆号MS-33;抗-E,克隆号MS-80+258;抗-e,克隆号MS-16+21+63);血液基因组DNA提取试剂盒(购自天根生化科技有限公司;货号DP304);抗原表位检测试剂盒(D-screen,Diagast,法国,克隆号P3×P3×61+21223B10+P3+P3×290×35);实时定量PCR扩增预混液(购自翌圣生物科技(上海)股份有限公司;货号11184ES08);数字PCR相关试剂(购自伯乐生命医学产品(上海)有限公司;货号1863023)。
2.2 血清学检测:对该样本采用试管法进行CE分型、Rh阴性确认和D抗原表位检测。按照D-screen试剂盒说明书方法检测样本的D抗原表位。
2.3RHD基因测序:根据天根生物血液基因组DNA提取试剂盒说明书提取外周血白膜细胞的基因组DNA。根据参考文献[7-8]中的引物及扩增方法,对RHD基因1号至10号外显子,包括相邻的侧翼内含子区域,进行PCR扩增并送测。PCR扩增仪为ABI Veriti。引物合成及测序均送至上海生工生物完成。
2.4RHD杂合性分析:采用伯乐生物数字PCR探针法试剂盒,严格按照说明书将探针法预混反应液、DNA模板、引物及探针配置成20 μL的PCR反应体系,并利用微滴生成仪(伯乐,QX200)将混合的PCR反应液分散成微滴,每个微滴作为单独体系进行PCR扩增,并利用微滴读取仪(伯乐,QX200)逐滴读取,实现对目标基因的绝对定量。PCR扩增反应程序为:预变性95℃ 10 min;变性94℃ 30 s,退火延伸60℃ 1 min,共40个循环;酶灭活98℃ 10 min。严格按照扩增方法检测RHD基因的5号、7号外显子并将β-ACTIN作为内参基因,PCR扩增引物及探针根据参考文献设计[9-10]。采用数字PCR方法分析该新突变样本的RHD杂合型。同时对26例随机已知基因型样本分别通过数字PCR和实时定量PCR方法扩增RHD基因5、7号外显子及β-ACTIN基因,并比较合子型的准确性及结果的离散程度。实时定量PCR仪器为罗氏LightCycler480Ⅱ,严格按照扩增方法检测RHD基因的5号、7号外显子及内参基因β-ACTIN,扩增引物根据参考文献设计[9-11],反应程序为:预变性95℃ 5 min;变性95℃10 s,退火延伸60℃ 30 s,共40个循环。
2.5 蛋白3D模型的建立:利用Robetta同源建模网站(http://www.robetta.org/),将部分D型和野生型RhD蛋白的氨基酸序列导入网站,分别构建部分D型和野生型RhD蛋白3D构象模型。
结 果
1 血清学结果 本研究的该名献血者样本在Rh阴性确认实验中与单克隆IgM抗-D抗体反应为阴性,与1种单克隆抗-D抗体、2种多克隆抗-D抗体反应均为3+。CE分型为CcEe,详见表1。
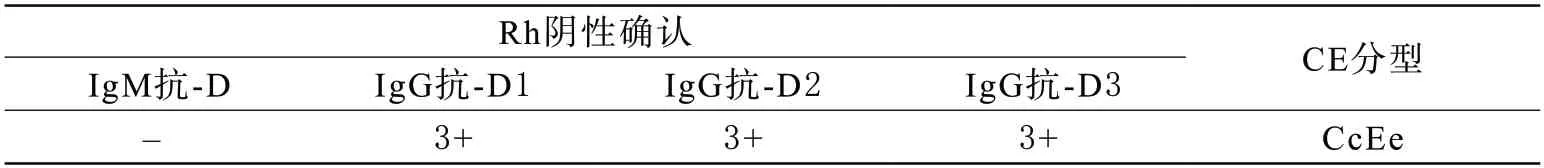
表1 样本血清学分型
2 RhD抗原表位分析 使用D-Screen试剂盒分析该样本D抗原表位分布,样本红细胞与针对D抗原的epD9.1、epD5.4、epD2.1和epD3.1表位的单克隆抗-D反应呈阳性(分别为2+s、2+、2+和3+),与其他单克隆抗-D反应均为阴性,表现为部分D表型,结果见表2。
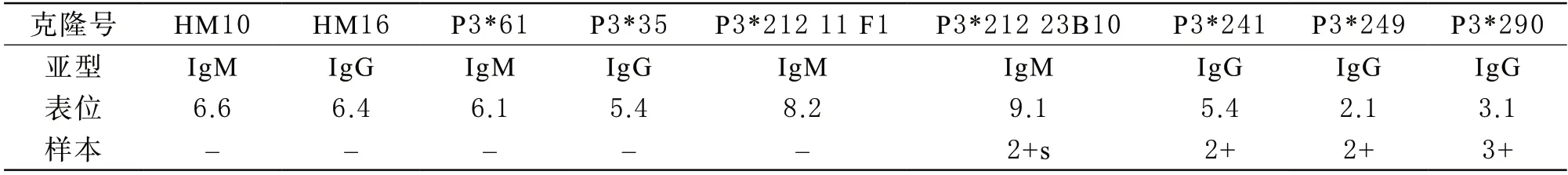
表2 D抗原表位检测
3 Sanger测序分析 对该个体RHD基因1号至10号外显子及相邻侧翼内含子区域扩增并测序。测序结果显示RHD基因第4号外显子存在c.492C>G突变,测序结果见图1。该突变导致RhD蛋白第3个胞外环上164位氨基酸天冬氨酸被谷氨酸替换(p.Asp164Glu)[12]。4 构建数字PCR检测RHD基因型的方法 利用数字PCR和实时定量PCR分别对随机RHD纯合、杂合样本检测RHD基因5、7号外显子及内参基因β-ACTIN的相对表达。
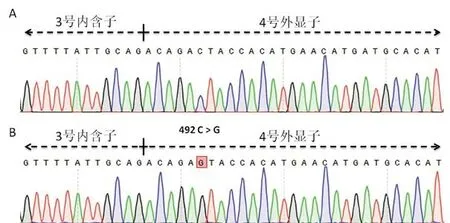
图1 RHD基因测序结果
实时定量PCR检测RHD基因的相对表达,其中12个纯合样本相对值在0.7~1.5之间,14个杂合样本在0.2~0.8之间。数字PCR方法检测RHD基因拷贝数,相对于内参基因β-ACTIN,12个纯合样本得到的比值范围是0.9~1.1,14个杂合样本则为0.46~0.56。其中数字PCR的结果为RHD/β-ACTIN(FAM/HEX)拷贝数的比例,实时定量PCR为2-△△CT的结果。详见图2。
对实时定量PCR和数字PCR的统计结果进行差异显著性分析。统计结果显示,相比于实时定量PCR,数字PCR同组样本间的重复性较好,结果更稳定,纯合组和杂合组数据的差异显著,详见图2A-D。同时分析几组数据的变异系数(CV),发现数字PCR结果的CV值明显低于实时定量PCR,提示数字PCR可以更精准、稳定地进行RHD基因杂合性分析,结果见图2E。
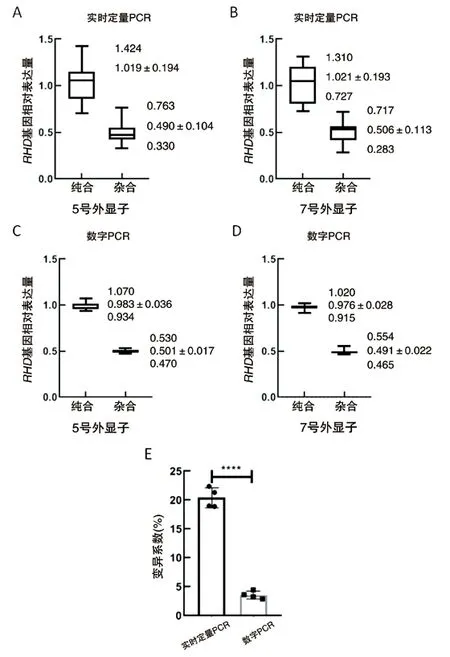
图2 实时定量PCR与数字PCR检测RHD基因相对表达及统计学分析
5RHD杂合性分析 利用数字PCR检测该例D变异型样本RHD基因5、7号外显子DNA水平的表达,结果显示RHD基因5、7号外显子的拷贝数约为内参基因β-ACTIN的一半,提示该样本RHD基因型为杂合,结果见图3和表3。
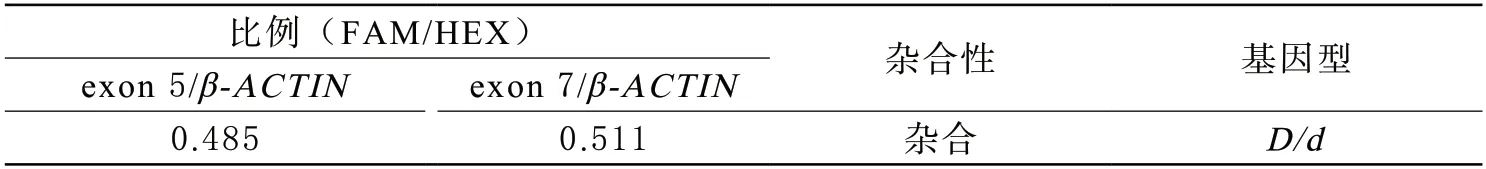
表3 数字PCR检测RHD杂合性
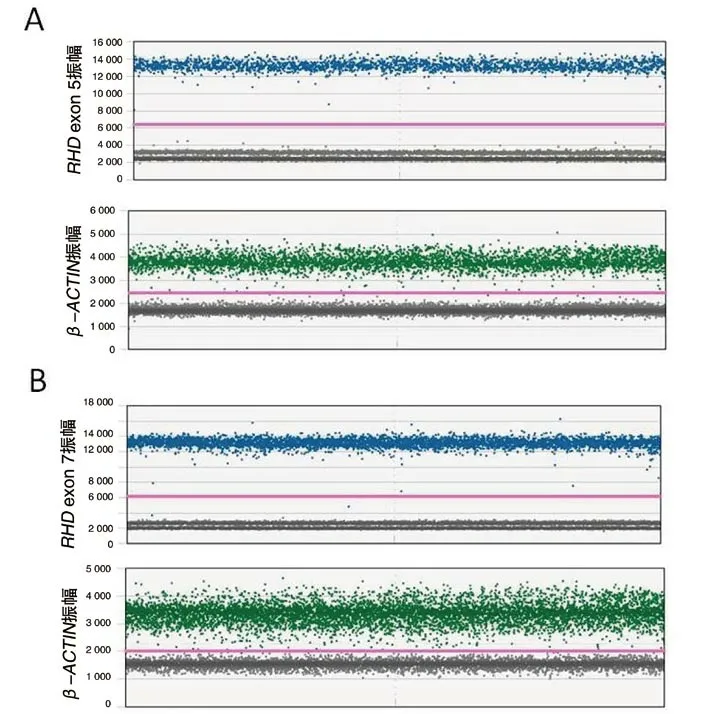
图3 数字PCR检测RHD基因的相对表达
6 RhD抗原蛋白建模 从3D结构模型可以看出,部分D型与野生型RhD蛋白在第3个胞外环存在螺旋构象的改变,提示p.Asp164Glu突变影响了蛋白的螺旋结构,可能导致D抗原epD6.6、epD6.4、epD6.1、epD5.4和epD8.2表位的缺失,结果见图4。
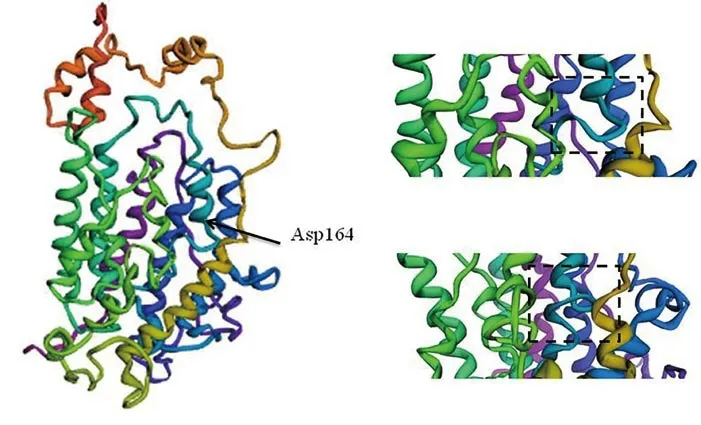
图4 野生型及突变型RhD蛋白的3D结构比较
讨 论
RhD蛋白编码基因RHD突变导致其胞外环改变是产生部分D表型的主要原因。目前已经发现超过80种部分D等位基因,大部分来自欧洲及非洲血统[13]。曾有研究显示,中国人群中部分D的占比约为0.003%[14],是稀有的血型。
本研究中的样本来自1名无偿志愿献血者,初筛为RhD阴性,D阴性确认结果为D变异型。利用Sanger测序检测发现其RHD基因4号外显子存在c.492C>G突变,为错义突变,编码氨基酸天冬氨酸被谷氨酸替换。天冬氨酸和谷氨酸均为酸性氨基酸,但等电点略有差异,这种突变是否影响对应抗原表达,还需要进一步研究证实。
本研究为国内首次上报该位点突变部分D表型的血清学结果。针对RHD*492G位点突变目前国际上仅澳大利亚研究人员报道过1例个体。LOPEZ[15]等人通过测序及抗原表位分析,2017年首次上报基因库,登录序列号为KY614793,但已报道的携带RHD*492G位点突变的1例部分D个体表型与本例突变样本缺失的抗原表位不同,样本红细胞与针对D抗原的epD8.1、epD5.1、epD6.3、epD1.1、epD4.1、epD9.1、epD6.6和epD6.3表位的单克隆抗-D反应呈强阳性4+,epD3.1、epD1.2表位的单克隆抗-D反应呈阳性(分别为3+和2+),仅epD1.2表位单克隆抗-D反应为阴性。抗原表位缺失差异的原因尚不明确,但因两例个体的人群背景不同,提示可能存在个体差异。同时,已报道样本CE分型为Ccee,而本研究为CcEe,是否有关需进一步研究。此外,荷兰研究人员STEGMANN等人报道过1例c.492C>A的错义突变(RHD*61)[12],RHD*61位点突变虽然也会导致编码氨基酸天冬氨酸被谷氨酸替代,导致部分D表型,但其与本例及已报道RHD*492G位点突变的血清学结果不同。该研究报道的抗原表位,除D抗原epD5、epD8.2表位缺失外,样本红细胞与针对D抗原的epD1、epD2、epD3、epD6、epD7、epD8和epD9表位的单克隆抗-D反应均呈强阳性或阳性(4+或3+),与针对D抗原的多克隆抗-D反应呈阳性(3+)。
实时定量PCR[16]和数字PCR[6]技术均可用于RHD基因型检测,本课题组曾采用实时定量PCR检测RHD基因合子型用以补充RFLP方法可能产生的误判[17]。数字PCR是基因表达的定量检测技术,近年发展起来用于检测RHD基因合子型,其相对于实时定量PCR,可以更准确地进行基因分型。本研究中利用数字PCR和实时定量PCR技术对随机样本的合子型进行分析比较。RHD基因与内参基因β-ACTIN相对定量结果显示,数字PCR技术在灵敏度和基因分型的准确性上更具优势。此外,组内数据的离散程度显示,变异系数(CV值)在数字PCR得到的结果中显著低于实时定量PCR,说明其结果重现性更高、更稳定、更精确,可以大大地降低因结果离散导致的误判。通过数字PCR技术,进一步分析该个体RHD基因合子型,确认其基因型为杂合RHD基因,提示RHD基因的1条等位基因携带c.492C>G突变,1条等位基因缺失。
本研究的不足之处在于,由于该例携带新突变的部分D个体为献血者,缺乏D抗原同种免疫相关的临床证据,因此其临床意义还需进一步探讨。同时,本研究与国外报道均显示该突变虽然导致D抗原表位的部分缺失,但D抗原强度较强。如采用的单克隆抗-D鉴定试剂不当,误判为D阴性并输注给阴性受血者,可能会产生同种抗体,继而引起溶血性输血反应。
综上所述,本研究发现1例部分D表型献血者其RHD等位基因为国内首次报道,并分析其D抗原表位及表型产生可能的分子机制。部分D个体存在抗-D同种异体免疫的高风险[18],因此,准确鉴定基因型可为其输血安全提供准确的依据。
利益冲突所有作者均声明不存在利益冲突
