mTOR/P70S6K/HIF-1α信号通路在脂多糖诱导Caco-2细胞屏障损伤中的作用及机制*
2022-02-16姚刘旭滕文彬黄素琴李玉红蒋宗明
姚刘旭, 滕文彬, 黄素琴, 李玉红△, 蒋宗明
[1绍兴文理学院医学院,浙江 绍兴 312000;2浙江大学医学院附属第一医院麻醉科,浙江 杭州 310000;3树人大学树兰国际医学院附属树兰(杭州)医院麻醉科,浙江 杭州 310004;4绍兴文理学院医学院附属第一医院麻醉科(绍兴市人民医院),浙江 绍兴 312000]
肠上皮细胞及其相邻的紧密连接结构(tight con‑junctions,TJs)是肠黏膜屏障的重要组成部分,参与机体营养物质的吸收、防止肠道微生物侵袭及肠黏膜损伤后修复。研究表明,生理情况下,肠上皮细胞处于“生理性低氧”环境中,肠上皮细胞可以适应缺氧,低氧环境是肠道共生菌生存的物质基础,能促进肠道物质运输[1];病理情况下,血流微小波动会导致氧输送较大幅度的下降,导致肠黏膜缺血/缺氧;脓毒症时,炎症反应导致组织代谢旺盛,氧耗增加,肠黏膜血管收缩,黏膜通透性增加[2-3],氧供降低,肠上皮细胞缺氧程度加重[4]。缺氧诱导因子1α(hypoxiainducible factor-1α,HIF-1α)是人体适应低氧环境的关键转录因子,在脓毒症的发展过程中发挥着重要的作用[5]。HIF-1α 由氧依赖的α 亚基和持续性表达的β亚基组成[6],主要在急性缺氧反应中发挥关键作用[7]。我们最近研究发现脓毒症大鼠肠黏膜HIF-1α表达上调,给予HIF-1α 激活剂二甲氧基丙烯酰甘氨酸(dimethyloxalylglycine,DMOG)能抑制脓毒症引起的炎症反应和氧化应激水平,增加抗氧化物质水平,缓解肠黏膜屏障损伤;而给予HIF-1α 抑制剂Bay87-2243 干预,作用则与其激活剂相反。结果提示HIF-1α 对脓毒症时期的肠黏膜具有保护作用[3]。哺乳动物雷帕霉素靶蛋白/p70 核糖体蛋白S6 激酶(mamma‑lian target of rapamycin kinase/ribosomal protein S6 ki‑nase,mTOR/P70S6K)信号通路是HIF-1α上游调节信号,是代谢中关键通路,在能量调节的过程中发挥着重要的作用[8]。研究表明,激活mTOR 信号通路能够上调HIF-1α 的表达,增加糖酵解导致代谢重编程,激活“训练免疫”,从而改善炎症,而抑制mTOR 信号通路则具有相反的作用[9]。脓毒症肠道上皮损伤中mTOR/P70S6K 信号通路是否调节HIF-1α 的表达仍有待进一步研究。
本研究分为两部分,第一部分:采用脂多糖(li‑popolysaccharide,LPS)刺激诱导人结肠上皮细胞株Caco-2 模拟脓毒症肠黏膜屏障损伤体外模型,观察HIF-1α 激活剂和抑制剂对肠黏膜屏障功能的影响,探讨HIF-1α 表达是否对肠黏膜屏障功能具有保护作用;第二部分:观察mTOR 激活剂和抑制剂对HIF-1α 表达、肠黏膜屏障功能的影响,探讨HIF-1α 表达是否受mTOR/P70S6K信号通路的调控。
材料和方法
1 主要材料与试剂
人结肠癌Caco-2 细胞株(中国科学院上海细胞库);荧光素标记的右旋糖酐(fluorescein isothiocya‑nate-dextran,FD4)、脂 多 糖(lipopolysaccharides,LPS)购自Sigma;兔抗大鼠ZO-1、HIF-1α 和occludin多克隆抗体(Invitrogen);claudin-1 和β -actin(Ab‑cam);mTOR、p-mTOR、P70S6K 和p-P70S6K 多克隆抗体(Cell Signaling Technology);辣根过氧化物酶标记的山羊抗兔抗体(Jackson ImmunoReserech);DMOG、BAY87-2243、雷帕霉素(rapamycin,Rapa)和MHY1486 等(MedChemExpress);胎牛血清、MEM 培养液、青霉素/链霉素、谷丙二肽、丙酮酸钠、非必须氨基酸以及0.25% 胰蛋白酶-乙二胺四乙酸(ethyl‑ene diamine tetraaceticacid,EDTA)均购自Gibco。
2 实验方法
2.1 细胞培养人结肠癌细胞株Caco-2 经细胞复苏后,用含10% 胎牛血清、青霉素和链霉素(100×)、1% 丙酮酸钠、1% 谷氨酰胺和1% 非必需氨基酸的MEM 培养液培养Caco-2 细胞。细胞在5% CO2环境中37 ℃孵育。每隔2 天更换1 次培养液。将对数期分化良好的Caco-2 细胞按2×108/L 的密度接种于24孔聚酯膜中,每孔400 μL,于基底侧加入600 μL 培养液。接种24 h 后换液培养。接下来一周隔天换液,一周后每天换液,定期观察细胞生长情况,每日用Millicell ERS-2 Epithelial Volt-Ohm Meter电阻仪测定跨上皮细胞电阻(trans-epithelial electrical resis‑tance,TEER)值。培养约21 d,待细胞形成完整致密单层,TEER 值显著升高且保持稳定,表明模型基本形成。实验中,LPS、DMOG、BAY87-2243、Rapa 以及MHY1487等均溶于细胞培养液中。
2.2 Caco-2 损伤模型建立及实验分组实验分两部分,第一部分细胞分组:对照(control,Ctrl)组、细胞屏障损伤模型组(LPS组)、LPS+DMOG(HIF-1α 激活剂)组和LPS+BAY87-2243(HIF-1α 抑制剂)组;第二部分细胞分组:Ctrl 组、LPS 组、LPS+Rapa(mTOR 抑制剂)组;LPS+MHY1487(mTOR 激活剂)组;LPS+Rapa+DMOG 组和LPS+MHY1487+BAY87-2243 组。对照组用细胞普通培养液培养;LPS 组细胞给予500 mg/L LPS 刺激构建细胞屏障损伤模型;LPS+DMOG组细胞在LPS 基础上给予10 μmol/L HIF-1α 激活剂DMOG;LPS+BAY87-2243 组细胞在LPS 基础上给予10 μmol/L HIF-1α 抑制剂BAY87-2243;LPS+Rapa 组细胞在LPS基础上给予10 nmol/L mTOR 抑制剂rapa‑mycin;LPS+MHY1487 组细胞在LPS 基础上给予100 nmol/L mTOR 激活剂MHY1487;LPS+Rapa+DMOG 组细胞在LPS、Rapa 基础 上 给 予10 μmol/L DMOG;LPS+MHY1487+BAY87-2243 组细胞在LPS、MHY1487L 基础上给予10 μmol/L BAY87-2243。所有组处理溶剂中均含有0.1% 的二甲基亚砜(di‑methylsulfoxide,DMSO)。
2.3 单层屏障跨膜TEER 测定电极放入70% 乙醇浸泡15 min,取出风干15 s,然后放入37 ℃的Hanks 平衡盐缓冲溶液(hank's balanced salt solu‑tion,HBSS)溶液中平衡15 min。移走培养板中的培养基,在上室侧每孔加400 μL 预热的HBSS,基底侧每孔加600 μL,37 ℃培育箱平衡30 min,同时洗去细胞表面的杂质,移走HBSS,重新加入预热的HBSS,测定跨膜电阻值,用1 个空白载体重复上述步骤以获得空白值。
TEER(Ω·cm2)=(测定电阻值-空白值)×单层表面积。
2.4 异硫氰酸荧光素右旋糖酐渗透率检测细胞分组处理后,去除培养基,避光条件下,上室加入400 μL 含有1 g/L 荧光素标记的右旋糖酐的HBSS 溶液[10],37 ℃、5% CO2条件下培养2 h 后,取基底侧溶液100 μL,使用荧光酶标仪测定(激发波长490 nm,发射波长530 nm)。绘制浓度标准曲线,并根据标准曲线计算样品浓度。
2.5 Western blot 检测TJs 相关蛋白和HIF-1α 蛋白表达按预定实验方案处理各实验组细胞完毕后,将细胞用冷PBS 洗涤两次,加入含苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)的蛋白RIPA裂解液,冰上裂解30 min,12 000 ×g离心15 min 后取上清。经BCA 方法定量后,取40 g 总蛋白与等体积2×上样缓冲液混合,100 ℃煮沸3~5 min变性,上样于6%~10% 十二烷基磺酸钠(sodium dodecyl sulfate,SDS)-聚丙烯酰胺凝胶上电泳。常规转膜,用含5%牛血清白蛋白(bovine serum albumin,BSA)的TBST(TBS+Tween)缓冲液室温封闭2 h。TBST 洗涤3 次,每次5 min。加入抗HIF-1α(1∶1000)、抗ZO-1(1∶1000)、抗occludin(1:1000)、抗claudin-1(1∶1000)、抗β-actin(1∶2 000)、抗p-mTOR(1∶1 000)、抗mTOR(1∶1 000)、抗p-P70S6K(1∶1 000)、抗P70S6K(1∶1 000)、抗GAPDH(1∶1 000),4 ℃孵育过夜。 经TBST 充分洗涤,加入辣根过氧化物酶标记的山羊抗兔抗体室温反应2 h,TBST 洗涤3 次,用ECL 发光试剂盒显影。胶片在凝胶成像系统拍照,并用ImageJ软件分析灰度值。
2.6 CCK-8 实验当Caco-2 细胞生长至70%~80%融合度时,用胰蛋白酶消化并收集贴壁细胞,离心后制成细胞悬液。按2×107/L的细胞密度,于96孔板中加入100 μL 细胞悬液。在培养箱中孵育24 h 后(37 ℃、5% CO2)进行实验分组,每组设置6 个复孔。培养箱中孵育24 h后,向每孔加入10 μL的CCK-8溶液,然后在培养箱中培育2 h。使用酶标仪在450 nm处测定吸光度(A)值。
3 统计学处理
采用GraphPad Prism 7.0 统计软件进行统计分析。所有实验数据都以均数±标准差(mean±SD)表示。采用单因素方差分析法分析各组间差异。对于方差齐的数据,使用LSD 法进行两两比较;对于方差不齐的数据,采用Dunnett T3 检验。以P<0.05 为差异有统计学意义。
结 果
1 HIF-1α激活剂和抑制剂对LPS刺激后Caco-2细胞TEER值和FD4浓度的影响
LPS 刺激Caco-2 细胞后TEER 值显著低于对照组(P<0.05)。与LPS 组比较,DMOG 可显著升高细胞TEER值,降低FD4浓度(P<0.05);而BAY87-2243的作用与DMOG相反,见图1。

Figure 1.Effects of HIF-1α agonist(DMOG)and inhibitor(BAY87-2243)on TEER value and FD-4 concentration of Caco-2 cells af‑ter LPS stimulation.Mean±SD. n=6.**P<0.01 vs Ctrl group;##P<0.01 vs LPS group.图1 HIF-1α激动剂和抑制剂对LPS刺激后Caco-2细胞TEER值和FD-4浓度的影响
2 HIF-1α 激活剂和抑制剂对LPS 刺激后Caco-2细胞TJs蛋白表达的影响
Western blot 检测结果显示,LPS 可增加Caco-2细胞HIF-1α 蛋白的表达水平(P<0.05)。与LPS 组比较,DMOG 使得HIF-1α 和TJs 相关蛋白ZO-1、oc‑cludin 和claudin-1 的表达上调,而BAY87-2243 的作用则与DMOG相反(P<0.05),见图2。
3 HIF-1α缓解LPS 诱导的Caco-2 细胞屏障损伤,其机制与mTOR/P70S6K通路有关
与LPS 组 相比,LPS+Rapa 组的Caco-2 细胞TEER 值显著降低,FD-4 浓度显著增加(P<0.05),pmTOR、p-p70S6K 和HIF-1α 蛋白表达水平显著降低,TJs 相关蛋白(ZO-1、occludin、claudin-1)表达水平降低(P<0.05);而LPS+MHY1487 组中Caco-2 细 胞TEER 值显著升高,FD-4 浓度显著降低,p-mTOR 和p-p70S6K 表达水平显著增加(P<0.05),但HIF-1α 和TJs 相关蛋白表达水平无明显变化(P>0.05)。与LPS+Rapa组相比,LPS+Rapa+DMOG 组的TEER值显著升高,FD-4 浓度显著降低(P<0.05),p-mTOR 和pp70S6K 的表达水平无明显变化,HIF-1α 和TJs 相关蛋白表达水平增加(P<0.05)。与LPS+MHY1487(L+M)组相比,LPS+MHY1487+BAY87-2243 组Caco-2 细胞TEER 值显著降低,FD4 浓度显著增加(P<0.05),p-mTOR 和p-p70S6K 的表达水平无明显变化(P>0.05),HIF-1α 和TJs 相关蛋白表达水平降低(P<0.05),见图3。
讨 论
脓毒症是一种危及生命的临床综合征,严重感染可引起多个器官功能障碍,如肠道屏障功能障碍[11]。HIF-1α 是组织代谢关键转录因子,在脓毒症发展过程中发挥着重要作用。本研究结果表明,LPS诱导Caco-2 细胞损伤,表现为紧密连接蛋白表达下调,通透性增加;HIF-1α 可以缓解LPS 诱导的Caco-2细胞损伤,并且其机制可能与mTOR/P70S6K 信号通路有关。
Caco-2 单层屏障模型作为体外模拟肠道屏障和药物转运的经典模型,已被广泛应用。LPS是革兰氏阴性菌细胞壁的主要组成部分,是引起过度炎症级联导致脓毒症的主要原因。肠道上皮功能的失调会导致与脓毒症相关的器官衰竭,脓毒症会致使多种转录因子激活来适应转录调节。LPS 是核因子κB(nuclear factor kappa B,NF-κB)通路的有效激活剂,通过Toll 样4 受体(toll-like receptor 4,TLR4)信号传递可上调HIF-1α 的mRNA 水平,促使其稳定[12-13]。肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)与干扰素γ(interferon-γ,IFN-γ)等炎症介质在炎症性肠病中会引起肠道功能障碍[14]。
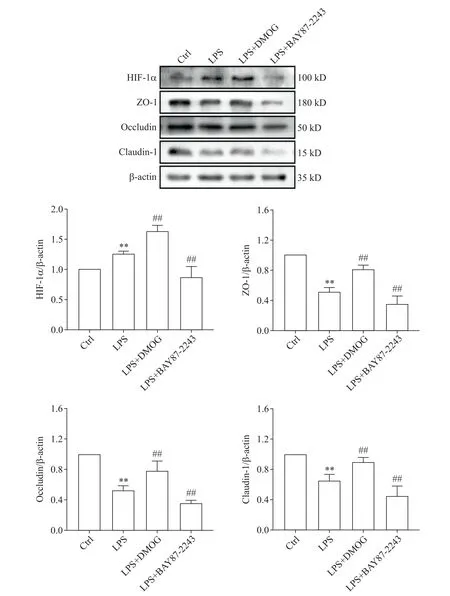
Figure 2.Effects of HIF-1α agonists(DMOG)and inhibitors on(BAY87-2243)expression of HIF-1α and TJs proteins(ZO-1,oc‑cludin and claudin-1)in LPS-stimulated Caco-2 cells.Mean±SD. n=6.**P<0.01 vs Ctrl group;##P<0.01 vs LPS group.图2 HIF-1α激动剂和抑制剂对LPS刺激的Caco-2细胞HIF-1α和TJs蛋白表达的影响
FD4 是肠道通透性和肠道屏障改变的标志物[15]。TJs,包括ZO-1、occludin 和claudin-1 等,是维系细胞间连接与细胞屏障的重要组成部分[16-17]。Oc‑cludin 在维持肠道细胞TEER 值中有重要的作用,具有黏附功能,扮演着栅栏的角色;claudin-1 影响着细胞间物质渗透率,形成细胞旁离子的选择性通道,尤其是阳离子;ZO-1 与多种细胞骨架蛋白绑定,对TJs起到支撑骨架作用[18-19]。
本研究结果表明,HIF-1α 在LPS 刺激的Caco-2中的表达增强。脯氨酸羟化酶抑制剂,HIF-1α 刺激剂DMOG,在常氧条件下可以激活HIF-1α[18],常用于体内外促进HIF-1α积累。本研究表明在体外LPS刺激的Caco-2 中,DMOG 也能明显提高HIF-1α 的表达水平,增加TEER 值,降低FD4浓度以及上调肠道TJs相关蛋白表达水平,而BAY87-2243 作用则与DMOG相反。表明HIF-1α 在脓毒症中缓解炎症和降低氧化应激水平以及改善肠道上皮损伤中发挥着重要的作用。

Figure 3.The effect of HIF-1α on LPS-induced barrier damage in Caco-2 cells is regulated by the mTOR/P70S6K pathway.A:rapa‑mycin(mTOR inhibitor)decreased TEER of Caco-2 cell monolayer,and MHY1487(mTOR activator)increased TEER of Caco-2 cell monolayer.DMOG(HIF-1α activator)can rescue the decrease of TEER caused by rapamycin,and BAY87-2243(HIF-1α inhibitor)can rescue the increase of TEER caused by MHY1487;B:rapamycin increased the FD4 concen‑tration in Caco-2 cell monolayer,while MHY1487 had opposite effect.DMOG rescued the increase in FD4 concentration caused by rapamycin,and BAY 87-2243 rescued the decrease in FD4 concentration caused by MHY1487;C:Western blot was used to detect the expression of p-mTOR,p-P70S6K,HIF-1α and TJs(ZO-1,occludin and claudin-1).Mean±SD. n=6.*P<0.05,**P<0.01 vs LPS group;##P<0.01 vs LPS+Rapa group;△P<0.05,△△P<0.01 vs LPS+MHY1487 group.图3 HIF-1α缓解LPS诱导的Caco-2细胞屏障损伤受mTOR/P70S6K通路调节
肠道HIF-1α 缺陷型小鼠被证实可以加剧肠道屏障的破坏[19]。Colgan 等[20]研究表明,与野生型动物相比,肠道上皮HIF-1α突变(抑制HIF-1α表达)可导致更严重的结肠炎,体重减轻,结肠长度减少,肠道通透性增加;相反,von Hippel-Lindau 突变(引起HIF-1α 持续表达)的肠上皮则表现为对肠道功能的保护作用。Claudin-1已被证明在各种人类疾病中调节功能失调[21]。Masterson 等[22]证实在肠道上皮中HIF-1α 对claudin-1 有着至关重要的调节作用,通过敲除和过表达实验,表明HIF-1α 在基因启动子水平上对claudin-1 表达起着基本调节作用。在TJs 靶标筛选中,claudin-1是HIF-1α缺陷型肠上皮细胞株TJs形态异常的主要原因[23-24]。
脓毒症引发过度炎症可引起机体能量过度消耗和多种脏器功能的损害。mTOR 信号通路是能量消耗中反应能量状态和自我吞噬的主要感受器[25],对HIF-1α 有级联放大作用[26-27]。mTOR 信号通路或许在脓毒症肠道功能损害中发挥着重要的作用。mTOR 是雷帕霉素复合物1 的一部分,丝氨酸-苏氨酸蛋白激酶(即AKT)在下游被磷脂酰肌醇-3-激酶激活,随后激活mTOR[24]。mTOR 能磷酸化p70S6K[28-29],随后p70S6K 激活40S 核糖体蛋白S6[30]对HIF-1α蛋白的合成起到促进作用[31-32]。同样的,mTOR 也可以磷酸化真核细胞起始因子4E 结合蛋白1(4EBP1)[28],使4E-BP1 不能与真核细胞翻译抑制因子4E(eIF-4E)结合并抑制eIF-4E[33],从而阻碍HIF-1α蛋白的合成[34]。
mTOR 抑制剂rapamycin 可以抑制HIF-1α 蛋白合成,降低HIF-1α 活性[35]。在脓毒症大鼠中,rapa‑mycin 可以明显降低心肌中p-mTOR、p-P70S6K 以及HIF-1α 的含量,通过抑制心肌细胞自噬发挥保护作用[35]。本研究中,使用mTOR 抑制剂rapamycin 在LPS 刺激的Caco-2 细胞中,降低HIF-1α 表达,降低TEER 值,增加FD4 浓度以及降低TJs 相关蛋白的表达水平,表明rapamycin 可抵消HIF-1α 对LPS 诱导的肠黏膜细胞的保护作用。而mTOR 激活剂MHY1487部分改善LPS 诱导的肠黏膜损伤作用,可能不通过HIF-1α起作用,具体机制还需要进一步研究。
综上所述,本研究显示HIF-1α 可减轻LPS 诱导的肠上皮Caco-2 细胞屏障功能损伤,其机制可能与mTOR/P70S6K 信号通路调控,改善紧密连接结构的变化和相关蛋白的表达,减低肠黏膜通透性有关。
