慢性阻塞性肺疾病小鼠模型制备方法的比较研究*
2022-02-16梅晓峰卢瑞龙崔莉莉田燕歌李建生
梅晓峰, 赵 鹏,3, 卢瑞龙, 崔莉莉, 田燕歌,3, 李建生,3△
(河南中医药大学1呼吸疾病中医药防治省部共建协同创新中心,2河南省中医药防治呼吸病重点实验室,3中医药科学院,河南 郑州 450046)
慢性阻塞性肺疾病(chronic obstructive pulmo‑nary disease,COPD)是一种以持续气流受限为特征的可预防和治疗的疾病[1]。据世界经济论坛评估,2030 年,COPD 全球经济负担将达每年50 万亿美元[2]。COPD 已成为威胁公众健康的第三大死亡原因疾病[3],香烟烟雾(cigarette smoke,CS)暴露、细菌及病毒感染均是诱发和加重COPD 的重要因素。COPD 病理机制复杂,动物模型是阐释发病机制、寻找有效药物的重要工具。因此,建立稳定可靠的COPD模型具有重要意义。
大鼠、豚鼠、小鼠和雪貂等常用于制备COPD 模型,其中小鼠具有成本低、体积小、易于饲养和基因组改造技术成熟等优势,是复制人类疾病模型的最常用动物[4]。COPD 模型制备的方法主要包括CS 熏吸、气管内滴注细菌或脂多糖及吸入SO2等[5-6],但大多方法周期长,病变持续时间短。本课题组前期成功建立了香烟联合肺炎克雷伯杆菌(Klebsiella pneu⁃moniae,KP)感染的大鼠模型,具有成模早,病理表现接近临床,且病变持续时间长的优势[7]。本研究在前期工作基础上,综合多种致病因素,采用CS 暴露、KP 感染、聚肌胞苷酸(polyinosinic-polycytidylic acid,Poly I:C)滴鼻、CS 暴露联合KP 感染和CS 联合Poly I:C 滴鼻5 种方法建立COPD 模型,通过比较单一及复合致病因素的致病特点及病变程度,以期建立一种稳定可靠、且与临床病理特征相符合的小鼠模型,为深入研究COPD 的发病机制及药物作用机制提供依据。
材料和方法
1 动物和细菌
SPF级BALB/c小鼠288只,雄性,体重(20±2)g,购自北京维通利华实验动物技术有限公司,合格证号为110011200106861568,许可证号为SCXK(京)2016-0006。本研究通过河南中医药大学实验动物福利伦理审查委员会审查批准(伦理审查批号为DWLL202003210)。
肺炎克雷伯杆菌(货号46114)购自中国生物制品检验鉴定所,使用前将细菌浓度调整为5×109CFU/L(预实验确定)。
2 实验材料、试剂和仪器
红旗渠过滤嘴香烟(烤烟型,焦油量10 mg,烟气烟碱量0.8 mg,烟气一氧化碳量12 mg)由河南中烟工业有限责任公司生产;Poly I:C(货号tlrl-picw-250)购自Invivogen,每次使用前将浓度调至1.25 g/L(预实验确定);小鼠肿瘤坏死因子α(tumor necrosis fac‑tor-α,TNF-α)ELISA Kit(货号555268)和小鼠白细胞 介 素6(interleukin-6,IL-6) ELISA Kit( 货 号555240)购自BD;小鼠基质金属蛋白酶2(matrix me‑talloproteinase-2,MMP-2) ELISA Kit( 货 号E-ELM0780c)购自Elabscience。 动物肺功能检测系统(FinePointe PFT);全波长酶标仪(Multiskan GO);样品破碎系统(TissueLyser Ⅱ);高速台式冷冻离心机(D-37520)。
3 方法
3.1 分组将288只SPF级BALB/c小鼠随机分为6组:空白组(normal 组)、CS 组、细菌组(KP 组)、CS 联合KP 组(CS+KP 组)、Poly I:C 组和CS 联合Poly I:C组(CS+Poly I:C组),每组48只。
3.2 小鼠模型的制备第1~8 周,CS 组单用CS 熏吸,KP组单用KP(每只1×105CFU)滴鼻,CS+KP组采用CS 熏吸联合KP 滴鼻,Poly I:C 组单用Poly I:C(每只25 μg)滴鼻,CS+Poly I:C 组采用CS 熏吸联合Poly I:C 滴鼻。CS 熏吸方法:将小鼠放入熏烟箱,点燃香烟,使烟雾浓度达到(30±5)%进行烟雾熏吸,每次40 min,每天2次。KP 和Poly I:C 经鼻滴注,每7 d 1次,共8周。
分别于第4周(造模4周)、第8周(造模8周)、第16 周(停止造模8 周)及第24 周(停止造模16 周)取材。
3.3 肺功能测定分别于第0、4、8、12、16、20 和24周采用小动物全身体积描记检测系统检测小鼠50%潮气量呼气流量(50% tidal volume expiratory flow,EF50)和呼气峰流速(peak expiratory flow,PEF)等指标。
3.4 肺组织病理学观察采用10 %中性甲醛固定肺组织,72 h 后进行石蜡包埋及HE 染色。每张肺组织切片随机截取6 个肺泡视野图片,在图片中央画出“十”字,计算每个视野的肺泡数(alveolar number,Na)、肺泡隔膜数(septum number,Ns)、测量长度(length,L)和面积(size,S),计算公式如下:肺泡平均截距(mean linear intercept,MLI;μm)=L/Ns,平均肺泡数(mean alveolar number,MAN;mm−2)=Na/S[8]。
3.5 ELISA 检测肺组织中TNF-α、IL-6 和MMP-2 水平将小鼠右肺分离后,50 mg 肺组织匀浆取上清,根据ELISA 试剂盒说明书检测小鼠肺组织中TNFα、IL-6和MMP-2的水平。
3.6 R 值综合评价采用R值综合评价法[9]分别对各时点小鼠肺功能、肺组织病理、炎症和蛋白酶指标进行R值综合评价(R综合),比较5 种造模方法对COPD 小鼠的病变程度。R综合值大于CS 组R综合值说明病变程度强于CS 组,R综合值小于CS 组说明病变程度弱于CS组。
4 统计学处理
采用SPSS 22.0 统计软件进行数据分析。计量数据以均数±标准差(mean±SD)描述。多组间比较采用方差分析,各组均数间的两两比较采用SNK-q检验。当P<0.05时认为差异有统计学意义。
结 果
1 肺功能
第4 周,与normal 组比较,CS+KP 组的PEF 显著降低(P<0.05);第8 周和第12 周,与normal 组比较,CS 组、CS+KP 组和CS+Poly I:C 组的PEF 和EF50 显著降低(P<0.05),KP 组和Poly I:C 组的PEF 显著降低(P<0.05);第16 周,与normal 组比较,CS 组、CS+KP 组和CS+Poly I:C 组的PEF 和EF50 均 显 著降低(P<0.05);第20 周和第24 周,与normal 组比较,CS+KP 组和CS+Poly I:C 组的PEF 和EF50 显著降低(P<0.05),见表1、2。
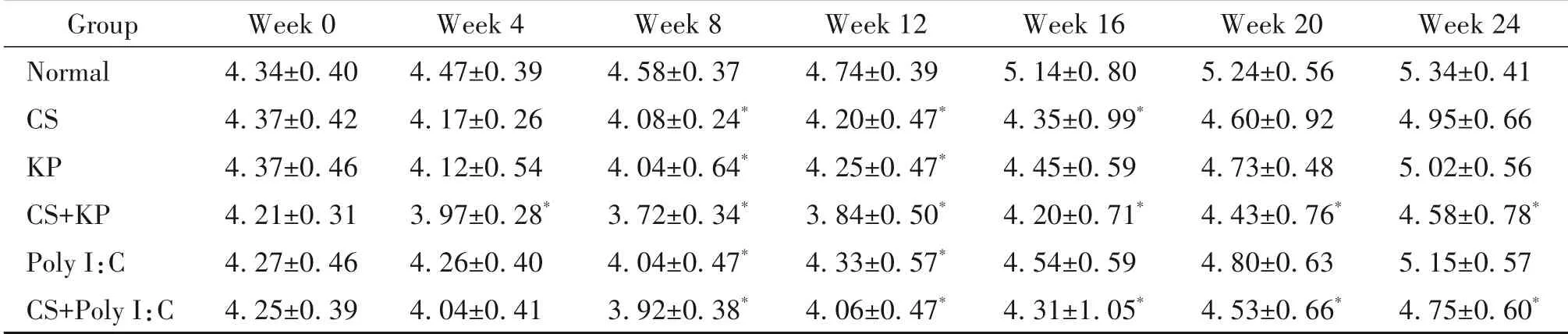
表1 不同时点各组小鼠PEF的变化Table 1.The changes of PEF in each group at each time point(mL/s.Mean±SD. n=8 to12)
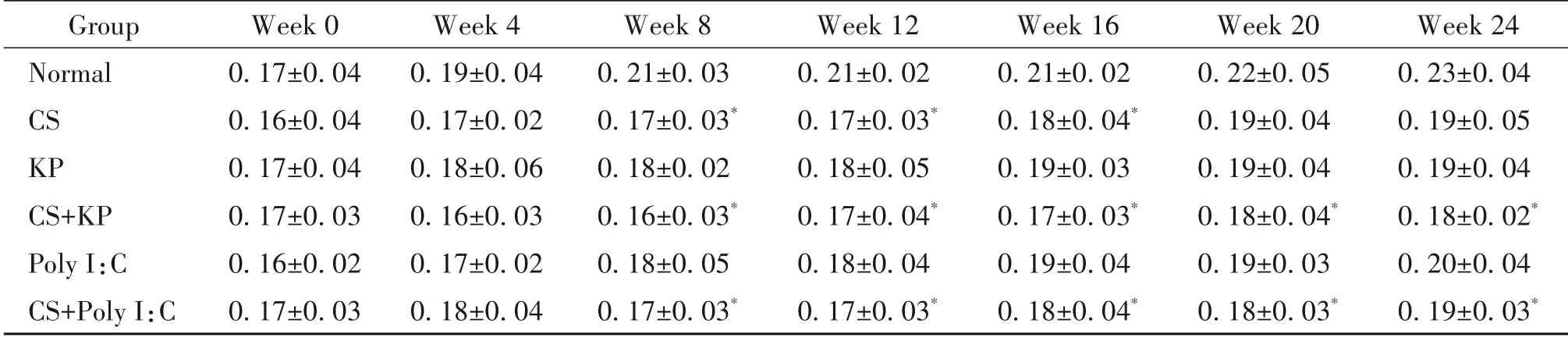
表2 不同时点各组小鼠EF50的变化Table 2.The changes of EF50 in each group at each time point(mL/s.Mean±SD. n=8 to 12)
2 肺组织病理变化
HE 染色结果显示,normal 组小鼠肺组织结构正常,未见病理改变;造模8 周后,CS 组、CS+KP 组和CS+Poly I:C 组小鼠肺组织出现大量炎症细胞浸润、肺泡腔扩张、肺泡壁断裂融合、气管壁增厚等病理变化,KP 组和Poly I:C 组小鼠肺组织仅出现炎症细胞浸润、肺泡腔扩张,见图1。
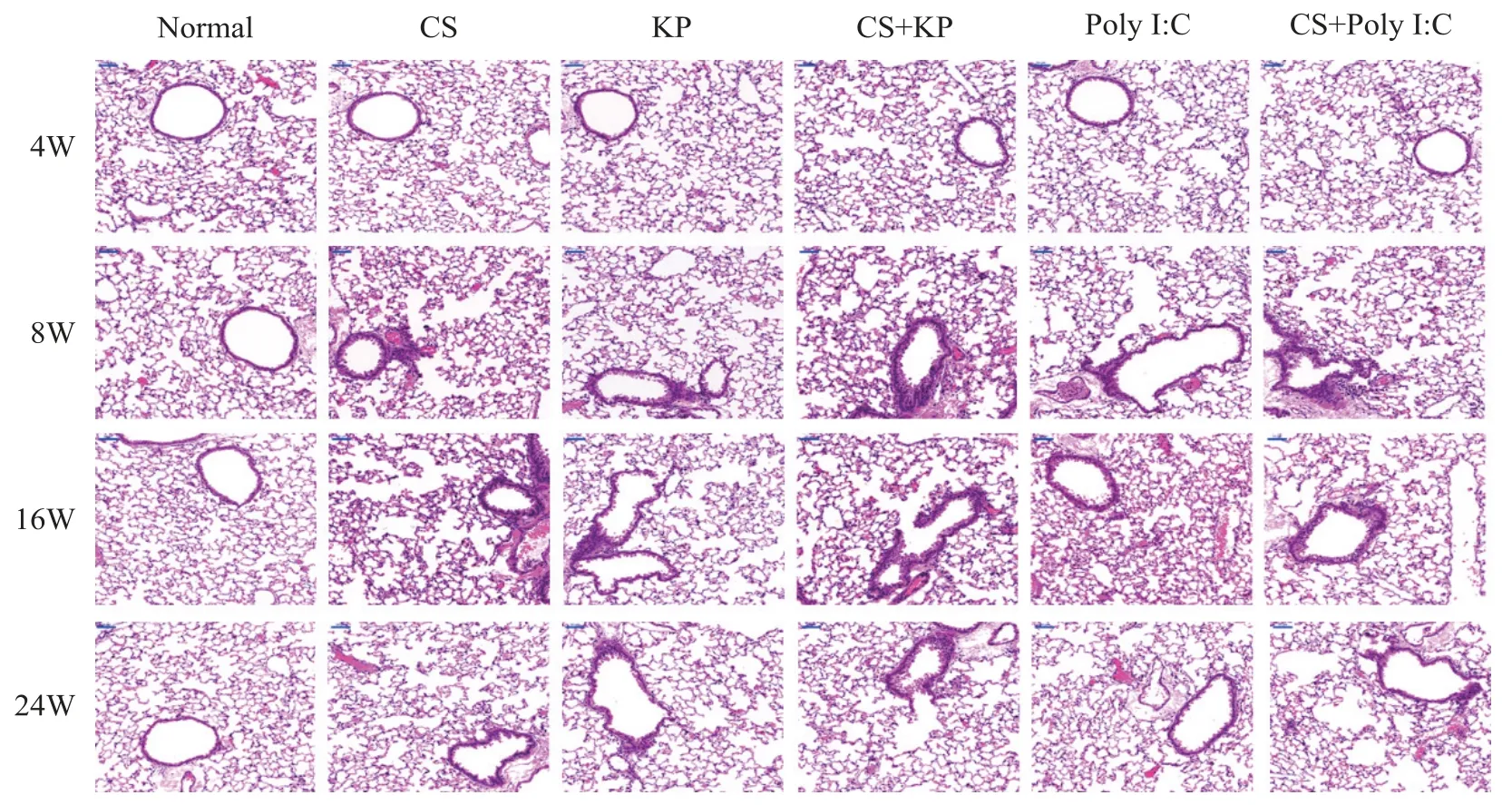
Figure 1.The pathological changes in lung tissues of mouse in each group at each time point(HE staining,×200).图1 不同时点各组小鼠肺组织的病理变化
第4周,与normal组比较,CS+KP 组的MAN 显著降低,MLI显著升高(P<0.05);第8周,与normal组比较,CS 组、CS+KP 组和CS+Poly I:C 组MAN 显著降低,MLI显著升高,KP组和Poly I:C组的MAN显著降低,CS+KP 组较KP 组和Poly I:C 组的MAN 显著降低(P<0.05);第16 周,与normal 组比较,CS+KP 组和CS+PolyI:C 组的MAN 显著降低,MLI 显著升高,CS组的MAN 显著降低(P<0.05);第24 周,与normal 组比较,CS+KP 组和CS+Poly I:C 组的MAN 显著降低,MLI 显著升高,CS+KP 组较CS 组和KP 组和Poly I:C组的MLI显著升高(P<0.05),见表3、4。
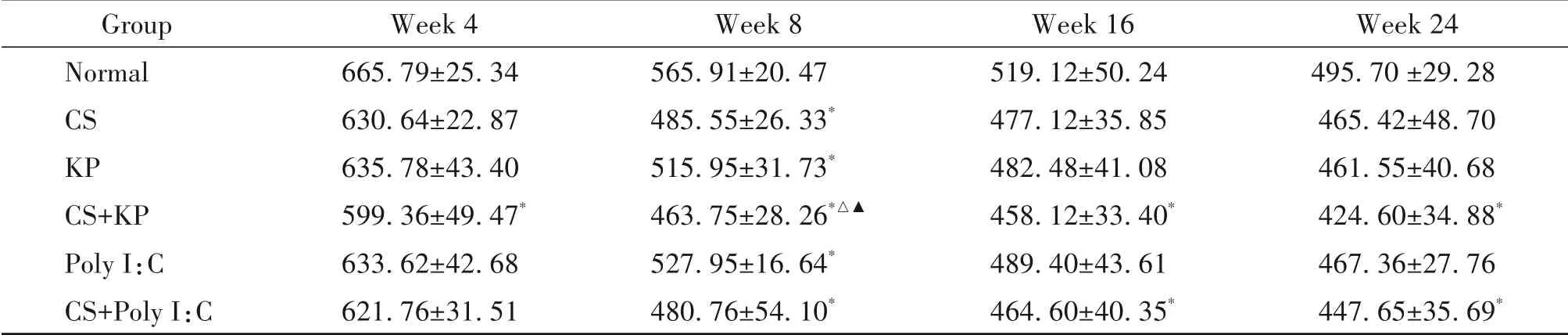
表3 不同时点各组小鼠平均肺泡数的变化Table 3.The changes of MAN in each group at each time point(mm−2.Mean±SD. n=8 to 12)
3 肺组织中TNF-α和IL-6的变化
第4 周,与normal 组比较,CS+KP 组的TNF-α 和IL-6 显著升高(P<0.05);第8 周,与normal 组比较,CS 组、CS+KP 组和CS+Poly I:C 组的TNF-α 和IL-6 均显著升高,KP 组的TNF-α 显著升高,CS+KP 组较CS组的IL-6 显著升高,较KP 组和Poly I:C 组的TNF-α和IL-6 显著升高,CS+Poly I:C 组较CS 组、KP 组和Poly I:C 组的IL-6 显著升高(P<0.05);第16 周,与normal 组比较,CS+KP 组和CS+Poly I:C 组的TNF-α和IL-6均显著升高,CS组、KP 组和Poly I:C 组的IL-6显著升高,CS 组较KP 组和Poly I:C 组的IL-6 显著升高,CS+KP组和CS+Poly I:C组较CS组的TNF-α显著升高,较KP 组和Poly I:C 组的TNF-α 和IL-6 显著升高(P<0.05);第24 周,与normal 组比较,CS+KP 组和CS+Poly I:C 组的TNF-α 和IL-6 显著升高,CS+KP 组较CS 组、KP 组和Poly I:C 组的IL-6 显著升高(P<0.05),见表5、6。
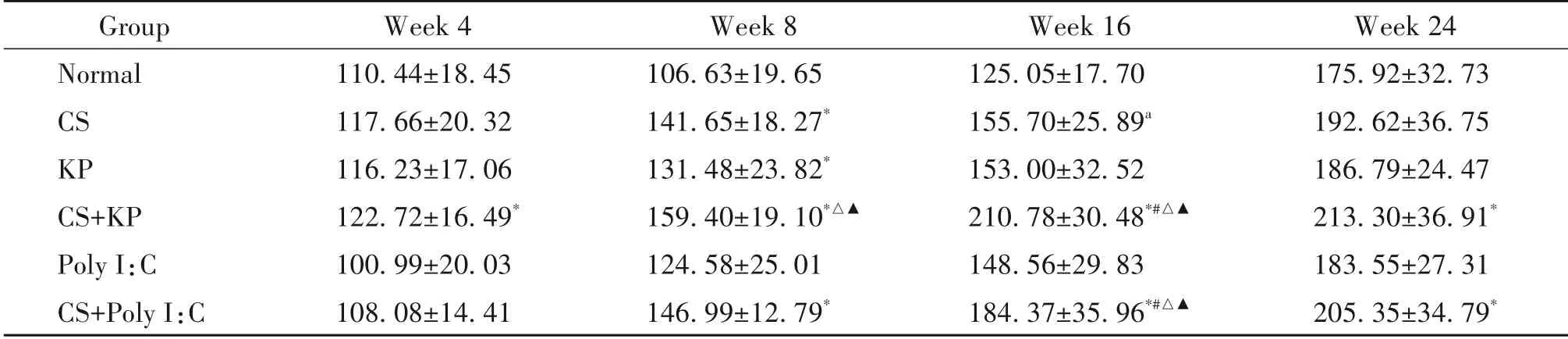
表5 不同时点各组小鼠肺组织中TNF-α水平的比较Table 5.Comparison of the levels of TNF-α in each group at each time point(ng/L.Mean±SD. n=8 to 12)
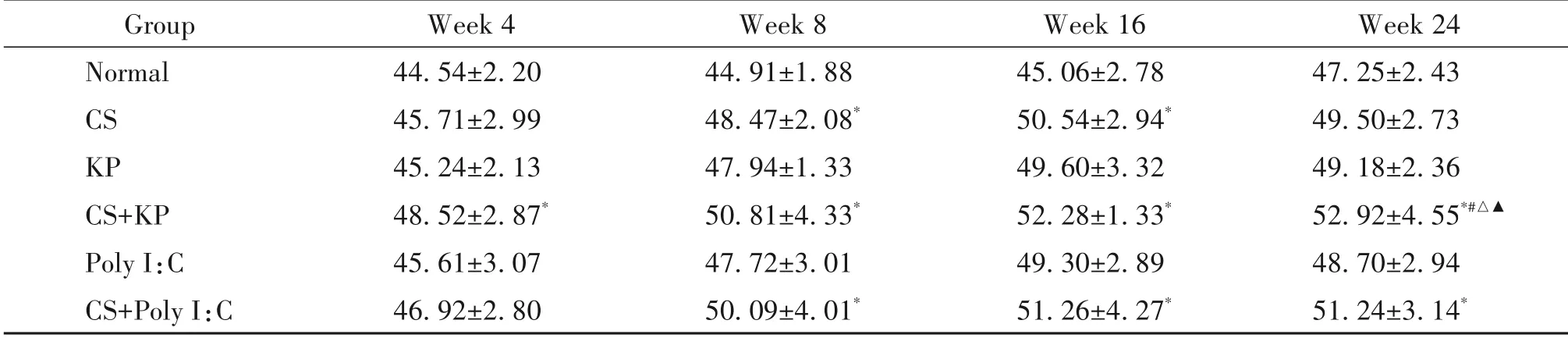
表4 不同时点各组小鼠肺泡平均截距的变化Table 4.The changes of MAN in each group at each time point(μm.Mean±SD. n=8 to 12)
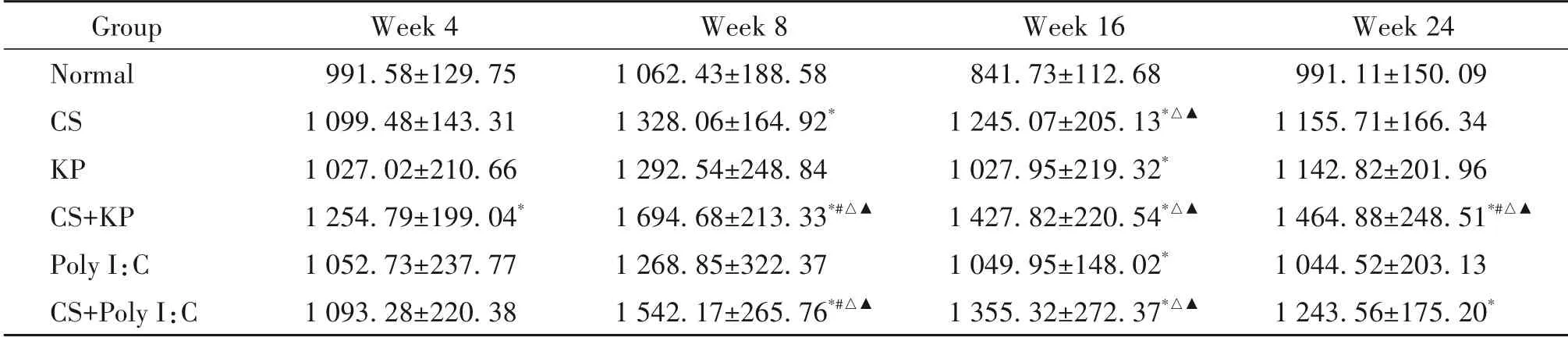
表6 不同时点各组小鼠肺组织中IL-6水平的比较Table 6.Comparison of the levels of IL-6 in each group at each time point(ng/L.Mean±SD. n=8 to 12).
4 肺组织中MMP-2的变化
第8 周,与normal 组比较,CS 组、KP 组、CS+KP组、Poly I:C 组和CS+Poly I:C 组的MMP-2 均显著升高,CS+KP 组和CS+Poly I:C 组较CS 组、KP 组和Poly I:C 组的MMP-2 显著升高(P<0.05);第16 周,与nor‑mal 组比较,CS 组、KP 组、CS+KP 组、Poly I:C 组和CS+Poly I:C 组的MMP-2 显著升高,CS+KP 组较CS组、KP 组和Poly I:C 组的MMP-2 显著升高,CS+Poly I:C 组较KP 组和Poly I:C 组的MMP-2 显著升高(P<0.05);第24 周,与normal 组比较,CS 组、CS+KP 组和CS+Poly I:C 组 的MMP-2 显著升高(P<0.05),见表7。
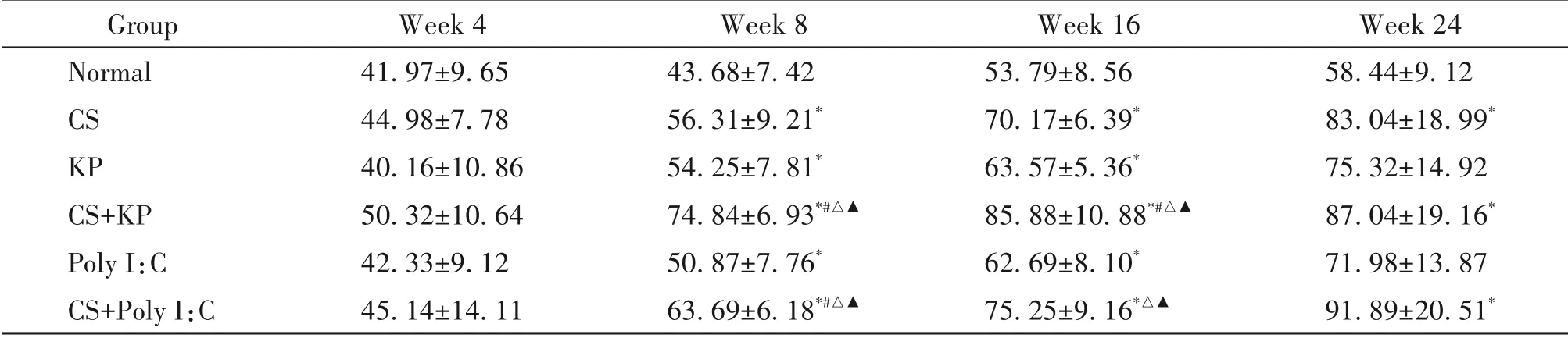
表7 不同时点各组小鼠肺组织中MMP-2水平的比较Table 7.Comparison of the levels of MMP-2 in each group at each time point(μg/L.Mean±SD. n=8 to 12)
5 R值综合评价
R值综合评价结果显示,造模4 周,CS+KP 组的R综合值较CS 组、KP 组和Poly I:C 组显著升高(P<0.05),各模型组的病变程度依次为CS+KP>CS>CS+Poly I:C>Poly I:C>KP;造模8 周,CS+KP 组和CS+Poly I:C 组的R综合值较KP 组和Poly I:C 组显著升高(P<0.05),各模型组的病变程度依次为CS+KP>CS+Poly I:C>CS>KP>Poly I:C;第16 周,CS+KP 组和CS+Poly I:C 组的R综合值较KP 组和Poly I:C 组显著升高,CS 组的R综合值显著高于Poly I:C 组(P<0.05),各模型组的病变程度依次为CS+KP>CS+Poly I:C>CS>KP>Poly I:C;第24 周,CS+KP 组和CS+Poly I:C 组的R综合值较CS 组、KP 组和Poly I:C 组显著升高,CS 组的R综合值显著高于Poly I:C组(P<0.05),各模型组的病变程度依次为CS+KP>CS+Poly I:C>CS>KP>Poly I:C;综合所有时点R值结果显示,与CS 组比较,KP组和Poly I:C 组的R综合值显著降低,CS+KP 组和CS+Poly I:C 组的R综合值较CS 组、KP 组和Poly I:C 组显著升高(P<0.05),见表8。
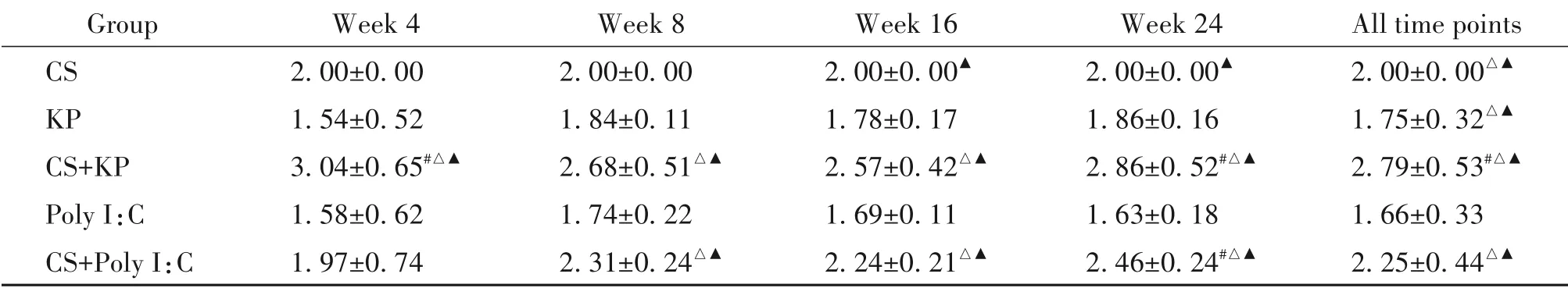
表8 不同时点各组小鼠指标R值综合评价Table 8.The changes of comprehensive R values in each group at each time point and all time points(Mean±SD. n=7)
讨 论
COPD 的发病率和死亡率在世界范围内呈上升趋势,其特点是慢性气道炎症、不可逆气流受限和肺功能的加速下降。诱发和加重COPD 的环境危险因素主要包括吸烟、细菌病毒感染、职业性粉尘和空气污染等。临床上90% 的COPD 患者为吸烟者或曾有吸烟史[10]。吸烟可损伤上皮组织,引起炎症细胞向黏膜、黏膜下层和腺体组织浸润,诱发杯状细胞和基底细胞增生、鳞状上皮细胞化生、细胞外基质沉积增多,导致气道重塑引起气流受限[11-12]。此外,呼吸道感染是COPD 发病和加重的主要原因,与非感染性COPD 患者相比,细菌和病毒感染者的住院周期延长、低氧血症和肺功能恶化程度加重、死亡率升高[13-16]。常见的感染细菌为流感嗜血杆菌、肺炎链球菌、肺炎克雷伯菌、铜绿假单胞菌和卡他莫拉菌,常见的病毒为单链RNA 病毒,如鼻病毒、副流感病毒、流感病毒和呼吸道合胞病毒[17-18]。
文献中多采用单纯CS 熏吸[19]、气管内滴注弹性蛋白酶[20]、CS联合脂多糖[21]及CS联合细菌或病毒[22]构建COPD 动物模型,但存在诸多不足,如造模周期较长、病理改变不稳定、无法较好模拟COPD 临床特征。活病毒用于动物模型的制备具有一定的风险、不易质控的局限性。Poly I:C 是双链核糖核酸的合成类似物,结构明确、无传染性、易于操作,可模拟呼吸道病毒感染复制的中间产物,诱发机体损伤,体内外研究常用Poly I:C 模拟RNA 病毒感染作用[23-24]。本课题组前期采用CS 熏吸联合细菌感染成功模拟COPD 大鼠模型,造模8周即可呈现COPD 病理特征,观察至第32 周,病变特征稳定。本研究以经济、个体差异小的近交系小鼠为研究对象,通过比较CS、肺炎克雷伯杆菌和Poly I:C 单因素及复合因素诱导的COPD 模型,以期建立一种简单、稳定、安全有效且成模周期短的造模方法。
肺功能和肺组织病理改变是COPD 动物模型制备的重要评价标准[25]。其中,无创肺功能的测定可动态监测气道阻塞、肺容积、传导性和通气参数等变化,如EF50 反应气道阻塞严重程度,潮气量反应肺容积变化;PEF 反应传导性变化,每分钟通气量反应通气情况变化等[26]。肺组织病理改变作为评价COPD 模型的标准之一,可反映气道和肺组织病变的严重程度[27]。王玮等[28]采用香烟联合气道滴入脂多糖发现造模12 周各模型组大鼠在肺功能和肺病理方面出现COPD 的典型病理变化。炎症反应和蛋白酶-抗蛋白酶失衡是COPD 的主要病理机制[29-30]。CS、细菌和病毒等致病因素侵入机体,刺激上皮细胞、肺泡巨噬细胞和T 细胞等产生多种炎症因子,如TNF-α、IL-6 和IL-β 等,诱发炎症反应级联放大[31-33],并引起各种蛋白酶失衡,促进巨噬细胞向肺实质及气道聚集,诱导结构改变,导致肺气肿的形成,促进COPD发生发展[34]。
本研究结果显示,造模4 周后,CS 联合细菌可降低小鼠肺功能,提高炎症因子水平,CS 联合细菌或Poly I:C 组肺组织出现病理损伤;造模8 周后,各模型组小鼠均出现COPD 典型病理变化,肺功能显著降低,炎症因子TNF-α、IL-6 和MMP-2 显著升高;停止造模8 周后,各模型组病理变化依然存在;停止造模16 周后,CS 联合细菌或Poly I:C 组病理变化仍持续存在。R值综合评价结果显示,造模4 周CS 联合细菌组即可出现COPD 病理特征;造模8 周CS 联合细菌或Poly I:C 组病理特征重于CS、细菌和Poly I:C组,且病理损伤可持续至停止造模后16周。
综上所述,CS、细菌和Poly I:C 及其联合均可以不同程度的引起小鼠肺功能下降、肺病理损伤,其中CS 联合细菌或Poly I:C 组病理特征出现早、明显、持续时间长,其病理学特征类似于COPD 患者,适用于发病机制的防治研究。
