淫羊藿苷通过AMPK减轻脂肪酸诱导的肾小管上皮细胞线粒体损伤*
2022-02-16吴艺璇彭维艳扈腊英周宇霞
吴艺璇, 彭维艳, 刘 露, 扈腊英, 汤 磊,2, 周宇霞,2△, 郭 兵,2△
(1贵州医科大学病理生理学教研室/贵州省常见慢性疾病发病机制及药物研究重点实验室,贵州 贵阳 550025;2贵州省化学合成药物研发利用工程技术研究中心,贵州 贵阳 550025)
肾脏是高度代谢的器官,其功能与线粒体能量生成密切关联。糖尿病肾病(diabetic nephropathy,DN)患者常合并有脂代谢紊乱,异常的脂质蓄积会导致细胞损伤和炎症,称为脂毒性。其中,线粒体功能障碍介导的细胞损伤是脂质肾毒性的重要机制之一。研究表明,适度的线粒体融合和分裂是组织细胞发挥正常功能的关键。线粒体融合-分裂失衡在DN 的发生发展过程中起着重要作用。有证据表明,线粒体功能障碍在激活NLRP3炎症小体中起着关键作用[1]。此外,线粒体过度分裂可以促进细胞凋亡[2]。同时,线粒体中脂肪酸β 氧化是早期DN 肾小管上皮细胞中活性氧簇(reactive oxygen species,ROS)产生增加的来源[3]。因此,脂质代谢异常引起的脂质异位沉积与糖尿病肾损伤紧密关联,过程涉及氧化应激、线粒体损伤、炎症和凋亡等多个事件,但具体调控机制尚未充分阐明。
AMP 活化蛋白激酶(AMP-activated protein ki‑nase,AMPK)是一种高度保守的丝氨酸/苏氨酸蛋白激酶,在ATP 被消耗,AMP 水平升高时被激活,维持能量的平衡[4-5]。目前已有研究发现,AMPK 可以促进Parkin 蛋白被招募到受损的线粒体上,并加强受损线粒体向溶酶体运动,增加线粒体自噬活性[6-7],改善线粒体功能。
淫羊藿苷(icariin,ICA)是一种植物类黄酮苷,是中药淫羊藿的主要活性成分。ICA 因其雌激素样作用,对心脑血管系统、骨代谢、免疫和神经系统等具有广泛的药理作用,同时还具有抗炎、抗菌、抗病毒和抗肿瘤等功效[8]。相关文献报道,ICA 可以参与调节胰岛素敏感性和脂质代谢[9-10],降低DN 大鼠血肌酐、尿素水平,抑制肾组织胶原的合成、影响细胞外基质(extracellular matrix,ECM)积聚,发挥肾脏保护作用,因而可用于糖尿病及其相关并发症的防治[11-12],但其具体调控机制仍未充分阐明。因此,本文以棕榈酸(palmitic acid,PA)培养的肾小管上皮细胞为研究对象,探讨ICA 对脂肪酸诱导肾小管上皮细胞损伤的作用及可能的分子机制,为ICA 在临床上治疗DN提供实验基础和理论依据。
材料和方法
1 材料与试剂
淫羊藿苷(MCE);上皮型钙黏蛋白(epithelial cadherin,E-cadherin)抗体(ABclonal);、α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)、p-AMPKα(Thr172)、cleaved caspase-3 抗体和MitoTracker Red CMXRos 均 为Cell Signaling Technology 产 品;Bax、Bcl-2、线粒体融合蛋白1(mitochondrial fusion protein 1,MFN1)、发动蛋白相关蛋白1(dynamin-related pro‑tein 1,Drp1)、核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domain-like re‑ceptor protein 3,NLRP3)、AMPK、caspase-1 及tubulin抗体均购自Proteintech;β-actin 抗体(普美生物);含caspase 募集结构域的凋亡相关斑点样蛋白(apopto‑sis-associated speck-like protein containing a caspase recruitment domain,ASC)抗体为Santa Cruz Biotech‑nology 产品;DMEM 培养基(Gbico);胎牛血清(BI);ROS 检测试剂盒购自南京建成生物工程研究所;线粒体膜电位检测试剂盒(JC-1)购自碧云天公司。AMPK 抑制剂(AMPK inhibitor,AMPKi)为dorsomor‑phin,溶解于DMSO 中,母液浓度为10 mmol/L,工作浓度为10 μmol/L。
2 方法
2.1 细胞培养及分组大鼠肾小管上皮NRK52E细胞于含10%胎牛血清的DMEM 培养基中培养。待NRK52E细胞融合至30%~40% 时,给予PA刺激并继续培养48 h。根据不同的干预措施,细胞随机分为对照(control)组、PA 组、PA+ICA 组及PA+ICA+AMP‑Ki组。上述各组细胞分别处理至6孔板中,48 h后收集细胞供各指标检测。
2.2 Western blot 检测蛋白水平收集的细胞蛋白样品经SDS-PAGE 分离,转膜,用含50 g/L 脱脂牛奶的TBST 封闭液封闭1 h,TBST 洗膜3 次,孵育Ⅰ抗4 ℃孵育过夜。次日回收I抗,TBST 洗膜后加入相应的Ⅱ抗,室温孵育1 h;TBST洗膜,ECL化学发光法显色,Tanon 化学发光成像系统曝光,并使用ImageJ 软件进行定量分析。
2.3 流式细胞术检测细胞内ROS 的生成水平10 mmol/L DCFH-DA 稀释于PBS 中使其工作浓度为10 μmol/L。37 ℃孵育细胞60 min 后用胰酶消化2 min,加入培养基终止消化,制成细胞悬液,1 000 r/min 离心5 min收集细胞,PBS洗涤1次,离心收集细胞沉淀物用于荧光检测。将收集好的细胞用PBS 重悬,并用流式细胞仪(ACEA NovoCyte)于激发波长488 nm处进行荧光检测。
2.4 激光共聚焦观察线粒体的形态变化将处理好的NRK52E 细胞吸取上清后,PBS 润洗1 次,加入用无血清培养基配置好的MitoTracker Red(50 nmol/L)染色工作液,在37 ℃细胞孵箱中避光染色20 min。吸去染色工作液后用冰冷甲醇固定15 min,再用PBS 润洗细胞,最后用含DAPI 的抗荧光淬灭剂封片,在激光共聚焦(Zeiss)于激发波长555 nm 处观察线粒体形态变化,并进行统计。
2.5 倒置显微镜观察细胞内线粒体膜电位变化将处理好的NRK52E 细胞吸取上清后,用PBS 润洗1次,每孔加入JC-1 工作液1 mL,在37 ℃细胞培养箱中避光染色20 min。最后用JC-1 染色缓冲液润洗细胞3 次,倒置荧光显微镜下观察图像。在线粒体膜电位较高时,可以产生红色荧光;在线粒体膜电位较低时,可以产生绿色荧光。通过JC-1 从红色到绿色荧光的转变可以检测到细胞膜电位的下降。同时,设置CCCP作为诱导线粒体膜电位下降的阳性对照。
3 统计学处理
采用GraphPad Prism8.3 软件进行数据统计分析。数据均以均数±标准差(mean±SD)表示,两组数据差异的比较采用两独立样本t检验,多组间比较采用单因素方差分析。以P<0.05 为差异有统计学意义。
结 果
1 ICA 减轻脂肪酸诱导的肾小管上皮细胞间质纤维化
肾小管上皮细胞是通过E-cadherin 等各种细胞黏附机制来维持细胞形态、结构及功能完整性的,丢失E-cadherin 的细胞会呈现出许多非上皮细胞的特征。因此,E-cadherin 是上皮细胞黏附和表型的主要标志,其减少或丢失是EMT 重要的标志性变化。α-SMA 常于肌成纤维细胞及平滑肌细胞的胞浆中呈阳性表达,肾间质纤维化发生时,α-SMA 的表达水平增加标志着上皮细胞形态学发生了转化。据此,我们通过Western blot 检测NRK52E 细胞E-cadherin 和α-SMA 蛋白表达水平,探究ICA 对肾小管上皮细胞间质纤维化的影响。结果如图1A 所示,与对照组比较,PA 组E-cadherin 的表达显著下调(P<0.01),α-SMA 的表达显著上调(P<0.01)。在PA 处理的细胞中加入不同浓度ICA,结果显示2.5 μmol/L、5 μmol/L 和10 μmol/L ICA 均可显著上调E-cadherin 的表达,同时5 μmol/L 和10 μmol/L ICA 均可下调α-SMA 的表达(P<0.05)。我们以5 μmol/L 为ICA 的最佳作用浓度行后续实验,结果显示:与对照组比较,PA 组E-cadherin 的表达显著下调(P<0.01),α-SMA的表达显著上调(P<0.01);与PA组比较,PA+ICA 组E-cadherin的表达显著上调(P<0.01),α-SMA的表达显著下调(P<0.01),见图1B。以上结果证明,ICA 可以减轻脂肪酸诱导的肾小管上皮细胞间质纤维化。
2 ICA 抑制脂肪酸诱导的肾小管上皮细胞凋亡和炎症反应

Figure 1.The effect of ICA on E-cadherin and α-SMA expression in NRK52E cells treated with PA.A:the expression of E-cadherin and α-SMA in NRK52E cells stimulated with PA after ICA intervention for 48h with different concentrations was determined by Western blot;B:after 5 μmol/L ICA intervention for 48 h,the expression of E-cadherin and α-SMA in the cells was de‑termined by Western blot.Mean±SD. n=3.**P<0.01 vs control group;#P<0.05,##P<0.01 vs PA group.图1 ICA对PA处理的NRK52E细胞E-cadherin和α-SMA的影响
Bcl-2 家族成员是细胞凋亡的调控者,通过调节不同效应蛋白的表达量,调控细胞的凋亡和生长,Bcl-2 表达增多可以与Bax 形成稳定的Bcl-2-Bax 复合体,来减少Bax-Bax 复合体对线粒体膜的破坏,抑制凋亡,延长细胞寿命。细胞凋亡的数学模型认为,Bcl-2 家族中促凋亡和抑凋亡成员的比率直接决定了线粒体外膜各种通道的开放程度,形成调控细胞凋亡的枢纽。因此,Bcl-2/Bax 的比值可以作为反映细胞凋亡程度的指标。Cleaved caspase-3 是死亡受体通路、线粒体通路及其内质网应激通路的汇聚点,是细胞凋亡过程中最主要的终末剪切酶。NLRP3炎症小体是由NLRP3、ASC 和无活性的caspase-l 前体(pro-caspase-1)组成的多蛋白复合体,是炎症免疫反应的重要组成部分。以NLRP3 炎症小体为中心的NLRP3-ASC-caspase-1-IL-18/IL-1β-TGF-β 信号通路在T2DM 的发生发展过程中发挥重要作用。据此,我们通过Western blot 检测NRK52E 细胞凋亡蛋白Bax 和cleaved caspase-3,抗凋亡蛋白Bcl-2 及炎症小体NLRP3、ASC 和caspase-1 的蛋白水平变化,探讨ICA 对肾小管上皮细胞凋亡和炎症的影响。结果如图2 所示,与对照组比较,PA 组Bax、cleaved caspase-3、NLRP3、ASC和caspase-1的蛋白水平显著上调(P<0.01),Bcl-2 的蛋白水平显著下调,Bcl-2/Bax 的比值明显降低(P<0.01);与PA 组比较,PA+ICA 组Bax、cleaved caspase-3、NLRP3、ASC 和caspase-1 的蛋白水平显著下调(P<0.01),Bcl-2 的蛋白水平显著上调,Bcl-2/Bax 的比值明显升高(P<0.01)。以上结果证明,ICA可抑制脂肪酸诱导的肾小管上皮细胞凋亡和炎症反应。
3 ICA 抑制脂肪酸诱导的肾小管上皮细胞线粒体损伤及ROS的产生
线粒体的融合可使细胞通过内补充恢复正常功能,线粒体外膜的融合主要由丝裂菌素(MFN1/MFN2)介导。线粒体分裂过程涉及关键发动蛋白(Drp1),随着DN 病变的进展,线粒体的分裂与肾损伤标记物存在正相关性。据此,我们通过Western blot 检测NRK52E 细胞MFN1 和分裂关键发动蛋白Drp1 的水平,进一步探究ICA 对线粒体融合和分裂的影响。结果如图3A 所示,与对照组比较,PA 组MFN1 的蛋白水平显著下调,Drp1 的蛋白水平显著上调(P<0.01);与PA 组比较,PA+ICA 组MFN1 的蛋白水平显著上调,Drp1 的蛋白水平显著下调(P<0.01)。为了观察ICA 对PA 刺激的NRK52E 细胞线粒体形态的影响,我们采用MitoTracker Red 对NRK52E细胞线粒体进行染色,如图3B所示,正常对照组NRK52E 细胞中的线粒体表现为相互交联的网状,在PA 刺激下转化为短棒状或颗粒状,而ICA 处理组可增加线粒体的棒状结构。以上结果证明,ICA可抑制脂肪酸诱导的肾小管上皮细胞线粒体融合-分裂失衡。
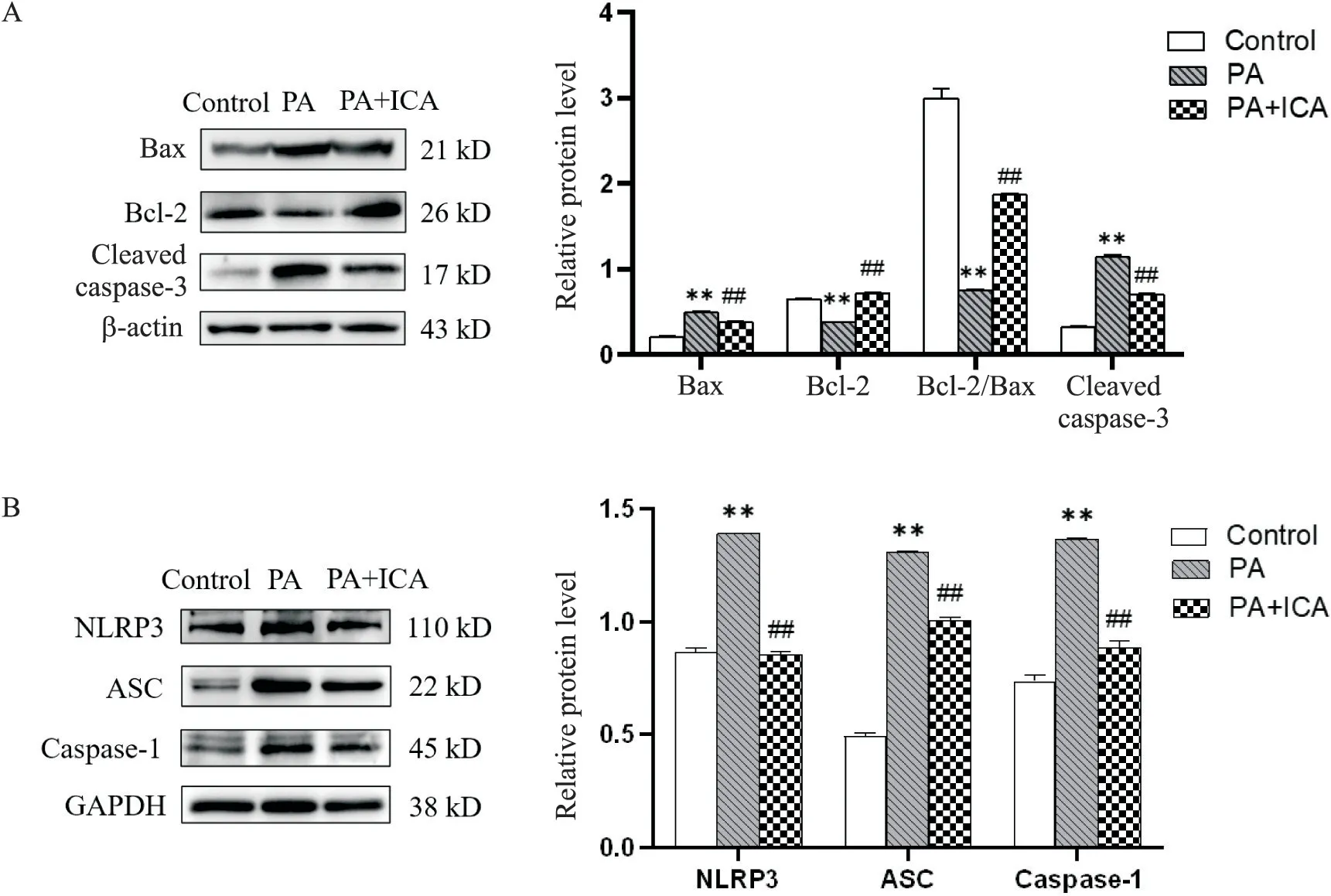
Figure 2.The effect of ICA on apoptosis and inflammatory response of NRK52E cells treated with PA.A:NRK52E cells were cul‑tured with PA and ICA for 48 h,and the protein levels of Bax,Bcl-2,Bcl-2/Bax,cleaved caspase-3 in NRK52E cells were determined by Western blot;B:NRK52E cells were cultured with PA and ICA for 48 h,and the expressions of NLRP3,ASC,caspase-1 in NRK52E cells were determined by Western blot.Mean±SD. n=3.**P<0.01 vs control group;##P<0.01 vs PA group.图2 ICA对PA处理的NRK52E细胞凋亡和炎症反应的影响
我们进一步采用JC-1 染色来观察ICA 对线粒体膜电位的影响。如图3C所示,PA刺激可以显著诱导NRK52E细胞内线粒体膜电位的下降,表现为与正常对照组相比,PA 刺激组细胞相对荧光强度比值(红色/绿色荧光)明显降低;而与PA 组相比,PA+ICA 组细胞相对荧光强度比值(红色/绿色荧光)升高。此外,我们检测了ICA 对细胞ROS 的影响,与对照组比较,PA 组ROS 的产生水平增加,与PA 组比较,PA+ICA 组ROS 的水平降低(P<0.01),见图3D。以上结果证明,ICA可抑制脂肪酸诱导的肾小管上皮细胞线粒体损伤及ROS的产生。
4 ICA 通过激活AMPK 减轻脂肪酸诱导的肾小管上皮细胞损伤
为了阐明ICA 维持线粒体功能发挥肾小管保护作用的机制,进行如下研究。
Western blot 检 测NRK52E 细 胞p-AMPKα 和AMPK 的蛋白水平,结果如图4A 所示。与对照组比较,PA 组p-AMPKα 的蛋白水平显著下调(P<0.01),与PA 组比较,PA+ICA 组p-AMPKα 的蛋白水平显著上调(P<0.01);而AMPK 的表达在各组无显著差异。表明ICA 可以激活AMPK 并促进其磷酸化。因此,在细胞培养基中加入10 μmol/L 的AMPK 抑制剂进一步验证其分子机制。Western blot 结果显示,与PA组比较,PA+ICA 组α-SMA、Drp1、NLRP3、ASC 和cas‑pase-1 的蛋白水平显著下调(P<0.01),E-cadherin 和MFN1 的蛋白水平显著上调(P<0.01)。与PA+ICA组比较,PA+ICA+AMPKi 组α -SMA、Drp1、NLRP3、ASC 和caspase-1 的蛋白水平显著上调(P<0.01),Ecadherin 和MFN1 的蛋白水平显著下调(P<0.01)。以上结果证明,ICA可通过激活AMPK抑制线粒体功能损伤和炎症反应,进而延缓脂肪酸诱导的肾小管上皮细胞间质纤维化的发生发展。
讨 论

Figure 3.ICA inhibited mitochondrial hyperdivision,the decrease in mitochondrial membrane potential and the production of ROS in fatty acid-induced renal tubular epithelial cells.A:NRK52E cells were cultured with PA and ICA for 48 h,and the ex‑pression of MFN1 and Drp1 in NRK52E cells was determined by Western blot;B:MitoTracker staining was used to ob‑serve the changes of mitochondrial morphology;C:ICA inhibited the decrease of mitochondrial membrane potential;D:ICA inhibited the production of ROS.Mean±SD. n=3.**P<0.01 vs control group;##P<0.01 vs PA group.图3 ICA抑制脂肪酸诱导的肾小管上皮细胞线粒体过度分裂、膜电位下降和ROS的产生

Figure 4.ICA attenuated fatty acid-induced renal tubular epithelial cell injury by activating AMPK.A:NRK52E cells were cultured with PA and ICA for 48 h,and the protein levels of AMPK and p-AMPKα in NRK52E cells was determined by Western blot;B:NRK52E cells were cultured with PA,ICA and AMPKi for 48 h,and the protein levels of E-cadherin and α-SMA in the cells were determined by Western blot;C:NRK52E cells were cultured with PA,ICA and AMPKi for 48 h,and the protein levels of Drp1 and MFN1 in the cells were determined by Western blot;D:NRK52E cells were cultured with PA,ICA and AMPKi for 48 h,and the protein levels of NLRP3,ASC,caspase-1 in the cells were determined by Western blot.Mean±SD. n=3.△△P<0.01 vs control group;**P<0.01 vs PA group;##P<0.01 vs PA+ICA group.图4 ICA通过激活AMPK减轻脂肪酸诱导的肾小管上皮细胞损伤
血脂异常在DN 的各阶段均有发生[13]。在糖尿病中,脂肪代谢紊乱使得大量脂质积累在非脂肪组织,导致脂质的异位沉积。研究表明,脂质在肾脏的异位蓄积可引起足细胞、肾小球系膜细胞和近端小管上皮细胞的结构和功能变化,导致上皮-间质转分化和细胞外基质沉积等,最后致肾实质破坏和肾功能丧失。线粒体功能障碍介导细胞损伤是导致糖尿病肾病肾小管损伤的关键因素之一。其中,线粒体融合和分裂在维持线粒体稳态平衡中发挥重要作用[14]。线粒体分裂可以影响线粒体自噬和细胞凋亡,但分裂过程改变了线粒体膜电位,继而削弱了ATP 的生成。线粒体融合可使细胞恢复正常功能,线粒体嵴数量增多,高效产生ATP,维持细胞生存[15-16]。AMPK 是参与生物能量代谢调节的关键因子。 据报道,糖尿病或肥胖症患者其肾组织中AMPK 表达减少;在1 型和2 型糖尿病模型鼠中,肾脏AMPK 的活性均受到抑制而AMPK 激活剂可以逆转糖尿病肾脏损伤[17]。研究表明,当细胞内AMP/ATP 的比值升高时AMPK 被激活,通过增强过氧化物酶体增殖活化受体γ 辅助活化因子1α 的转录活性,从而调控线粒体的生物合成和能量代谢,促进脂肪酸氧化[18-19]。线粒体既是细胞内ROS 产生的主要来源,同时又容易受到ROS 的攻击[20]。细胞内大约90% ROS 的产生来源于损伤的线粒体[21-22]。ROS 的产生增加可以诱导线粒体分裂,而线粒体分裂也可以促进ROS 产生[23]。有证据表明,损伤线粒体释放的ROS 可以促进NLRP3 蛋白的去泛素化,从而导致NLRP3炎症小体的激活[1]。
淫羊藿含有ICA 等黄酮类及木脂素类、苯酚苷类等多种组分[24]。其药理成分复杂并具有广泛的生物活性[25]。近年来,ICA对各种代谢性疾病的治疗作用已引起学者们的重视[26]。在链脲菌素诱导的糖尿病大鼠模型中,ICA能有效降低血液中血脂及果糖水平,同时延缓链脲菌素诱导的糖尿病视网膜病变[27]及糖尿病肾病的发生[28]。研究表明,ICA可通过诱导PGC-1α的表达激活AMPK,促进脂肪酸氧化,增加能量生成;可通过激活AMPK 抑制ROS 的产生,改善心肌细胞内外Ca2+和ATP 酶的活性,提高能量利用,从而发挥治疗心力衰竭的作用。但ICA 对糖尿病肾病的保护作用,其机制有待进一步阐明。我们研究发现,脂肪酸刺激下肾小管上皮细胞间质纤维化相关蛋白、凋亡蛋白、线粒体损伤蛋白和炎症因子的表达显著升高,ROS 的产生水平增加,线粒体过度分裂和线粒体膜电位下降,而ICA 能够逆转上述改变。然而,AMPK抑制剂的干预可以削弱ICA对脂肪酸刺激肾小管上皮细胞损伤的作用。AMPK 由一个催化亚单位α和两个调节亚单位β、γ构成[29],通常α亚基的172 位苏氨酸磷酸化具有激活形式。目前介导172位苏氨酸磷酸化的上游激酶有LKB1,CaMKKβ 及TAK1等[30]。而我们前期实验发现ICA可促进AMPK的磷酸化,但是否通过上述3 种激酶或其它方式发挥作用,尚有待进一步研究。
综上所述,ICA减轻脂肪酸所致肾小管上皮细胞的损伤,可能是通过激活AMPK 维持线粒体融合-分裂稳态及抑制ROS生成、炎症反应和细胞凋亡有关。不足的是,本研究未在动物水平阐明ICA 对DN 肾小管线粒体损伤的作用机制,仍有待进一步研究。
