瓜蒌皮提取物通过调控PI3K/AKT信号通路介导的自噬而减轻肥胖小鼠慢性炎症*
2022-02-16赵艳利康志强张晓珂
赵艳利, 毛 雨, 康志强, 何 丽, 张晓珂
(郑州大学附属郑州中心医院内分泌科,河南 郑州 450000)
肥胖是由于摄入过多能量或机体代谢异常而导致体内脂肪堆积过多的状态,是引起高脂血症、糖尿病和动脉粥样硬化等心血管疾病的重要原因,其发病机制与脂肪组织的慢性炎症密切相关[1]。细胞自噬是一种分解机制,可主动降解细胞内一些物质,对细胞内物质进行循环更新和维持内环境稳态具有重要作用。肥胖的发生可以使脂肪组织的自噬失调,而调节脂肪组织自噬可以有效抑制肥胖及其相关疾病的发展,且自噬对肥胖所致炎症反应有着重要的调控作用[2-4]。因此自噬在减轻肥胖者的脂肪组织炎症方面发挥着重要作用。
中药瓜蒌皮为葫芦科植物栝楼或双边栝楼等的果皮,富含多糖、黄酮和氨基酸等多种化学成分[5]。药理研究表明,瓜蒌皮具有抗炎、抗氧化、调节脂代谢、抗动脉粥样硬化及提升免疫力等作用[6-7]。瓜蒌皮注射液可有效减轻冠心病心力衰竭患者的症状,并显著降低不稳定性心绞痛患者血清炎症因子水平[8-9]。体外研究显示,瓜蒌皮提取物(Fructus Tricho⁃santhispeel extract,FTPE)可通过激活磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,PKB/AKT)信号通路抑制缺氧/复氧损伤诱导的心肌细胞凋亡[10]。PI3K/AKT 信号通路促进脂质生物合成并抑制脂肪分解,参与肥胖及其相关代谢疾病的病理生理学[11-12]。肥胖与脂肪组织中PI3K活性降低有关,激活PI3K可通过增加AKT的磷酸化来促进脂肪细胞分化[13-14]。且PI3K/AKT 通路可通过调控自噬的关键调节因子哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)参与包括肿瘤在内的一系列疾病的发生和进展[15]。然而,FTPE 是否能通过调控PI3K/AKT 介导的自噬减轻肥胖所致慢性炎症尚未见报道。因此,本研究通过高脂饲料建立肥胖小鼠模型,探讨FTPE 对肥胖小鼠脂肪组织慢性炎症的影响及作用机制。
材料和方法
1 材料
1.1 动物SPF 级8 周龄雄性C57BL/6J 小鼠60 只,体质量(20±2)g,购自湖南斯莱克景达实验动物有限公司[许可证号SCXK(湘)2019-0004],饲养在35%~40% 相对湿度、20~23 ℃及12 h 的明暗循环中,可随意获取水和食物。该研究遵守《实验动物的护理和使用指南》的指导原则,并获得了本院动物伦理委员会的批准,实验动物按照3R原则给予人道关怀。
1.2 试剂瓜蒌皮注射液(成分为FTPE,上海上药第一生化药业有限公司,国药准字Z20027540,规格:每支4 mL);LY294002(PI3K 抑制剂)购自MedChem‑Express;总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(high-densi‑ty lipoprotein cholesterol,HDL-C)和低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)检测试剂盒均购自南京建成生物工程研究所;肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素(interleukin,IL)-6、单核细胞趋化蛋白1(monocyte chemoattractant protein-1,MCP-1)和IL-10 ELISA 试剂盒均购自上海酶联生物有限公司;HE 染色试剂、RIPA 裂解液和BCA 试剂盒购自碧云天生物科技公司;兔抗小鼠PI3K、p-PI3K、AKT、p-AKT、mTOR 和pmTOR 均购自Thermo Fisher Scientific;兔抗小鼠微管相关蛋白1 轻链3(microtubule-associated protein 1 light chain 3,LC3)-I、LC3-II、beclin-1、P62 和GAPDH抗体及山羊抗兔IgG H&L(HRP)均购自Abcam。
1.3 仪器iMark680 多功能酶标仪和ChemiDoc XRS+凝胶成像仪(Bio-Rad);HT7700 透射电子显微镜(HITACHI)。
2 方法
2.1 肥胖模型的建立与分组适应性喂养7 d 后,随机选取10 只小鼠为对照(control)组,给予普通饲料喂养,其余小鼠采用高脂饲料(含60% 的脂肪)连续喂养12周,建立肥胖模型[16]。实验期间,每4周称量一次小鼠体质量。12 周末,给予高脂饲料喂养的小鼠体质量比普通饲料喂养的对照组小鼠体质量高20%,即肥胖度大于20%,视为肥胖模型构建成功[肥胖度(%)=(实验组实际体质量−对照组平均体质量)/对照组平均体质量×100%]。
取造模成功的50 只小鼠,分为模型(model)组、PI3K 抑制剂(LY294002,7.5 mg/kg[17])组、低剂量(2 mL/kg)FTPE(low-dose FTPE,FTPE-L)组、高剂量(4 mL/kg)FTPE(high-dose FTPE,FTPE-H)组[18]和FTPE+PI3K 抑制剂(4 mL/kg FTPE+7.5 mg/kg LY294002)组,每组10只。PI3K抑制剂组尾静脉注射PI3K抑制剂LY294002(溶于二甲基亚砜中),FTPE 各剂量组腹腔注射相应剂量的FTPE,FTPE+PI3K 抑制剂组在腹腔注射FTPE 的同时尾静脉注射LY294002,对照组和模型组给予等体积生理盐水注射,每天1 次,连续给药8周。
2.2 小鼠一般体征给药结束后,测定各组小鼠体质量和体长(鼻尖到肛门的长度),计算Lee 指数(衡量成年小鼠肥胖的有效指标),取小鼠腹股沟皮下脂肪组织并称重,计算腹股沟皮下脂肪质量百分比。Lee 指数=×1 000/体长(cm)。腹股沟皮下脂肪质量百分比(%)=腹股沟皮下脂肪组织湿重/体质量×100%。
2.3 小鼠血脂水平给药结束后,小鼠摘眼球取血,静置后以1 610×g离心15 min,分离血清,使用生化试剂盒检测血清TG、TC、LDL-C和HDL-C水平。
2.4 小鼠脂肪组织炎症因子水平取各组小鼠的部分脂肪组织,加预冷的生理盐水研磨,制备10% 的组织匀浆,离心取上清液。按照ELISA 试剂盒说明书检测匀浆中TNF-α、IL-6、MCP-1和IL-10水平。
2.5 HE 染色观察小鼠脂肪组织病理学变化取各组小鼠的部分脂肪组织,以4% 多聚甲醛固定,梯度乙醇脱水,二甲苯透明,石蜡包埋并切成4 μm 厚的切片,常规HE 染色,显微镜下观察各组小鼠脂肪组织病理学改变。
2.6 透射电子显微镜观察脂肪细胞超微结构与自噬状态 取各组小鼠的部分脂肪组织,剪碎成约1 mm×1 mm×1 mm 的小块,戊二醛溶液固定,磷酸盐缓冲液冲洗3 次后,在4 ℃下用1% 锇酸固定2 h。梯度丙酮脱水,浸透包埋,行超薄切片(约80~100 nm厚),乙酸铀酰和柠檬酸铅染色,电镜下观察脂肪细胞超微结构与自噬状态变化并拍照。
2.7 Western blot检测脂肪组织PI3K/AKT 通路和自噬相关蛋白的表达取200~300 mg 脂肪组织,RIPA裂解液提取组织中的总蛋白,4 ℃、12 000×g离心5 min,取上清,使用BCA法测定蛋白质浓度,变性后在每个孔上加35 μg蛋白质样品,进行SDS-PAGE,然后转移到PVDF膜上并用5% 脱脂牛奶密封1 h;将膜与Ⅰ抗(PI3K、p-PI3K、AKT、p-AKT、mTOR、p-mTOR、LC3-I、LC3-II、P62、beclin-1 和GAPDH,均以1∶1 000的比例稀释)在4 ℃下孵育过夜。次日洗去Ⅰ抗,加Ⅱ抗(1∶5 000,山羊抗兔IgG)在恒温振荡器上于室温下孵育2 h。然后用TBST 洗涤3 次,每次10 min,超灵敏ECL 化学发光试剂显色,在ChemiDoc XRS+凝胶成像仪上成像,通过软件读取和分析成像图像的灰度值,并通过与内参的灰度比,计算膜上目的蛋白质相对表达水平。
3 统计学处理
采用GraphPad Prism 8.0 和Image-Pro Plus 6.0软件对实验所得数据进行分析,结果以均数±标准差(mean±SD)表示。多组间比较采用单因素方差分析(one-way ANOVA),组间有差异进一步采用SNK-q检验进行两两比较。P<0.05为差异有统计学意义。
结 果
1 各组小鼠一般体征变化
与对照组相比,模型组小鼠体质量、Lee 指数和皮下脂肪质量百分比显著升高(P<0.05);与模型组相比,FTPE-L 和FTPE-H 组小鼠体质量、Lee 指数和皮下脂肪质量百分比显著降低(P<0.05),PI3K 抑制剂组小鼠上述指标显著升高(P<0.05);与PI3K 抑制剂组相比,FTPE+PI3K 抑制剂组小鼠上述指标显著降低(P<0.05);与FTPE-H 组相比,FTPE+PI3K 抑制剂组小鼠上述指标显著升高(P<0.05),见表1。

表1 各组小鼠一般体征变化Table 1.Changes in general signs of mice in each group(Mean±SD. n=10)
2 各组小鼠血脂水平的比较
与对照组相比,模型组小鼠血清中TG、TC 和LDL-C 水平显著升高,HDL-C 水平显著降低(P<0.05);与模型组相比,FTPE-L 和FTPE-H 组小鼠血清中TG、TC 和LDL-C 水平显著降低,HDL-C 水平显著升高(P<0.05),PI3K 抑制剂组小鼠血清中TG、TC和LDL-C 水平显著升高,HDL-C 水平显著降低(P<0.05);与PI3K 抑制剂组相比,FTPE+PI3K 抑制剂组小鼠血清中TG、TC 和LDL-C 水平显著降低,HDL-C水平显著升高(P<0.05);与FTPE-H 组相比,FTPE+PI3K 抑制剂组小鼠血清中TG、TC 和LDL-C 水平显著升高,HDL-C水平显著降低(P<0.05),见表2。

表2 各组小鼠血脂水平Table 2.Blood lipid levels of mice in each group(mmol/L.Mean±SD. n=10)
3 各组小鼠脂肪组织炎症因子水平的比较
与对照组相比,模型组小鼠脂肪组织中TNF-α、IL-6 和MCP-1 水平显著升高,IL-10 水平显著降低(P<0.05);与模型组相比,FTPE-L 和FTPE-H 组小鼠脂肪组织中TNF-α、IL-6 和MCP-1 水平显著降低,IL-10 水平显著升高(P<0.05),PI3K 抑制剂组小鼠脂肪组织中TNF-α、IL-6和MCP-1水平显著升高,IL-10水平显著降低(P<0.05);与PI3K 抑制剂组相比,FTPE+PI3K抑制剂组小鼠脂肪组织中TNF-α、IL-6和MCP-1 水平显著降低,IL-10 水平显著升高(P<0.05);与FTPE-H 组相比,FTPE+PI3K 抑制剂组小鼠脂肪组织中TNF-α、IL-6 和MCP-1 水平显著升高,IL-10水平显著降低(P<0.05),见表3。
4 各组小鼠脂肪组织病理学变化
对照组小鼠脂肪组织中脂肪细胞结构完整,大小正常;与对照组相比,模型组小鼠脂肪组织中脂肪细胞变大;与模型组相比,FTPE-L 和FTPE-H 组小鼠脂肪细胞较小,而PI3K 抑制剂组小鼠脂肪细胞进一步增大;FTPE+PI3K 抑制剂组小鼠脂肪细胞较PI3K抑制剂组呈变小趋势;与FTPE-H 组相比,FTPE+PI3K抑制剂组小鼠脂肪细胞变大,见图1。
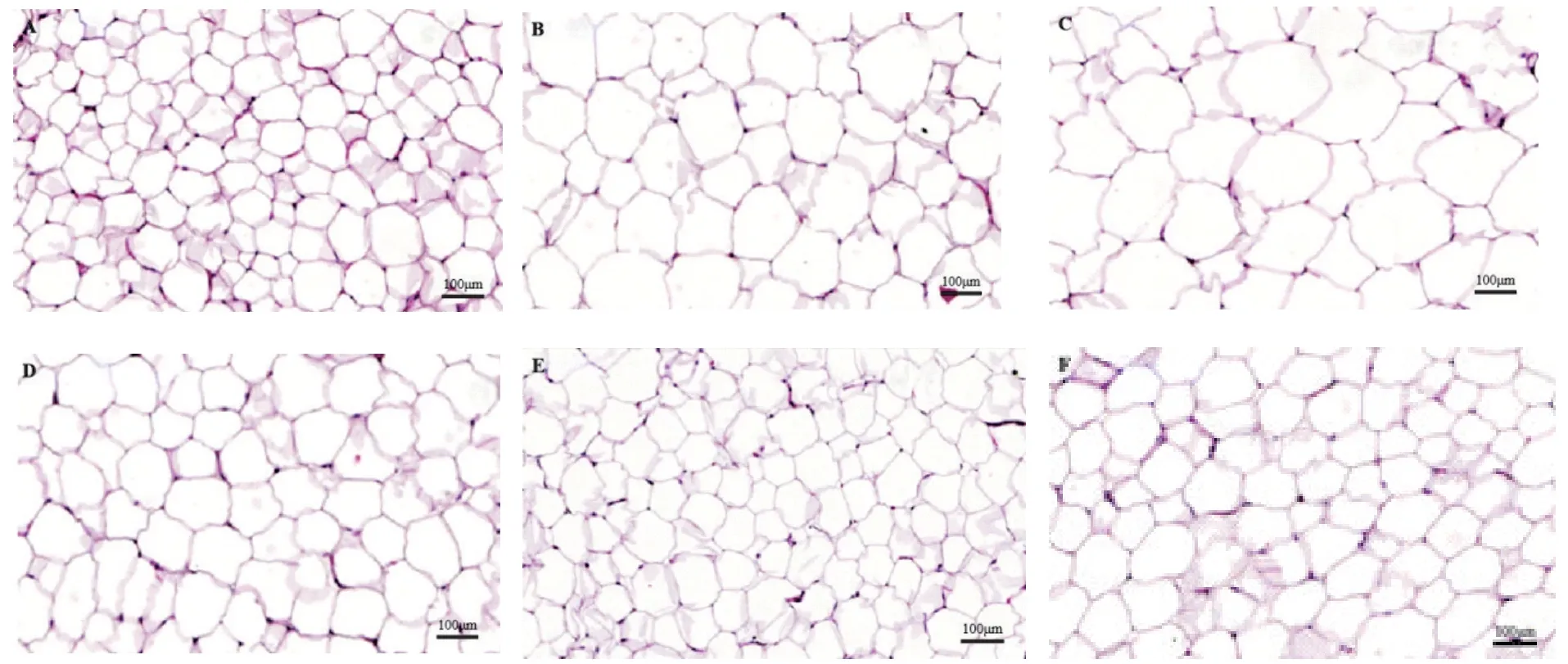
Figure 1.HE staining of the adipose tissues of mice in each group.A:control group,adipocytes had complete structure and normal size;B:model group,the size of adipocytes became larger;C:PI3K inhibitor group,the size of adipocytes further in‑creased;D:FTPE-L group,the size of adipocytes was small;E:FTPE-H group,the size of adipocytes was small;F:FTPE+PI3K inhibitor group,the size of adipocytes was larger.The scale bar=100 μm.图1 各组小鼠脂肪组织HE染色
5 各组小鼠脂肪细胞超微结构与自噬状态变化
对照组小鼠脂肪细胞结构完整,细胞器丰富;模型组小鼠脂肪细胞胞浆内有空泡,线粒体嵴破坏严重,出现解离现象,自噬小体较对照组明显增多;与模型组相比,FTPE-L 和FTPE-H 组小鼠脂肪细胞可见部分胞浆空泡,自噬小体数量减少,部分线粒体嵴破坏,而PI3K 抑制剂组小鼠脂肪细胞中自噬小体数量增多,线粒体嵴破坏加重;FTPE+PI3K 抑制剂组小鼠脂肪细胞自噬小体数量较PI3K 抑制剂组减少;与FTPE-H 组相比,FTPE+PI3K 抑制剂组小鼠脂肪细胞胞浆空泡数量和自噬小体数量均呈增加趋势,见图2、3。
6 各组小鼠脂肪组织自噬相关蛋白的表达比较
与对照组相比,模型组小鼠脂肪组织中LC3-II/LC3-I比值和beclin-1表达水平显著升高,P62表达水平显著降低(P<0.05);与模型组相比,FTPE-L 和FTPE-H 组小鼠脂肪组织中LC3-II/LC3-I 比值和be‑clin-1 表达水平显著降低,P62 表达水平显著升高(P<0.05),PI3K 抑制剂组小鼠脂肪组织中LC3-II/LC3-I比值和beclin-1表达水平显著升高,P62表达水平显著降低(P<0.05);与PI3K 抑制剂组相比,FTPE+PI3K 抑制剂组小鼠脂肪组织中LC3-II/LC3-I比值和beclin-1 表达水平显著降低,P62 表达水平显著升高(P<0.05);与FTPE-H 组相比,FTPE+PI3K 抑制剂组小鼠脂肪组织中LC3-II/LC3-I 比值和beclin-1表达水平显著升高,P62 表达水平显著降低(P<0.05),见图4。
7 各组小鼠脂肪组织PI3K/AKT 通路相关蛋白表达的比较
与对照组相比,模型组小鼠脂肪组织中p-PI3K/PI3K、p-AKT/AKT 和p-mTOR/mTOR 比值显著降低(P<0.05);与模型组相比,FTPE-L 和FTPE-H 组小鼠脂肪组织中p-PI3K/PI3K、p-AKT/AKT 和p-mTOR/mTOR 比值显著升高(P<0.05),PI3K 抑制剂组小鼠脂肪组织中p-PI3K/PI3K、p-AKT/AKT 和p-mTOR/mTOR 比值显著降低(P<0.05);与PI3K 抑制剂组相比,FTPE+PI3K 抑制剂组小鼠脂肪组织中p-PI3K/PI3K 和p-AKT/AKT 和p-mTOR/mTOR 比值显 著升高(P<0.05);与FTPE-H 组相比,FTPE+PI3K 抑制剂组小鼠脂肪组织中p-PI3K/PI3K、p-AKT/AKT 和pmTOR/mTOR比值显著降低(P<0.05),见图5。
讨 论

Figure 2.Ultrastructure of the adipocytes of mice in each group.A:control group,adipocytes had complete structure and abundant organelles;B:model group,autophagosomes increased significantly compared with control group;C:PI3K inhibitor group,the number of autophagosomes increased and the destruction of mitochondrial cristae was observed;D:FTPE-L group,the number of autophagosomes decreased and some mitochondrial cristae were destroyed;E:FTPE-H group,the number of autophagosomes decreased and some mitochondrial cristae were destroyed;F:FTPE+PI3K inhibitor group,the number of autophagosomes increased.The scale bar=0.1 μm.图2 各组小鼠脂肪细胞超微结构

Figure 3.Number of autophagosomes in the adipocytes of mice in each group.Mean±SD. n=10.*P<0.05 vs control group;#P<0.05 vs model group;△P<0.05 vs PI3K in‑hibitor group;▲P<0.05 vs FTPE-H group.图3 各组小鼠脂肪细胞自噬小体的数量
肥胖被认为是全球公共卫生的主要问题之一,自噬在人体许多疾病的发生和发展中发挥着重要的作用。近年来研究显示,自噬与肥胖、炎症三者之间可以相互影响,参与肥胖及其并发症的发生与发展[19]。但是,目前关于肥胖状态下脂肪细胞自噬的研究存在较大争议。一方面有研究者认为,脂肪细胞中自噬活性的增强可抑制炎性因子的分泌,发挥抗炎作用。如Jansen 等[20]的研究显示自噬活性在肥胖个体的脂肪组织中上调,在人和小鼠脂肪组织中使用3-甲基腺嘌呤抑制自噬可导致IL-1β、IL-6 和IL-8 mRNA 和蛋白表达显著增加;Yin 等[21-22]的研究也显示自噬的抑制导致棕榈酸酯诱导的脂肪细胞中MCP-1 和IL-6 表达进一步增加,应用雷帕霉素激活自噬可降低脂肪细胞炎性因子MCP-1和IL-6的表达和分泌。另一方面,有研究表明,肥胖时自噬活性与脂肪组织中炎性基因的表达呈正相关,自噬活动的增强可以促进炎因子分泌。如Kosacka 等[4]的研究显示,在肥胖和糖尿病患者中,脂肪细胞内积累着大量自噬小体,并且自噬增加与脂肪组织炎症一起发生;Laiglesia 等[23]的研究显示,Maresin 1 抑制3T3-L1 脂肪细胞中TNF-α 诱导的脂解和自噬而发挥抗炎作用。可见,自噬在肥胖中既可以发挥抗炎作用,又可以发挥促炎作用。
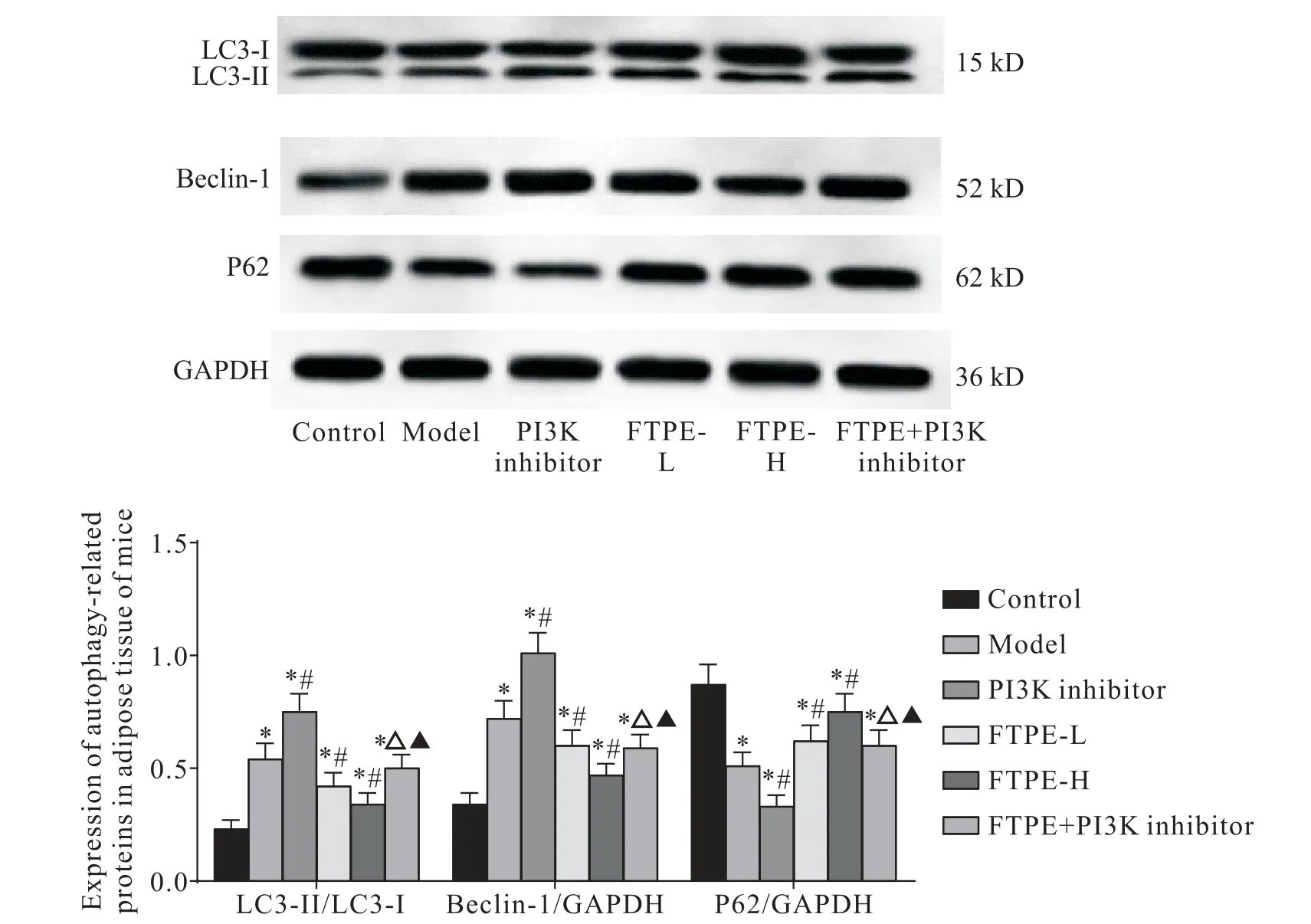
Figure 4.Expression of autophagy-related proteins in the adipose tissues of mice in each group.Mean±SD. n=10.*P<0.05 vs control group;#P<0.05 vs model group;△P<0.05 vs PI3K inhibitor group;▲P<0.05 vs FTPE-H group.图4 各组小鼠脂肪组织自噬相关蛋白的表达
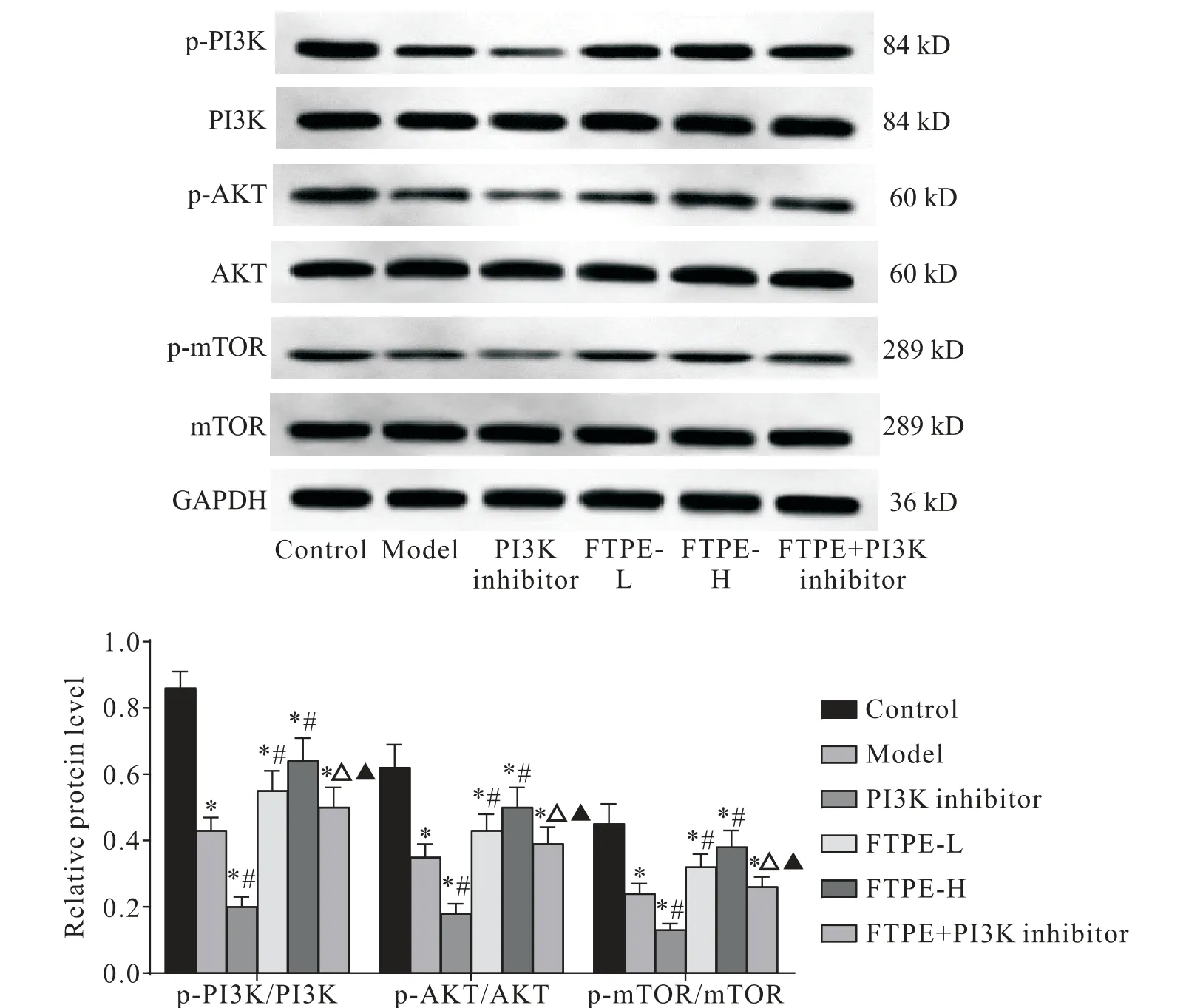
Figure 5.Expression of PI3K/AKT signaling pathway-related proteins in the adipose tissues of mice in each group.Mean±SD. n=10.*P<0.05 vs control group;#P<0.05 vs model group;△P<0.05 vs PI3K inhibitor group;▲P<0.05 vs FTPE-H group.图5 各组小鼠脂肪组织PI3K/AKT信号通路相关蛋白的表达
高脂饮食诱导的肥胖模型被广泛应用在肥胖的研究中。在本研究中,我们通过高脂饲料喂养小鼠成功构建肥胖模型,主要体现在模型小鼠的体质量、Lee指数、腹股沟皮下脂肪质量百分比及血脂水平均较对照组小鼠显著升高,且脂肪组织中脂肪细胞增大。以脂肪细胞肥大为主的脂肪组织会触发促炎因子的分泌,并导致肥胖引起的炎症;脂肪细胞较大的个体通常具有升高的促炎因子,包括IL-6、IL-8 和MCP-1,以及胰岛素敏感性相关脂联素和IL-10 水平的降低[22,24]。MCP-1 是涉及脂肪组织慢性炎症的关键因素。肥胖中MCP-1 水平升高与脂肪组织中M1型促炎巨噬细胞的积累有关;并且MCP-1 与肥胖中脂肪细胞过度表达的其他促炎细胞因子(如TNF-α和IL-6)协同作用,导致胰岛素敏感性降低[25]。IL-10是一种抗炎细胞因子,IL-10 缺乏会加重高脂饮食肥胖小鼠肾脏炎症、纤维化和功能衰竭[26]。ELISA 检测结果进一步显示模型组小鼠脂肪组织中促炎因子(TNF-α、IL-6 和MCP-1)水平升高,IL-10 水平降低,与以上研究结果一致,说明肥胖小鼠脂肪组织出现过度的炎症反应。而给予FTPE 干预后,肥胖小鼠的上述体征、血脂和促炎因子水平均降低,IL-10 水平升高,提示FTPE对肥胖具有一定的抑制作用。
肥胖与脂肪组织中自噬活性的增强有关。自噬活动和炎症之间存在复杂的双向关系。自噬途径诱导或抑制炎症反应,而炎症信号调节自噬通量。据报道,局部脂肪组织中的促炎细胞因子可以刺激脂肪细胞自噬,从而损害肥胖脂肪组织中TG 的储存[27]。本研究通过透射电镜观察脂肪细胞的超微结构,可见肥胖小鼠脂肪细胞中自噬活性增强;并且脂肪组织中PI3K/AKT 通路的活化受到抑制。而PI3K/AKT 通路在自噬和炎症中起关键作用:PI3K 是一类脂质激酶,AKT 是PI3K 途径的中心介质,PI3K 激活后可通过AKT 的磷酸化,进一步磷酸化下游的mTOR 及其他靶蛋白,从而介导炎症、自噬和凋亡等多种生物学效应[28]。在正常情况下,当PI3K/AKT 被激活时可以调节身体机能,当能量摄入过多时,PI3K/AKT 通路会被抑制;而激活PI3K/AKT 通路可减轻肥胖和胰岛素抵抗[11]。本研究结果与此一致,即肥胖小鼠能量摄入过多,PI3K/AKT 通路被抑制。给予FTPE 干预后,肥胖小鼠脂肪细胞内自噬小体的数量减少,且脂肪组织中p-PI3K/PI3K、p-AKT/AKT、p-mTOR/mTOR 比值和P62 表达水平升高,LC3-II/LC3-I比值及beclin-1 表达水平降低;而在FTPE 干预的基础上使用LY294002 抑制PI3K 信号通路后,脂肪细胞的自噬活性增强,促炎因子水平升高。这提示FTPE 可能通过激活PI3K/AKT/mTOR 通路,抑制脂肪细胞过度自噬,进而减轻肥胖小鼠的炎症反应。
综上所述,FTPE可减轻肥胖所致慢性炎症,其作用机制可能与激活PI3K/AKT/mTOR 通路,进而抑制脂肪细胞过度自噬有关。本研究结果支持自噬在肥胖中发挥促炎作用的观点,与Jansen等[20]的研究结果不一致,推测其原因可能与自噬的双重作用相关,即适度的自噬对机体具有保护作用,而过度的自噬会损害机体;此外,有研究显示肥胖者内脏脂肪细胞中的自噬活性显著高于皮下脂肪细胞,故脂肪组织的取材部位也可能是引起实验结果中自噬发挥不同作用的原因之一。这些问题尚待进一步的研究确认。
