壮通饮对缺氧/复氧诱导的HUVEC/U251细胞屏障损伤的影响*
2022-02-16王凯华赖思嘉李曼菲麻小梅梁慧荟杨鑫勇王亚南
李 岩, 王凯华△, 朱 亮, 赖思嘉, 李曼菲, 何 青,麻小梅, 梁慧荟, 杨鑫勇, 王亚南
(1广西中医药大学附属国际壮医医院脑病科,广西 南宁 530201;2广西中医药大学,广西 南宁 530200)
血脑屏障(blood-brain barrier,BBB)是由脑毛细血管内皮细胞、星形胶质细胞、周细胞以及基膜组成的血液与脑组织之间的屏障,在维持中枢神经系统的稳态方面发挥至关重要的作用[1]。已有研究证明,脑卒中、阿尔茨海默病、帕金森病和脑外伤等神经系统疾病患者的BBB 通透性会增加,导致脑组织炎症细胞浸润、脑水肿而进一步加重脑损伤[2]。许多中药通过改善血脑屏障通透性参与治疗脑神经相关性疾病[3]。 壮医经验方壮通饮(Zhuangtongyin,ZTY)由扶芳藤、参三七和黄花倒水莲3 味广西特色壮药配伍而成,具有抗血栓、抗凝血、抗炎及抗氧化等作用,有广泛临床用药基础,也常作为治疗脑梗死的经验药方[4]。前期研究发现ZTY 与西药联合使用降低了缺血性脑中风患者神经受损程度、提高生活自理能力,并无明显副反应[5],但机制尚不清楚。因此,本实验观察ZTY 对人脐静脉血管内皮细胞(hu‑man umbilical vein endothelial cells,HUVEC)和人星形细胞瘤U251 细胞共培养模型中紧密连接蛋白[tight junction proteins,TJPs;包括密封蛋白(clau‑dins)、闭合蛋白(occludin)、连接黏附分子(junctional adhesion molecules,JAMs)和闭锁小带蛋白1(zonula occuldens-1,ZO-1)]、基质金属蛋白酶(matrix metal‑loproteinases,MMPs)和内皮素1(endothelin-1,ET-1)的影响,研究ZTY 对缺氧/复氧诱导的BBB 损伤的作用及机制。
材料和方法
1 实验动物
8只8周龄雄性SD大鼠(体重250~300 g)来源于三峡大学,于无特定病原体(specific pathogen free,SPF)条件下饲养。饲养环境为温度22~26 ℃,相对湿度50%~60%,人工光照明暗各12 h。实验动物使用许可证号为SYXK(鄂)2018-0104,实验动物在武汉华联科生物技术有限公司屏障环境动物实验设施(No.00285918)饲养和实验,合格证号为No.42010200004170。所有动物实验均符合湖北省动物管理委员会《实验动物伦理证》的相关规定。
2 细胞与试剂
HUVEC来源于iCell;U251细胞来源中国科学院上海细胞库。戊巴比妥钠购自Sigma;ZTY 药材来自广西国际壮医医院民族药房;胎牛血清(fetal bovine serum,FBS)购自Gibco;PBS、胰蛋白酶、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、N,N,N',N'-四甲基乙二胺、过硫酸铵、RIPA(强)组织细胞快速裂解液和BCA 蛋白浓度测定试剂盒均购自Solarbio;低糖DMEM 购自HyClone;PVDF 转移膜和化学发光试剂均购自Millipore;蛋白Marker 购自Helix;兔抗clau‑din 3 抗体、兔抗JAM 抗体、兔抗occludin 抗体、兔抗ZO-1 抗体、兔抗ET-1 抗体和羊抗兔IgG 均购自武汉贝茵莱生物科技有限公司。
3 主要方法
3.1 ZTY 的制备[6]将扶芳藤30 g、黄花倒水莲25 g 和参三七10 g 去除杂质切制,加入生药材10 倍量的水浸泡60 min 后,用TC-15 套式恒温器250 V 电压加热煎煮,沸腾后将电压调低至150 V,微沸状态下煎煮1 h 后滤取煎液。药渣再加入生药材8 倍量的水,同法煎煮1 h 后滤取煎液。两次煎液混合后,于恒温水浴锅(100 ℃)蒸发去水分至浓稠状,转入恒温烘箱(60 ℃)干燥,获干浸膏,称重,收膏率为36.80%,4 ℃保存备用。临用前使用蒸馏水溶解浸膏至生药材含量为200 g/L。
3.2 ZTY 含药血清的制备将8 只SD 品系大鼠适应性喂养7 d 后,分为4 组:空白组及低、中、高剂量ZTY 组,每组2 只。空白组大鼠等体积蒸馏水灌胃。低、中、高剂量ZTY 组分别采用浓度为0.374 g/mL、0.748 g/mL 和1.496 g/mL 的ZTY 灌胃,10 mL/kg,连续7 d。最后一次灌胃2 h 后,用3% 戊巴比妥钠麻醉大鼠,腹主动脉取血,提取各组血清,于−70 ℃冻存。若发现动物未死亡,使用100 mg/kg 戊巴比妥钠麻醉至无心跳无呼吸后确定动物死亡。
3.3 细胞复苏及培养将冻存的细胞从液氮罐中取出后,37 ℃水浴融化后加入4 mL 完全培养基,500 r/min 离心3 min,弃上清,加入完全培养基,37 ℃、5% CO2的培养箱内培养。HUVEC 完全培养基为原代内皮细胞基础培养基+原代内皮细胞培养添加剂+5% FBS 和1% 双抗;U251细胞完全培养基为DMEM+10% FBS,细胞均按照1∶2~1∶3进行传代。
3.4 体外HUVEC/U251 细胞缺氧/复氧模型的建立[7-9]采用Transwell 系统共培养方法(图1),将2 mL U251 细胞接种到Transwell 小室的下室,37 ℃下培养24 h,待细胞达到60% 融合后,在Transwell 小室内侧接种HUVEC,于37 ℃培养24 h,直到显微镜观察2 种细胞达到高密度共培养。此时用跨内皮细胞电阻(transendothelial electric resistance,TEER)检测共培养细胞模型通透性的变化。TEER≥120 Ω 后把其中的培养基改为低糖DMEM 培养基,并在不含有氧气的培养环境(95% N2、5% CO2)中培养2 h后换成完全培养基于37 ℃、5% CO2培养箱内进行复氧培养2 h。
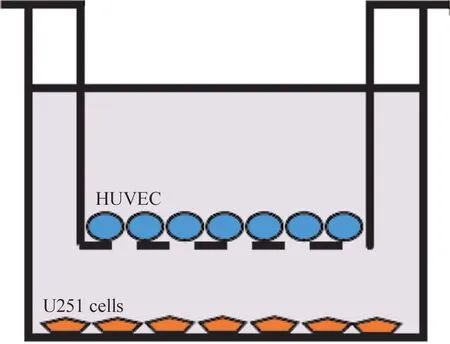
Figure 1.Co-culture of HUVEC and U251 cells with Transwell system.图1 Transwell系统共培养HUVEC和U251细胞
3.5 细胞分组各组细胞中添加不同的血清培养基37 ℃、5% CO2培养24 h。实验分组如下:(1)空白(control)组:共培养细胞模型+含10% 空白血清培养基;(2)模型(model)组:缺氧/复氧共培养细胞模型+含10% 空白血清培养基;(3)低剂量ZTY 组:缺氧/复氧共培养细胞模型+含10%低剂量ZTY血清培养基;(4)中剂量ZTY 组:缺氧/复氧共培养细胞模型+含10% 中剂量ZTY 血清培养基;(5)高剂量ZTY 组:缺氧/复氧共培养细胞模型+含10% 高剂量ZTY 血清培养基。
3.6 TEER 的检测[10]将电阻仪及筷子电极紫外灯消毒30 min,连接筷子电极至电阻仪,打开电阻仪开关,静置筷子电极,待筷子电极电阻值稳定后,弃去上下室培养基,用D-Hanks 溶液分别冲洗上下小室后,加入适量的D-Hanks 溶液使上下室液面持平。稳定后将筷子电极垂直插入Transwell 小室中,长的一侧电极插入下室,短的一侧电极插入上室,电极膜片置于液面下,不触碰小室,分别测量各孔不同位置的电阻值,重复3次,并记录显示屏上的电阻值(Ω),取平均值记为每孔的测量值。根据公式计算出实际电阻值:实际电阻值(Ω·cm2)=(实验孔测量值−空白孔测量值)×PET膜面积(cm2)。
3.7 Western blot 实验收集HUVEC,用预冷的1×PBS 洗涤细胞后,将细胞密度稀释为1×106/L,加入含有蛋白酶和磷酸酶抑制剂的裂解液200 μL,充分裂解后,取上清进行蛋白质定量。SDS-PAGE 分离后,90 V转膜50 min,5% 脱脂奶粉4 ℃封闭过夜,加Ⅰ抗(1∶1 000)室温孵育1 h,洗膜,加Ⅱ抗(1∶10 000),室温孵育1 h,洗膜。选用ECL 化学发光法显色,通过TANON GIS软件读取相关条带灰度值。
3.8 RT-qPCR 检测mRNA 表达收集HUVEC,用Trizol 法提取各组细胞总RNA,将mRNA 反转录成cDNA。以逆转录后cDNA 为模板进行qPCR 扩增。PCR 条件为:95 ℃预变性3 min;95 ℃变性5 s,56 ℃退火10 s,72 ℃延伸25 s,共40 个循环。β-actin 作为内参照进行样品间的校正,使用2−ΔΔCt法进行统计分析。引物序列见表1。
4 统计学处理
采用SPSS 23.0软件进行数据分析,实验数据均以均数±标准差(mean±SD)表示,单因素方差分析比较多组间差异,组间两两比较采用SNK-q检验,以P<0.05表示差异有统计学意义。
结 果
1 HUVEC/U251细胞的形态学观察
培养24 h 后,HUVEC 生长情况良好,呈卵圆形、多角形或梭形;U251 细胞密集生长,外形不规则,有较多突起,形成分支将彼此连接,见图2。
2 ZTY 减轻体外共培养HUVEC/U251 细胞屏障的损伤

Figure 2.The morphological observation of HUVEC and U251 cells(×200).图2 HUVEC和U251细胞的形态学观察
检测不同组共培养HUVEC/U251 细胞的TEER,结果见图3。与空白组相比,模型组细胞的TEER 显著降低[(177.78±10.64)Ω·cm2vs(70.71±12.62)Ω·cm2],表明模型组细胞的致密性及完整性遭到破坏,通透性增加,共培养HUVEC/U251 细胞屏障损伤模型建立成功;与模型组相比,细胞血清中添加不同剂量的ZTY 共培养后,其TEER 呈现上升趋势,低、中、高剂量ZTY组TEER与模型组相比差异均有统计学意义[(92.92±1.75)Ω·cm2vs(70.71±12.62)Ω·cm2;(115.15±9.09)Ω·cm2vs(70.71±12.62)Ω·cm2;(127.27±3.03)Ω·cm2vs(70.71±12.62)Ω·cm2]。
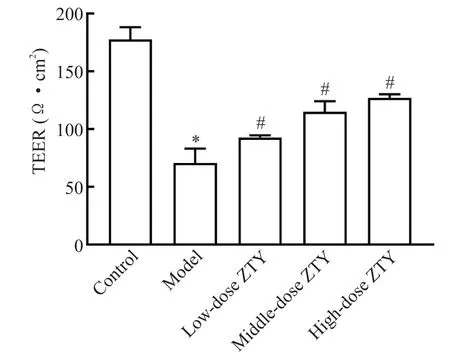
Figure 3.Effect of ZTY at different doses on transendothelial electric resistance (TEER) of co-cultured HUVEC/U251 cell barrier in vitro.Mean±SD. n=3.*P<0.05 vs control group;#P <0.05 vs model group.图3 不同剂量ZTY 对体外共培养HUVEC/U251 细胞屏障跨内皮细胞电阻的影响
3 ZTY 能够降低共培养HUVEC 中MMPs 及ET-1的mRNA水平
通过RT-qPCR 检测各组HUVEC 中MMPs 及ET-1 的mRNA 表达情况,结果如图4 所示。与空白组相比,模型组MMP2、MMP3、MMP9 和ET-1 的mRNA 表达水平均显著升高;细胞血清中添加不同剂量的ZTY 共培养后,MMP2、MMP3、MMP9 和ET-1 的mRNA 表达均呈剂量依赖性下降趋势。与模型组相比,低剂量ZTY 组HUVEC 中MMP2 和ET-1 的mRNA表达差异无统计学显著性(P>0.05),但MMP3 和MMP9 的mRNA 表达水平均显著降低(P<0.05),而中、高剂量ZTY 组HUVEC 中MMP2、MMP3、MMP9和ET-1的mRNA表达水平均显著降低(P<0.05)。
4 ZTY 对共培养HUVEC 中claudin 3、JAM、occludin、ZO-1和ET-1蛋白水平的影响
与空白组相比,模型组HUVEC 中claudin 3、JAM、occludin和ZO-1蛋白的相对表达量均显著降低(P<0.05),ET-1 蛋白的相对表达量显著升高(P<0.05);与模型组相比,中、高剂量ZTY 组HUVEC 中claudin 3、JAM、occludin 和ZO-1 蛋白的相对表达量显著升高(P<0.05),ET-1 蛋白的相对表达量显著降低(P<0.05),见图5和表2。

表2 Western blot检测claudin 3、JAM、occludin、ZO-1和ET-1的蛋白表达水平Table 2.The protein expression levels of claudin 3,JAM,occludin,ZO-1 and ET-1(Mean±SD. n=3)
讨 论
研究发现,脑缺血再灌注损伤导致微血管结构改变、BBB 结构及功能受损、脑内微环境失衡、脑水肿及缺血性脑损伤再发展[11-13]。由于BBB 结构较复杂,对其通透性的研究通常是通过建立体外共培养细胞模型而开展的,脑血管内皮细胞和星形胶质细胞的共培养模型应用较广泛[14]。本研究利用Tran‑swell系统共培养HUVEC 和U251细胞建立体外细胞屏障的缺氧/复氧模型,模拟体内BBB 损伤。与空白组相比,模型组细胞TEER 明显降低,表明模型建立成功。
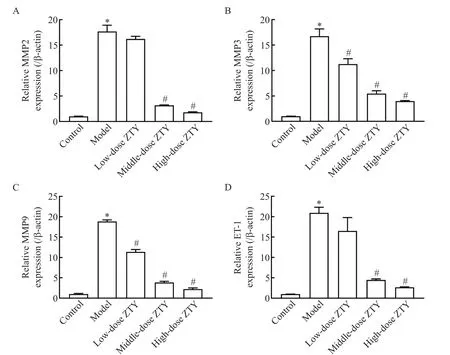
Figure 4.Effect of ZTY on the mRNA expression of MMPs and ET-1 in co-cultured HUVEC.A:relative mRNA expression of MMP2;B:relative mRNA expression of MMP3;C:relative mRNA expression of MMP9;D:relative mRNA expression of ET-1.Mean±SD. n=3.*P<0.05 vs control group;#P<0.05 vs model group.图4 ZTY对共培养HUVEC中MMPs及ET-1 mRNA表达水平的影响
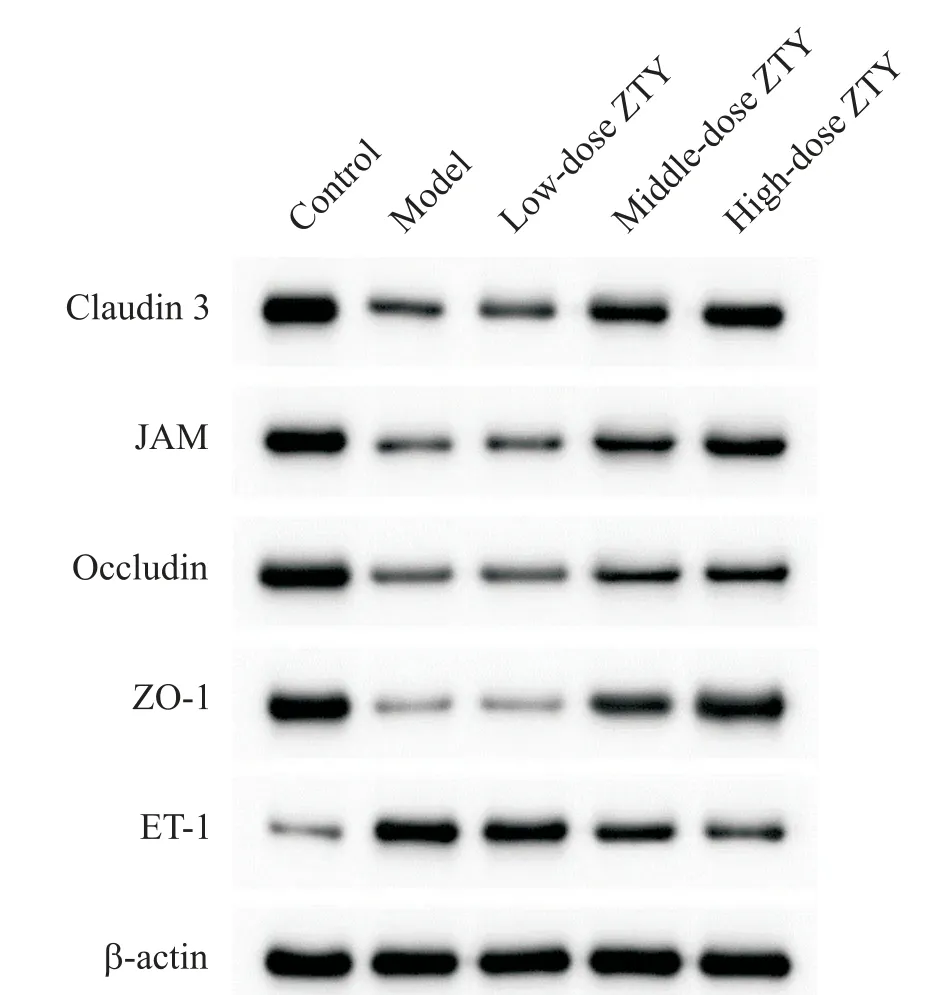
Figure 5.The representitive images of Western blot for deter‑mining the protein expression levels of claudin 3,JAM,occludin,ZO-1 and ET-1.图5 Western blot 检测claudin 3、JAM、occludin、ZO-1 和ET-1蛋白表达水平
TJPs是组成血脑屏障的结构及基础,由claudin、occludin 和JAM 三种跨膜蛋白及包浆附着蛋白(ZO-1、ZO-2 和ZO-3)等组成,以二聚体形式存在的跨膜蛋白与同型蛋白结合形成封闭链,将细胞间隙封闭起来,而附着蛋白则是跨膜蛋白和细胞骨架之间的连接蛋白,TJPs 的丢失是BBB 功能破坏的一个指标[15]。Li 等[16]构建了缺氧/复氧诱导的BBB 损伤模型,其结果显示,缺氧/复氧模型组TJPs(ZO-1和clau‑din-5)的表达显著减少,提示屏障完整性被破坏。MMPs 是多功能内肽酶,在大脑中对组织形成、神经元网络重塑和BBB 完整性至关重要[17]。在神经系统疾病中,MMPs可以分解基底膜的细胞外基质蛋白并降解TJPs,导致BBB 破坏[18]。王圆圆等[19]在研究瑞舒伐他汀对缺氧/复氧引起的脑微血管内皮细胞损伤的作用时,发现缺氧/复氧引起的脑微血管内皮细胞中MMPs(MMP-9 和MMP-2)表达均显著增加。本研究与上述研究结果类似,相比于空白组,体外细胞屏障缺氧/复氧模型组细胞中的TJPs 表达下调,MMPs 表达上调,表明缺氧/复氧可显著影响TJPs 和MMPs,导致BBB 通透性和功能发生改变。这再次证实TJPs 和MMPs 与细胞屏障功能紧密相关,模型组细胞屏障受损。
ET-1 是由21 个氨基酸组成的缩血管活性多肽,调节心血管收缩的重要因子[20]。ET-1可引发脑缺血性损伤[21],并且高浓度ET-1 与急性缺血性卒中的不良预后和高死亡率也密切相关[22]。ET-1在脑损伤中作用的研究较多。Armstead 等[23]的研究表明,脑卒中后ET-1 和c-Jun 氨基末端激酶表达上调促使白细胞介素6 大量释放,破坏脑血管自动调节功能,加剧组织病理进展。Ronaldson 等[24]发现,ET-1 与G 蛋白偶联受体ETB结合,使酪氨酸激酶磷酸化,激活PI3K/Akt 及p42/p44 MAPK 通路,促使诱导型一氧化氮合成酶表达并合成NO,进一步硝化酪氨酸而激活MMP9,促使BBB 结构受损并加剧脑水肿。ETA/ETB非选择性拮抗剂能缓解创伤性脑损伤小鼠的BBB 破坏和脑水肿[25-26]。这均表明ET-1 可作为脑缺血损伤的标志物。我们的实验发现,缺氧/复氧损伤后ET-1蛋白表达显著升高,给予中、高剂量ZTY 治疗后,模型组BBB通透性降低,表现为细胞中TJPs表达上调,MMPs 表达下调;此外,中、高剂量ZTY 可降低ET-1蛋白表达。低剂量ZTY 未改变缺氧/复氧后BBB 细胞通透性,但细胞中ET-1、MMP3 及MMP9 的表达降低。本研究结果表明,缺氧/复氧损伤发生后,TJPs表达下调,MMPs 表达上调,提示细胞屏障通透性增加;同时ET-1 表达上调;而ZTY 可上调TJPs、下调MMPs 并降低ET-1 蛋白水平,说明ZTY 通过调节TJPs、MMPs 和ET-1 表达,改善细胞屏障的通透性,减轻缺氧/复氧引起的细胞屏障损伤。
本研究初步确定ZTY 可通过抑制ET1 和MMPs表达、上调TJPs 表达而减轻缺氧/复氧体外共培养细胞屏障的损伤,但MMPs 和TJPs 的排列方式与细胞屏障功能的作用机制尚有待进一步研究。
