G蛋白偶联受体75信号通路在20-羟二十烷四烯酸诱导乳鼠心肌细胞凋亡中的作用*
2022-02-16刘娇莉吉雨恬郭立荣
刘娇莉, 吉雨恬, 毛 凌, 郭立荣, 韩 勇
(遵义医科大学生理学教研室,贵州 遵义 563000)
20-羟二十烷四烯酸(20-hydroxyeicosatetraenoic acid,20-HETE)是由花生四烯酸经细胞色素P450 酶途径的CYP4A/4F 酶催化ω-羟基代谢生成的血管活性脂[1]。近年研究表明,20-HETE与多种心脏疾病的发生、发展密切相关,如冠心病、心肌梗死和心肌缺血再灌注损伤和心肌肥大等[2],但20-HETE 引起心肌损伤的受体机制尚不清楚。
G 蛋白偶联受体75(G-protein-coupled receptor 75,GPR75)是G 蛋白偶联受体(G-protein-coupled re‑ceptors,GPCRs)家族一员,发现以来一直被列为孤儿受体[3]。在人血管内皮细胞及大鼠主动脉平滑肌细胞中的研究中发现,20-HETE 与GPR75 具有高亲和性,且20-HETE 通过绑定并激活GPR75 从而影响血管功能并引发高血压[4],提示GPR75 可能是20-HETE发挥心血管活动调节的作用受体。然而,在心肌细胞中是否同样存在20-HETE-GPR75 配对机制,并介导20-HETE 的心肌损伤作用,尚鲜有研究。我们既往观察到GPR75在大鼠H9c2心肌细胞中表达,且敲减GPR75后抑制了20-HETE 诱导的H9c2 心肌细胞凋亡[5]。在此研究基础上,本文拟在原代培养乳鼠心肌细胞中,进一步探索GPR75 及其介导的信号通路在20-HETE 诱导心肌细胞凋亡中的作用机制。
材料和方法
1 动物
SD 大鼠的新生1~3日龄乳鼠购自长沙市天勤生物技术有限公司,许可证号为SCXK(湘)2019-0014。本实验经遵义医科大学实验动物伦理委员会同意,符合中国国家实验动物伦理的相关规定。
2 主要试剂
20-HETE 购自Cayman Chemical;慢病毒包装试剂盒购自GeneCopoeia;U73122、2-氨基乙氧基二苯基硼酸酯(2-aminoethoxydiphenyl borate,2-APB)、GF109203X 和apocynin 购自MCE;兔抗GPR75 抗体和小鼠抗细胞色素C(cytochrome C,CytC)抗体购自CST;小鼠抗caspase-3 抗体购自Abcam;抗β-actin 抗体及辣根过氧化物酶(horseradish peroxidase,HRP)标记的Ⅱ抗购自Proteintech;逆转录试剂盒及荧光SYBR Green I 购自TaKaRa;TUNEL 细胞凋亡检测试剂盒、钙荧光探针Fluo-3/AM 和二氢乙啶(dihy‑droethidine,DHE)荧光探针购自北京索莱宝生物科技有限公司;ELISA试剂盒购自江莱生物。
3 主要方法
3.1 心肌细胞的原代培养按照本实验室前期建立的方法进行原代SD 乳鼠心肌细胞体外培养[6]。0.25%胰蛋白酶及Ⅱ型胶原酶在37 ℃磁力搅拌恒温水浴锅中重复消化SD 大鼠新生1~3 d 乳鼠心脏组织,200 ×g离心10 min 收集细胞沉淀,加入含15% 胎牛血清、青霉素和链霉素(1×105U/L,0.1 mg/L)的DMEM/F12 培养液于5% CO2培养箱中37 ℃条件下培养90 min,利用差速贴壁法将分离的心肌细胞悬液加入5‑溴脱氧尿嘧啶核苷(100 μmol/L)置于37 ℃、5% CO2培养箱中培养。
3.2 慢病毒重组载体转染参考我们已报道的方法进行慢病毒转染[5]。GPR75shRNA(shGPR75)的靶向序列为:5'-CCCTATCCCTTCTGTTTAATA-3'。shControl 靶向序列为:5'-ACAGAAGCGATTGATC-3'。在培养的心肌细胞融合度为60%~70% 时,将滴度为1×1011TU/L的慢病毒重组载体shGPR75和相应空载体shControl 转染至心肌细胞,于37 ℃、5% CO2培养箱中培养24 h,RT-qPCR 和Western blot 检测转染效率。
3.3 实验分组shControl转染对照组(control组)与慢病毒转染组(shGPR75 组)细胞在相同条件下培养24 h 后,开展后续实验。培养的乳鼠心肌细胞使用20-HETE(100 nmol/L)孵育处理24 h(20-HETE 组),其他组别细胞依据不同实验目的,在20-HETE 处理前1 h,参考相关文献分别加入不同浓度的预处理药物:U73122(1 μmol/L)、2-APB(100 μmol/L)、GF109203X(1 μmol/L)和apocynin(100 μmol/L)进行药物干预,培养24 h后收集细胞进行相关指标检测。
3.4 RT-qPCR检测GPR75 mRNA 表达水平Trizol法提取细胞总RNA,逆转录合成cDNA 进行实时荧光定量实验,GPR75 的上游引物序列为5'-GCCA‑CAAGCCTGGTCTACAAA-3',下游引物序列为5'-GT‑GCTCTGGTGCCTGCGATAC-3';GAPDH 的上游引物序列为5'-TCTCTGCTCCTCCCTGTTC-3',下游引物序列为5'-ACACCGACCTTCACCATCT-3'。反应条件为:94 ℃30 s;94 ℃5 s,60 ℃30 s,共40个循环。实验结果以GAPDH 作为内参照,采用2−ΔΔCt进行结果分析。
3.5 Western blot 检测GPR75、CytC 和caspase-3 蛋白水平各分组细胞经不同药物处理后,RIPA 裂解液裂解细胞提取细胞总蛋白,采用BCA 法测定蛋白浓度,取等量蛋白进行SDS-PAGE,转膜后封闭,分别加入兔抗GPR75 多克隆抗体(1∶300)、小鼠抗Cyt C抗体(1∶300)、小鼠抗caspase-3 抗体(1∶500)和小鼠抗β-actin 单克隆抗体(1∶2 000),4 ℃孵育过夜,再加入抗小鼠HRP-IgG(1∶5 000)及抗兔HRP-IgG(1∶5 000)Ⅱ抗,室温孵育1 h,ECL 法显影,采用ImageJ 1.48软件分析目标蛋白及内参照的灰度计算蛋白表达相对含量。
3.6 ELISA 法检测三磷酸肌醇(inositol triphos‑phate,IP3)含量及蛋白激酶C(protein kinase C,PKC)和NADPH 氧化酶活性按照厂商提供的ELISA 试剂盒说明书操作,各组细胞取等量蛋白提取液,加入所对应的HRP 标记的检测抗体,37 ℃孵育1 h 后洗板5 次,加底物显色剂后避光孵育15 min,最后加入终止液停止反应,在酶标仪450 nm 波长下测各孔吸光度(A)值。绘制线性标准曲线,计算细胞内IP3含量以及PKC和NADPH氧化酶活性。
3.7 Fluo-3/AM 法检测Ca2+含量将细胞接种于共聚焦皿,药物处理后,加入5 %的Pluronic F‑127 及Fluo‑3/AM(5 μmol/L)荧光探针37 ℃避光孵育50 min,激光共聚焦显微镜观察,激发波长488 nm、发射波长525 nm 下产生绿色荧光,ZEN 2.3 软件分析平均绿色荧光强度。
3.8 DHE 荧光探针检测活性氧簇(reactive oxygen species,ROS)含量将细胞接种于共聚焦皿,药物处理后,加入DHE 荧光探针37 ℃避光孵育40 min,激光共聚焦显微镜观察,激发波长510 nm、发射波长580 nm 下产生红色荧光,采用ZEN 2.3 软件分析平均红色荧光强度。
3.9 TUNEL染色检测细胞凋亡4% 多聚甲醛固定各分组细胞,TUNEL 工作液37 ℃避光孵育1 h,DAPI溶液避光复染细胞核,抗荧光衰减剂封片。荧光显微镜下随机挑选5个200倍视野,统计每个视野中的凋亡细胞数目(绿色荧光)与总细胞数目(蓝色荧光)的比值即为凋亡率。
4 统计学处理
用SPSS 17.0 统计软件进行分析。数据均采用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析(one-way ANOVA),组间两两比较采用最小显著性差异法(LSD 法)。以P<0.05 为差异有统计学意义。
结 果
1 敲减GPR75 及20-HETE 对乳鼠心肌细胞GPR75表达影响
与control 组相比,慢病毒shGPR75 转染组乳鼠心肌细胞内GPR75 的mRNA 表达水平降低(P<0.05);使用20-HETE(100 nmol/L)处理乳鼠心肌细胞24 h 后,GPR75 mRNA 水平较control 组升高(P<0.05)。与mRNA 表达一致,shGPR75 组GPR75 蛋白表达亦较control 组显著降低(P<0.05);经20-HETE处理后,细胞内GPR75 蛋白表达水平显著升高(P<0.05),见图1。
2 敲减GPR75 及磷脂酶C(phospholipase C,PLC)抑制剂U73122 对20-HETE 诱导心肌细胞内IP3生成的影响
ELISA 检测结果显示,与control 组相比,乳鼠心肌细胞使用20-HETE 处理后,细胞内IP3含量升高(P<0.05);与20-HETE 组相比,敲减GPR75或应用PLC 抑制剂U73122 处理可显著抑制20-HETE 诱导IP3生成的作用(P<0.05);与control组相比,shGPR75组和U73122组IP3无显著改变(P>0.05),见图2。
3 敲减GPR75 及U73122、IP3 受体(IP3 receptor,IP3R)阻断剂2-APB 对20-HETE 诱导的细胞内Ca2+浓度的影响

Figure 1.Effects of GPR75 knockdown or 20-HETE administration on mRNA and protein expression of GPR75 in NRCMs.Mean ±SD. n = 4.*P < 0.05 vs control group;#P< 0.05 vs 20-HETE group.图1 敲减GPR75及20-HETE对乳鼠心肌细胞GPR75表达的影响

Figure 2.Effects of GPR75 knockdown or PLC inhibitor U73122 administration on the 20-HETE-induced IP3 production in NRCMs.20 ‑ HETE-treated induced a significant increase in IP3 production.Knockdown of GPR75 or pre-treatment with U73122 blocked the ef‑fects of 20-HETE-indeuced IP3 production.Mean±SD. n=4.*P< 0.05 vs control group;#P< 0.05 vs 20-HETE group.图2 敲减GPR75 及U73122 对20-HETE 诱导心肌细胞内IP3生成的影响
激光共聚焦检测结果显示,与control 组相比,20-HETE 处理组乳鼠心肌细胞内Ca2+浓度([Ca2+]i)升高(P<0.05);而敲减GPR75或应用PLC 抑制剂U73122处理可显著抑制20-HETE 诱导Ca2+浓度升高效应(P<0.05);此外,与20-HETE 组相比,IP3R 阻断剂2-APB 预处理亦可减少细胞内Ca2+浓度(P<0.05);与control 组相比,单独shGPR75 组、U73122组 以 及2-APB 组[Ca2+]i无显著变化(P>0.05),见图3。
4 敲 减GPR75 及PKC 抑制剂GF109203X、NADPH 氧化酶抑制剂apocynin 对20-HETE 诱导ROS生成的影响
DHE 荧光染色结果显示,与control 组相比,20-HETE 处理组乳鼠心肌细胞内ROS 含量显著升高(P<0.05);而敲减GPR75或应用PKC抑制剂GF109203X 处理可显著抑制20-HETE 诱导细胞内ROS 生成(P<0.05);此外,与20-HETE 组相比,应用NADPH 氧化酶抑制剂apocynin 后,细胞内ROS 生成亦减少(P<0.05);与control 组相比,单独shGPR75组、GF109203X 组以及apocynin 组ROS 含量均无显著改变(P>0.05),见图4。
5 敲减GPR75 对20-HETE 诱导心肌细胞PKC 及NADPH氧化酶活性的影响
ELISA 检测结果显示,与control 组相比,20-HETE处理组乳鼠心肌细胞内PKC和NADPH氧化酶活性均显著升高(P<0.05);而敲减GPR75后,20-HETE诱导的心肌细胞内PKC和NADPH氧化酶活性显著降低(P<0.05);shGPR75 组与control 组相比,PKC 和NADPH 氧化酶活性无显著差异(P>0.05),见图5。

Figure 3.Effects of knockdown of GPR75,pre-treatment with PLC inhibitor U73122 or IP3R inhibitor 2-APB on the 20-HETE-in‑duced increase of [Ca2+]i in NRCMs by Fluo-3/AM staining.Mean ± SD. n= 4.*P<0.05 vs control group;#P<0.05 vs 20-HETE group.图3 敲减GPR75及U73122、2-APB预处理对20-HETE诱导心肌细胞内Ca2+浓度的影响
6 敲减GPR75 及U73122、GF109203X 对20-HETE诱导心肌细胞凋亡的影响
TUNEL 检测结果显示,与control 组相比,20-HETE 处理组心肌细胞凋亡率显著增加(P<0.05);同时,Western blot结果显示,20-HETE 组心肌细胞凋亡相关蛋白CytC 以及caspase-3 蛋白表达显著升高(P<0.05);而敲减GPR75表达则显著抑制了20-HETE的如上作用(P<0.05);同时,使用U73122阻断PLC 信号通路或者使用GF109203X 阻断PKC 信号通路后,20-HETE 诱导的心肌细胞凋亡和CytC、cas‑pase-3 蛋白表达均被抑制(P<0.05);与control 组相比,单独shGPR75 组、U73122 组或GF109203X 组心肌细胞凋亡率、CytC 和caspase-3 蛋白表达水平均无显著改变(P>0.05),见图6。
讨 论
GPR75 受体自发现以来一直被列为孤儿受体[3],在对其进行去孤儿化的研究中,有学者[7-9]首先报道炎性趋化因子CCL5具有激活GPR75受体作用,并通过该受体参与神经细胞功能保护以及胰岛素分泌等作用,但如上研究并未提供CCL5与GPR75受体直接绑定的实验证据。Garcia 等[4]报道在人内皮细胞及大鼠平滑肌细胞中,20-HETE 可通过激活并绑定GPR75 受体影响血管功能并引发高血压。随后Cárdenas 等[10]和Gilani 等[11]分别在前列腺癌PC-3 细胞和3T3-1 分化的脂肪细胞中,同样观察到20-HETE-GPR75 受体配对机制,并在肿瘤细胞恶性转化、胰岛素的合成与分泌等方面发挥重要作用。在最新的一项研究中,Pascale 等[12]进一步报道了20-HETE 是GPR75 受体的高亲和力配体,而CCL5 则起到抑制20-HETE 激活GPR75 受体信号通路的作用。如上研究提示20-HETE可能是GPR75受体的天然配体,但尚需在多种组织器官中加以证实。心脏是20-HETE 发挥生理、病理调节作用的重要器官,但心肌组织中是否表达GPR75受体并介导20-HETE的生物作用,目前鲜有报道。

Figure 4.Effects of GPR75 knockdown,PKC inhibitor GF109203X or NADPH oxidase inhibitor apocynin on 20-HETE-induced ROS generation in NRCMs(DHE staining).Mean±SD. n=4.*P<0.05 vs control group;#P<0.05 vs 20-HETE group.图4 敲减GPR75及GF109203X、apocynin对20-HETE诱导的心肌细胞ROS生成的影响
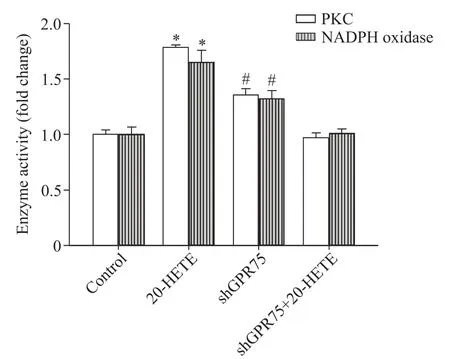
Figure 5.Effects of GPR75 knockdown on activity of PKC and NADPH oxidase in NRCMs induced by 20-HETE.Mean±SD. n=4.*P<0.05 vs control group;#P<0.05 vs 20-HETE group.图5 敲减GPR75 对20-HETE 诱导的心肌细胞内PKC 及NADPH氧化酶活性的影响

Figure 6.Effects of knockdown of GPR75,PLC inhibitor U73122 or PKC in hibitor GF109203X on 20-HETE-induced apoptosis in NRCMs.A:representative images of TUNEL staining;B:bar graph representing percentages of apoptotic cells;C:the pro‑tein levels of Cyt C and caspase-3 detected by Western blot.Mean±SD. n=5.*P<0.05 vs control group;#P<0.05 vs 20-HETE group.图6 敲减GPR75及U73122、GF109203X对20-HETE诱导的心肌细胞凋亡的影响
我们既往及本研究观察到,在大鼠H9c2 细胞和乳鼠心肌细胞中,GPR75 受体在mRNA 及蛋白水平表达,且20-HETE 孵育后可显著促进培养的乳鼠心肌细胞中GPR75的表达。当采用慢病毒转染方法敲减GPR75表达后,显著抑制了20-HETE 诱导的心肌细胞凋亡。应用慢病毒载体转染方法进行干扰RNA基因表达,相比于传统的转染试剂法、电穿孔法和脂质体法等转染细胞,该方法具有感染广泛、基因组整合稳定、转移基因可长期表达等特点[13]。有比较研究表明,对于心肌细胞采用病毒载体进行基因干扰相比于其他方法更为高效和稳定[14]。Consonni 等[15]在培养的乳鼠心肌细胞中报道,采用慢病毒转染干扰基因表达可防止心肌细胞超微结构及功能损伤。因此,本研究采用了慢病毒转染降低乳鼠心肌细胞GPR75基因表达,观察其对20-HETE 诱导的心肌细胞凋亡作用的影响。
GPR75被激活后可活化与其偶联的Gαq蛋白,后者经细胞膜PLC 水解磷脂酰肌醇4,5 二磷酸生成细胞内重要第二信使—IP3,并最终激活细胞内相关信号通路[4,16]。因此,细胞内IP3累积被认为是GPCRs激活的重要标志物。本研究观察到20-HETE 具有促进细胞内IP3生成的作用,且敲减GPR75表达或者使用U73122 抑制PLC 作用均可阻断20-HETE 的该效应,提示在心肌细胞中20-HETE 具有激活GPR75 德作用。但是,后续研究中需要深入观察20-HETE 对GPR75受体的内化激活、招募β-arrestin、下游信号激酶的磷酸化等方面的作用,以进一步确定20-HETE与GPR75在心肌细胞中的配对机制。
IP3生成增加还可激活细胞内IP3受体门控通道引起肌浆网内Ca2+释放,导致Ca2+调控紊乱从而诱发细胞内钙超载[17]。Ca2+在心肌细胞的功能与代谢活动中发挥关键性的调节作用,Ca2+调控的稳态失衡不仅影响心肌细胞收缩、舒张功能,且由其引发的钙超载是心肌损害的最终通路[18]。我们之前的研究曾报道,20-HETE 具有升高心肌细胞[Ca2+]i的作用,是诱导心肌细胞凋亡继而造成缺血性心肌损伤的重要机制[6,19]。在本研究中观察到,敲减GPR75表达、阻断PLC 信号通路或者抑制IP3R 受体作用后,20-HETE诱导的心肌细胞内[Ca2+]i升高效应均被显著逆转,提示20-HETE-GPR75 受体配对在造成心肌细胞钙超载继而诱导细胞凋亡方面发挥重要作用,其机制与GPR75 受体激活后介导的PLC/IP3/Ca2+信号通路密切相关。
活性氧簇(reactive oxygen species,ROS)过量生成是诱导心肌细胞凋亡、加重心肌损伤的另一重要因素。ROS 的过量生成将引起细胞发生氧化应激反应,导致细胞内多种亚细胞成分过氧化损伤,如降解膜磷脂,攻击蛋白质及损伤DNA,最终引起细胞凋亡,而且由于心肌组织中缺乏抗氧化酶,其对于ROS的敏感性要高于其他组织器官[20-21]。NADPH 氧化酶是促进心肌细胞内ROS 生成的重要来源[22],且我们前期研究观察到,在大鼠离体心肌缺血再灌注损伤(myocardial ischemia reperfusion injury,MIRI)模 型中,20-HETE 可通过激活NADPH 氧化酶途径诱导细胞内ROS过量生成,从而诱导心肌细胞凋亡,最终加重再灌注后心肌梗死面积的发生[23]。另外一项研究表明,在培养乳鼠心肌细胞中,20-HETE 通过PKC 依赖机制激活NADPH 氧化酶从而诱导ROS生成[19];此外,20-HETE 还可通过诱导ROS 生成参与血管紧张素Ⅱ诱导的心肌细胞凋亡[24]。与上述研究一致,在本实验中观察到,应用PKC 抑制剂GF109203X 或者NADPH 氧化酶抑制剂apocynin 预处理均可减少20-HETE 诱导的细胞内ROS 生成。而敲减GPR75表达后,除细胞内ROS 生成显著减少外,20-HETE 诱导的PKC 以及NADPH 氧化酶活性亦显著降低。如上结果提示,20-HETE 可通过GPR75 受体发挥促细胞内ROS 生成作用,其机制与GPR75 受体介导的PKC/NADPH/ROS 信号通路有关。最后,本实验还观察到敲减GPR75表达、应用PLC 抑制剂U73122 以及PKC抑制剂GF109203X处理可显著抑制20-HETE诱导的乳鼠心肌细胞凋亡,同时显著下调细胞凋亡相关蛋白Cyt C和caspase-3蛋白的表达。
综上所述,敲减GPR75可阻断20-HETE 诱导的乳鼠心肌细胞凋亡,GPR75 介导的PLC/PKC 信号通路参与了20-HETE 诱导的细胞凋亡进程,提示敲减GPR75或者阻断GPR75下游信号通路的作用可能是减少20-HETE 导致实验动物心肌损伤的有效策略,后续实验需在大鼠MIRI 或心肌梗死等模型中进一步研究证实。
