流感病毒诱导的小鼠肺上皮细胞损伤及外泌体miRNA差异表达谱研究*
2022-02-16马心悦朱梦晨卢芳国陈雨露黄家望
马心悦, 朱梦晨, 卢芳国, 陈雨露, 王 平, 赵 澄, 黄家望, 李 玲
(湖南中医药大学1中西医结合学院,2医学院,3中医学院,湖南 长沙 410208)
流感病毒作为一种常见呼吸道病原体,常分为4型(甲型、乙型、丙型和丁型),其中甲型流感病毒(in‑fluenza A virus,IAV)具有较高的致病性和变异性[1],可引发严重呼吸道感染,并造成大范围流行[2-3],其传播具有季节性、周期性及高度传染性的特点[4-5]。该病毒主要感染上呼吸道和下呼吸道,其典型表现为肺上皮损伤,严重时可发展为肺衰竭,引起急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)[6],严重影响人类的健康及公共卫生安全。因此,通过探究流感病毒诱导肺损伤的发病机制对防治流感极为重要。
外泌体在体内分布广泛,属于细胞分泌到细胞外的小囊泡,参与多种细胞生物的生理组织调节,在致病性损伤及器官重塑等多个生物学过程中发挥着重要作用。外泌体可携带细胞产生的一些功能性物质,进入靶细胞发挥不同的生物学效应,如参与免疫应答、抗原提呈、细胞分化、肿瘤侵袭等[7]。此外,研究表明外泌体可以参与病毒感染的过程,可以携带病毒相关的物质传递至相关靶细胞,促进病毒在宿主体内的传播[8],如促进病毒复制、激活炎症细胞因子、进行性诱导肺部炎症损伤的发生发展等[9]。然而,目前对流感病毒感染后宿主细胞分泌的外泌体的功能及其生物学特征研究较少。本研究拟通过构建稳定的IAV 诱导肺上皮细胞损伤模型,并提取外泌体进行高通量测序,筛选IAV 刺激后肺上皮细胞源性外泌体微小RNA(microRNA,miRNA)差异表达谱,为后续探索miRNA 在流感病毒感染小鼠肺上皮细胞中的作用及其调控机制提供实验依据。
材料和方法
1 材料
1.1 细胞和病毒株小鼠肺上皮细胞MLE-12 为本实验室传代保存。IAV 小鼠肺适应株(A/PR/8/34)为湖南师范大学病毒研究室惠赠,储存在−80 ℃冰柜中备用。经10 日龄鸡胚尿囊腔接种培养传代,血凝效价1∶640 以上者供实验用。将病毒尿囊液以灭菌生理盐水稀释成每0.1 mL 50 LD50[即感染复数(multi‑plicity of infection,MOI)=0.2]置于冰袋中备用。
1.2 主要试剂RPMI-1640 基础培养液、无外泌体培养液、胎牛血清、磷酸盐缓冲液和双抗(Biological Industries);病毒稀释液含RPMI-1640 基础培养液、1 mol/L HEPES、1 g/L TPCK-Try、NaHCO3和双抗;病毒维持液为含0.2% 胎牛血清的病毒稀释液;CCK-8 细胞毒性检测试剂盒(Biosharp,BS350A);miRNA 逆转录引物、CD63抗体(ab134045)、CD81抗体(ab79559)和TSG101抗体(ab125011)均购自Abcam。
1.3 仪器CytExpert 流式细胞仪、Optima MAX-XP台式超速离心机和浓缩管(Beckman Coulter);CO2细胞培养箱和台式高速冷冻离心机(Thermo);CFX96 Touch 荧光定量PCR 仪和Western blot 工作系统(Bio-Rad);ELx800 酶标仪(BioTek);Amicon Ultra-15,Ul‑tracel-30K 超滤管(Merck Millipore);透射电子显微镜;NS300 纳米颗粒跟踪分析(nanoparticle tracking analysis,NTA)仪(NanoSight)。
2 实验方法
2.1 细胞培养MLE-12 细胞用内含10% 胎牛血清、1% 双抗(青霉素和链霉素)、90% RPMI-1640 基础培养液置于37 ℃、5% CO2培养箱中培养,每天更换细胞培养液,待细胞长至铺满皿底90% 时,用0.25%胰蛋白酶进行消化传代。
2.2 造模浓度的选择及分组病毒性肺泡上皮损伤模型的建立,根据不同浓度病毒在倒置显微镜下细胞形态的变化和CCK-8 检测结果,以及查阅文献[10-11],选取MOI=0.2。
实验分组:空白对照(control,CON)组和病毒干预组(IAV 组)。细胞按预设组铺板孵育细胞长至皿底90%,弃去原来培养液,更换成稀释液,IAV 组内加入IAV 干预2 h 后,更换成维持液。通过倒置相差显微镜观察细胞形态,确定干预时间,从而进行以下各项指标检测。
2.3 CCK-8 法检测细胞活力将对数生长期的MLE-12 细胞制备成细胞悬液,接种到96 孔板,细胞数量在每孔4×103个左右。待贴壁后,IAV 组用病毒稀释液(MOI=0.2)干预,同步设CON 组,每组设5 个复孔。干预2 h后弃去上清,更换维持液继续培养4、6、8、10 和12 h 后,根据CCK-8 试剂盒操作说明书进行细胞活力检测,使用多功能酶标仪在450 nm 测量吸光度(A),并计算细胞活力抑制率(%)=(ACON组−AIAV组)/(ACON组−A空白)×100%,以及IC50。
2.4 流式细胞术检测细胞凋亡将对数期生长的MLE-12 细胞悬液接种到6 孔板,待细胞长至铺满皿底90%。设IAV 组和CON 组,分别用病毒稀释液和稀释液干预2 h,每组3个复孔,更换为维持液继续培养8 h 后收集各组细胞,离心后弃上清,加预冷PBS清洗2 次,细胞重悬,制备细胞密度为5×109L−1的悬液。按照Annexin V-FITC/PI 试剂盒说明书,使用流式细胞仪检测各组细胞凋亡率。
2.5 RT-qPCR 检测分组和干预方式同前。采用Trizol法提取两组细胞总RNA,逆转录合成cDNA,进行RT-qPCR 检测。反应体系:模板cDNA 取1 μL,上下游引物各取1 μL,qPCR SuperMix Plus 取10 μL,RNase Free Water 取7 μL,配至20 μL 总体积。反应条件:95 ℃4 min 预变性;95 ℃变性30 秒,60 ℃退火30 秒,72 ℃延伸45 s,30 个循环。以GAPDH 为内参照,按照2−ΔΔCt计算目的基因的相对表达量。引物序列见表1。
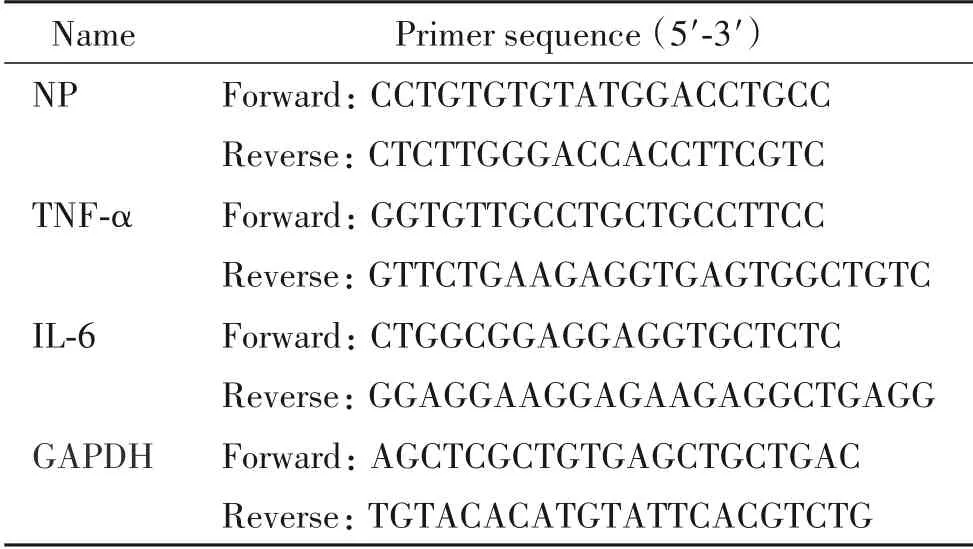
表1 RT-qPCR引物序列Table 1.Primer sequence for RT-qPCR
2.6 Western blot 检测分组和干预方式同前。采用常规RIPA 裂解液裂解后用BCA 蛋白测定试剂盒检测总蛋白浓度。变性蛋白样品经8%~10% SDSPAGE 分离后转PVDF 膜。用1× TBST 洗涤后,5%BSA 室温封闭1 h。用1× TBST 洗涤后,加入Ⅰ抗[甲型流感病毒核蛋白(nucleoprotein,NP)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)和白细胞介素6(interleukin-6,IL-6)抗体]孵育4 ℃过夜,用1×TBST洗涤3 次后,HRP 标记的Ⅱ抗室温孵育1h。ECL 显影曝光后化学发光仪检测并分析。
2.7 外泌体的提取与鉴定
2.7.1 外泌体的提取将对数生长期的MLE-12 细胞接种在75 cm2培养瓶内,待细胞长至铺满皿底90%。分组和干预方式同前。收集2 组细胞的上清液,300×g离心10 min,去除上清液中的细胞;用冷PBS重悬,2 000×g离心10 min,去除上清液中的死细胞;10 000×g离心30 min,去除上清液中的细胞碎片。将处理好的上清液移入超滤过滤器内,3 000×g离心15 min,弃离心管内液体,收集过滤管内浓缩后的上清液,并将液体移至超速离心管内。按照超速离心机使用说明书,120 000×g离心90 min,提取外泌体样本。
2.7.2 外泌体的电镜检测将收集的外泌体进行常规固定。在室温下孵育10 min 后,在铜网上取20 μL 外泌体悬液,用无菌蒸馏水冲洗,然后从滤纸吸收多余液体,然后滴3% 磷钨酸溶液30 μL 室温负染5 min,用滤纸吸干负染液,晾干。在透射电镜下观察铜网并拍摄照片。
2.7.3 NTA 检测外泌体含量和粒径分布将离心后的外泌体沉淀加入PBS 稀释混匀,取1 mL 外泌体悬液加入比色皿中,使用NTA仪进行检测,并对实验数据进行分析。
2.7.4 Western blot 检测外泌体膜标志蛋白将收集的外泌体常规RIPA 裂解液裂解后用BCA 蛋白测定试剂盒检测总蛋白浓度。变性蛋白样品经8%~10% SDS-PAGE分离后转PVDF膜。用1× TBST洗涤后,5% BSA 室温封闭1 h。用1× TBST 洗涤后,加入Ⅰ抗(CD63、CD81 和TSG101 抗体)孵育4 ℃过夜,用1× TBST 洗涤3 次后,HRP 标记的Ⅱ抗室温孵育1 h。ECL显影曝光后化学发光仪检测并分析。
2.8 高通量单细胞测序分组、干预方式及提取外泌体方法同前。将收集的外泌体样本交由杭州联川生物技术有限公司进行miRNA 文库构建及高通量测序,检测2 组外泌体的miRNA 的表达差异谱。再通过RT-qPCR 验证高通量单细胞测序结果,引物序列见表2。

表2 miRNA引物序列Table 2.The primer sequences of miRNAs for RT-qPCR
3 统计学处理
运用SPSS 21.0 统计软件处理数据。计量资料经检验符合正态分布且具有方差齐性,以均数±标准差(mean±SD)表示。采用独立样本t检验进行组间均数比较。以P<0.05为差异有统计学意义。
结 果
1 倒置相差显微镜观测细胞形态
如图1 所示,为确定流感病毒刺激细胞的最佳时间,对肺上皮细胞进行时效实验检测,在倒置相差显微镜观察MLE-12细胞形态:空白对照组细胞呈梭形,贴壁生成,细胞形态完整,生长状态良好;而加入病毒刺激后,在2 h 细胞状态尚好,4 h 后细胞数量减少,形状变圆,而病毒刺激8 h后,视野内出现较多的细胞碎片,细胞损伤严重。
2 CCK-8实验结果
如图2 所示,流感病毒刺激细胞后,在前8 h 内,细胞活力抑制率随着时间而升高,在8 h 达到最高[(22.00±0.02)%]。因此,以8 h 为后续实验的干预条件。
3 流式细胞术检测凋亡
如图3 所示,基于细胞形态和CCK-8 实验结果,选取病毒抑制率最佳的时点8 h 进行流式细胞术检测。与空白对照组(凋亡率为6.84±1.0%)相比,病毒干预组(凋亡率为24.11±0.17%)凋亡细胞显著增多(P<0.01)。
4 RT-qPCR 检测NP、TNF-α 和IL-6 mRNA 表达水平
RT-qPCR 结果显示,与空白对照组相比,病毒干预组NP、TNF-α 和IL-6 的mRNA 表达水平显著升高(P<0.01),见图4。
5 Western blot 检测NP、IL-6 和TNF-α 蛋白表达水平
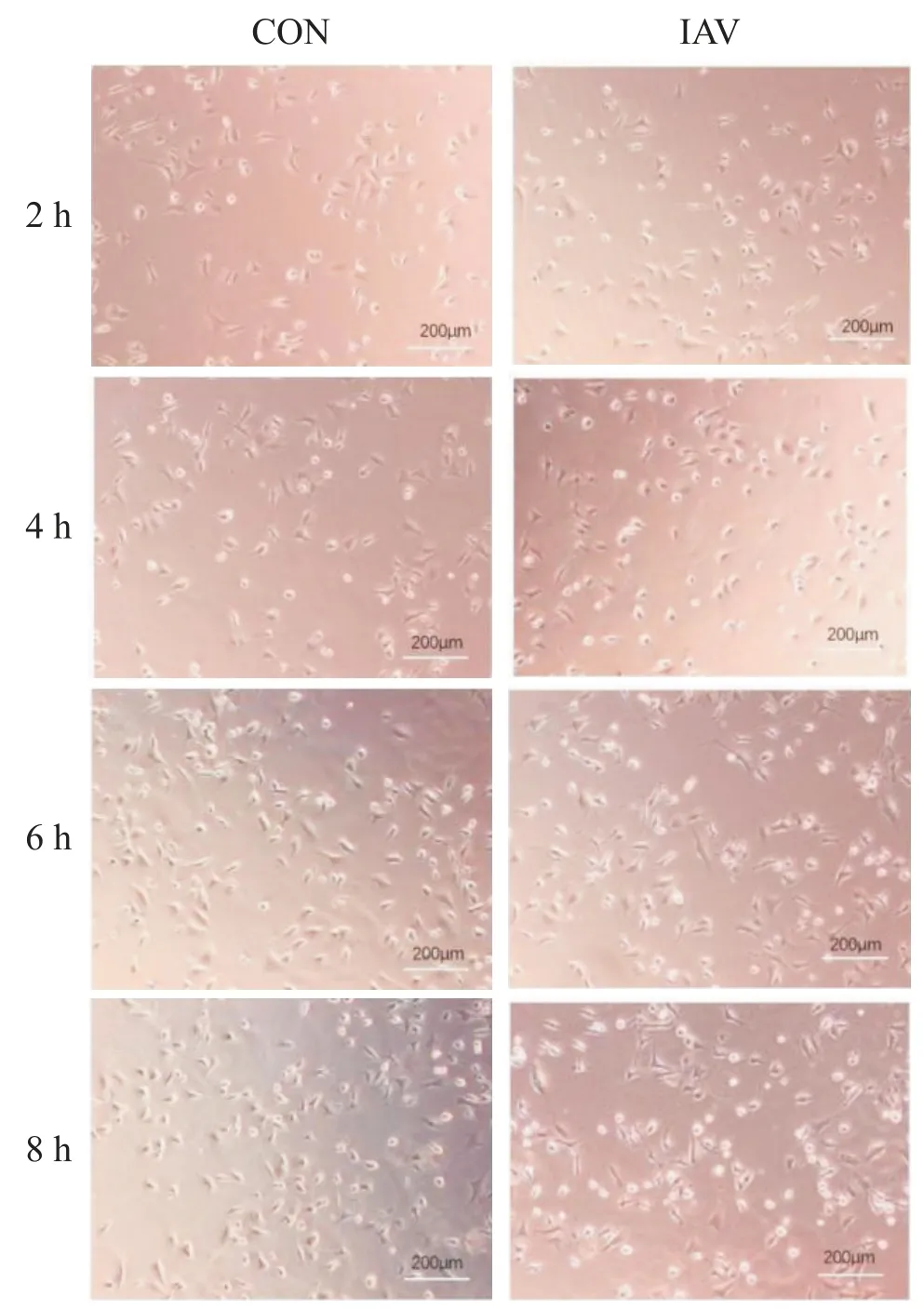
Figure 1.Morphological observation of MLE-12 cells infected by influenza A virus(IAV).Scale bar=200 μm.图1 细胞形态观察结果

Figure 2.The viability of MLE-12 cells after influenza A virus infection detected by CCK-8 assay.Mean±SD. n=4.图2 流感病毒干预MLE-12细胞的时效实验结果
Western blot结果显示,与空白对照组相比,病毒干预组NP、IL-6 和TNF-α 蛋白表达显著增加(P<0.01),病毒干预组NP 蛋白表达差异最为显著,见图5。
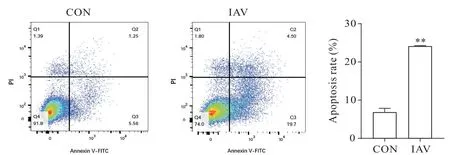
Figure 3.Apoptosis of MLE-12 cells detected by flow cytometry.Mean±SD. n=4.**P<0.01 vs control(CON)group.图3 流式细胞术检测MLE-12细胞凋亡
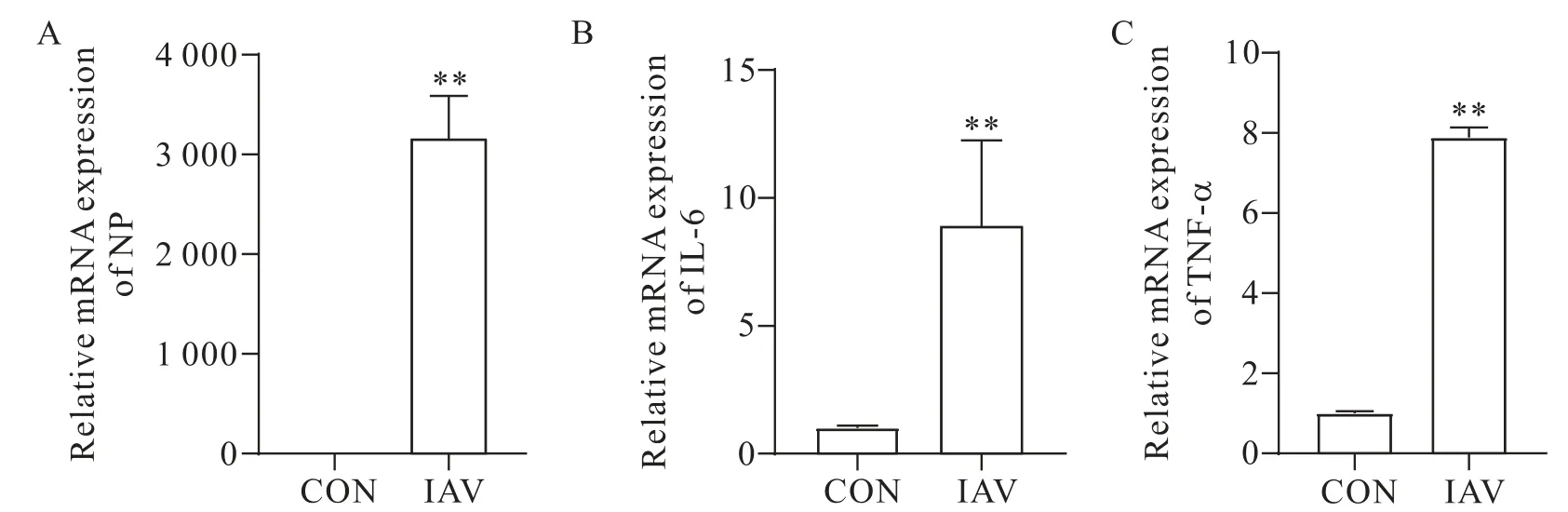
Figure 4.The relative mRNA expression levels of NP(A),IL-6(B)and TNF-α(C)detected by RT-qPCR.Mean±SD. n=4.**P<0.01 vs control(CON)group.图4 RT-qPCR检测NP、IL-6和TNF-α mRNA表达水平
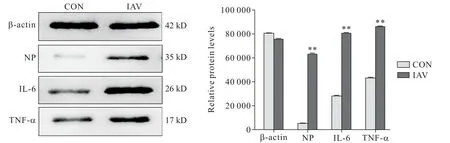
Figure 5.The relative protein expression levels of NP,IL-6 and TNF-α detected by Western blot test.Mean±SD. n=4.**P<0.01 vs control(CON)group.图5 Western blot检测NP、IL-6和TNF-α蛋白表达水平
6 外泌体的提取与鉴定
如图6 所示,流感病毒诱导的MLE-12 细胞上清液来源的外泌体为圆形或椭圆形的囊泡结构,大小均匀完整,与空白对照组细胞上清液来源的外泌体比较,形态上无明显差异。
NTA 检测结果显示,提取的外泌体直径在30~200 nm 之间,符合外泌体形态判断标准;检测结果同时提示,2 组外泌体的粒径大小无显著差异,但组间浓度有显著差异,见图7。
Western blot 对外泌体标志物进行检测,结果显示,在2 组细胞上清液提取的外泌体中均能检测到外泌体膜性标志蛋白CD63、CD81 和TSG101 的表达呈阳性,且病毒干预组CD63 和TSG101 表达水平高于空白对照组(P<0.01),而CD81表达水平无显著差异,见图8。
7 高通量单细胞测序数据分析
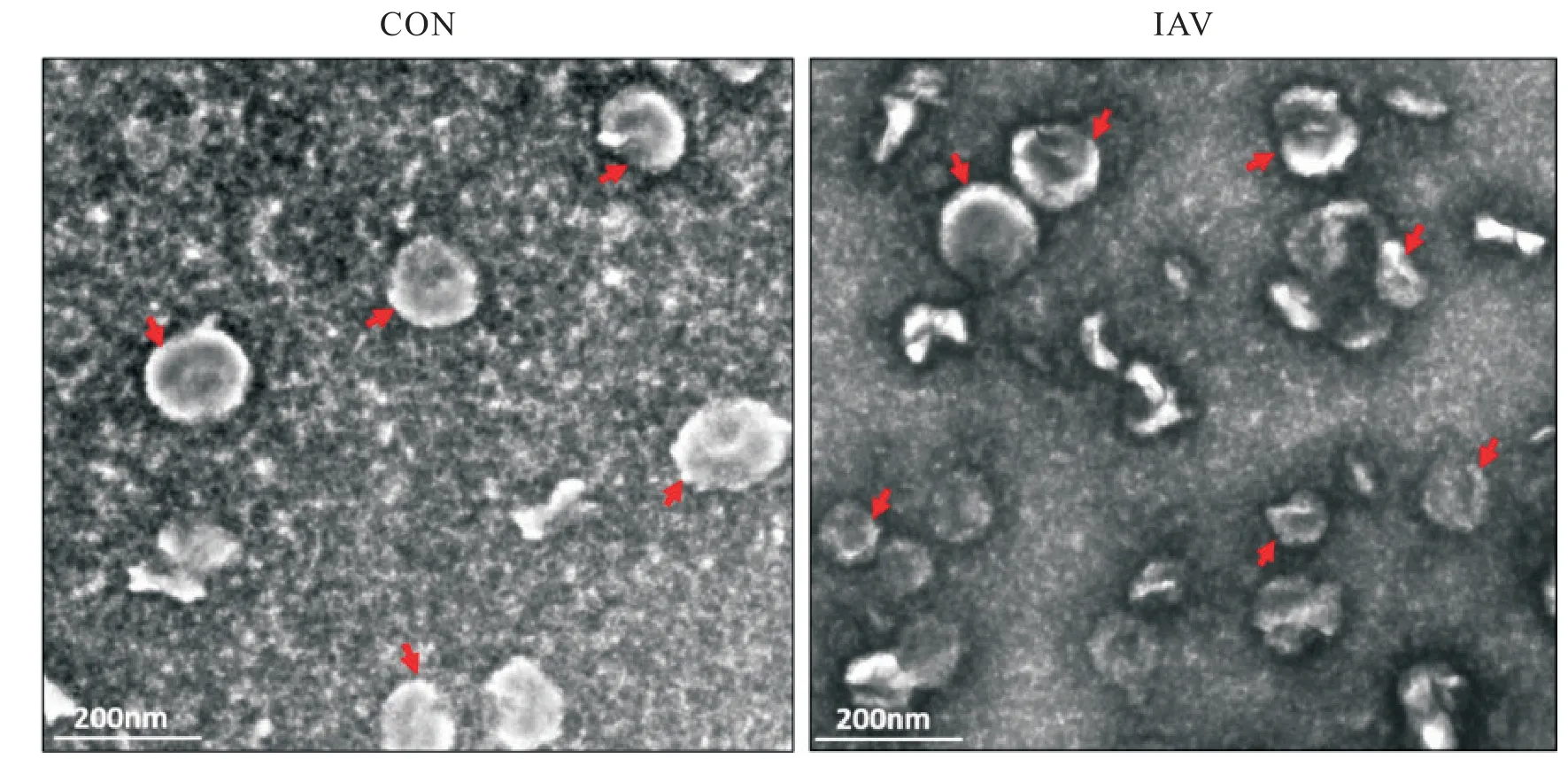
Figure 6.Observation of exosomes by transmission electron microscopy(red arrows;scale bar=200 nm).The exosome showed circu‑lar vesicles between 30 to 200 nm in diameter and uniformly complete in size.图6 透射电镜观察外泌体
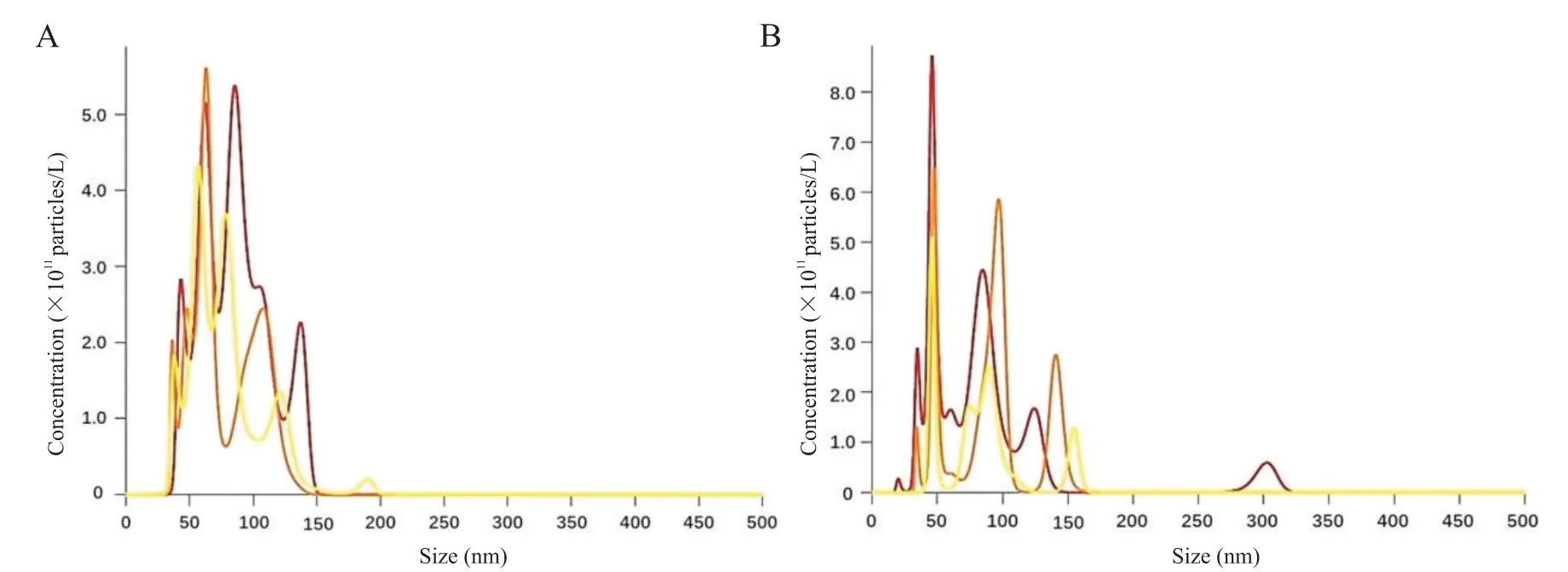
Figure 7.Size and concentration of exosomes by NTA.A:control(CON)group,particle size of(80.40±27.25)nm,concentration of(4.41±0.71)×1011/L;B:IAV group,particle size of(86.75±40.65)nm,concentration of(3.57±0.83)×1011/L.图7 Nanosight检测外泌体的大小-浓度分布
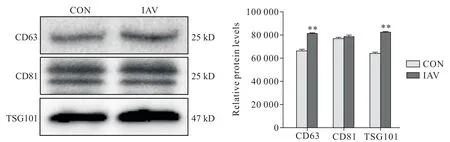
Figure 8.Western blot detection of exosome membrane marker proteins.Mean±SD. n=4.**P<0.01 vs control(CON)group.图8 Western blot检测外泌体膜性标志蛋白
7.1 miRNA 差异表达和聚类分析如图9 所示,对病毒干预组与空白对照组的肺上皮细胞外泌体差异表达的miRNA 进行分析,以显著性P值(Pvalue)和差异倍数(fold change,FC)作为差异表达的判断标准,筛选出差异表达的miRNA:(1)当P≤0.05,且FC≥2[log2(FC)≥1],则判断为上调;(2)当P≤0.05,且FC≤0.5[log2(FC)≤−1],则判断为下调。
根据2 组样品的miRNA 表达谱的相近程度,对miRNA 进行聚类分析,能够直观地展示miRNA 在组间的不同表达情况,见图10。

Figure 9.Volcanic distribution of significantly differentially expressed miRNAs.A total of 154 differently expressed miRNAs were de‑tected by sequencing,120 of which were known miRNAs,and 34 were newly discovered miRNAs.There were 69 up-regu‑lated miRNAs in the known miRNAs,while 51 were down-regulated.Among the newly discovered miRNAs,13 were upregulated,while 21 were down-regulated.A:the volcanic distribution of known differentially expressed miRNAs;B:the volcanic distribution of newly differentially expressed miRNAs.Each point in the figure represents an miRNAs,the abscis‑sa is the fold change(FC)value,and the ordinate is the P value.Red point represents up-regulated miRNAs,while green point represents down-regulated ones.图9 显著差异表达miRNA的火山分布图
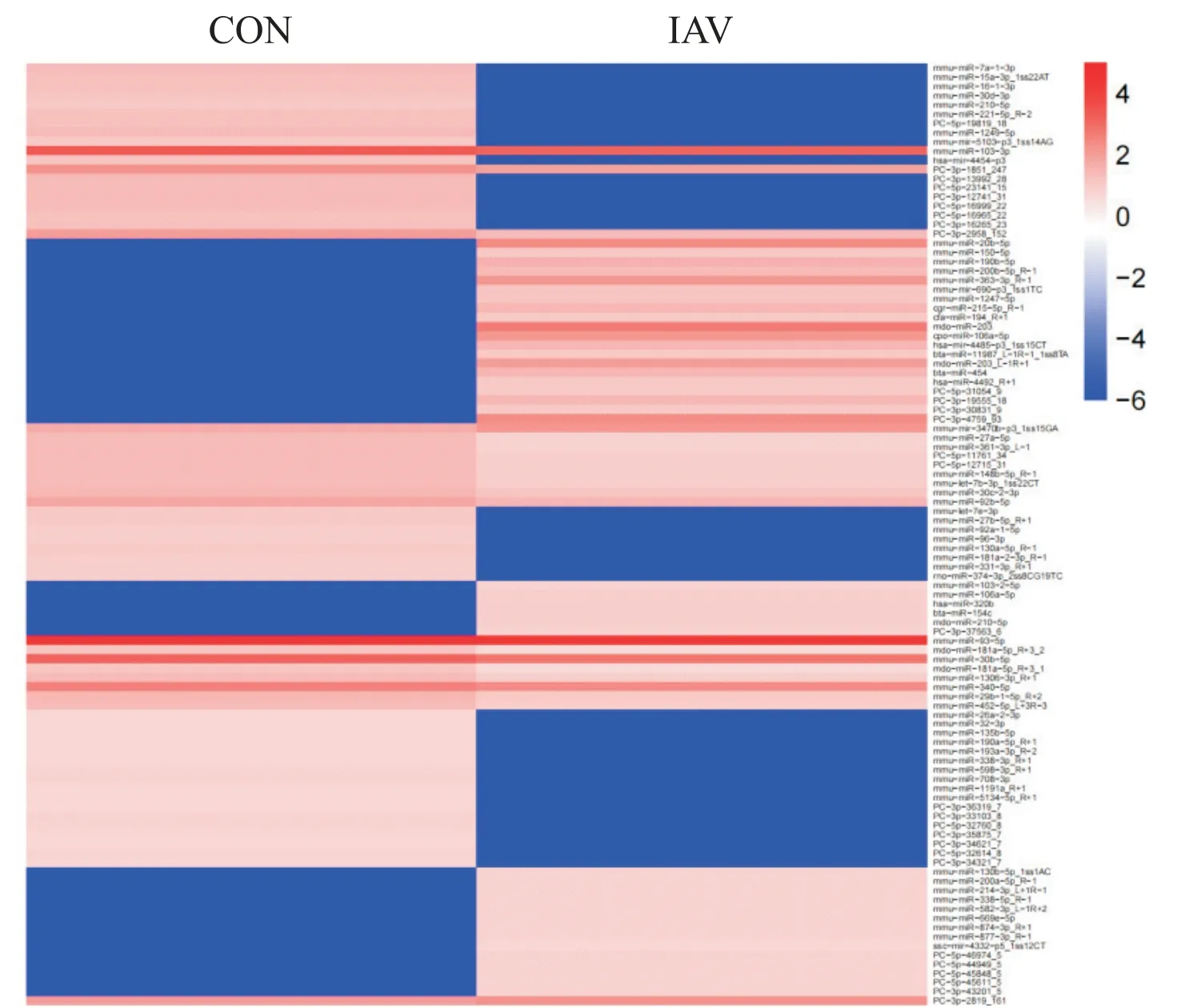
Figure 10.Heat map of differentially expressed miRNAs.图10 差异表达miRNA的热图
7.2 筛选差异表达显著的miRNA根据测序结果中的miRNA 差异表达数据,筛选出5 个病毒干预组高于空白对照组的miRNA,分别为mmu-miR-150-5p、mmu-miR-93-5p、mmu-miR-106a-5p、mmu-miR-363-3p_R-1 和mmu-miR-3470b-p3_1ss15GA,FC≥2 且P≤0.05;筛选出5 个病毒干预组低于空白对照组的miRNA,分别是mmu-miR-30b-5p、mmu-miR-1249-5p、mmu-miR-16-1-3p、mmu-miR-103-3p 和mmu-miR-340-5p,FC≤−1且P≤0.05,见表3。

表3 筛选出的差异表达的miRNATable 3.The screened differentially-expressed miRNAs
7.3 RT-qPCR 验证差异表达明显的miRNA对根据测序结果筛选出来的10 个差异表达miRNA 进行RT-qPCR 验证,如图11 所示,有6 个与测序结果一致,其中2个为上调趋势,4个为下调趋势。

Figure 11.Validation results of the known differentially expressed miRNAs.A to J:the expression of miR-16-1-3p,miR-1249-5p,miR-106-5p,miR-150-5p,miR-30b-5p,miR-103-3p,miR-340-5p,miR-363-3p_R-1,miR-3470b-p3_1ss15GA and miR-93-5p,respectively.Mean±SD. n=4.**P<0.01 vs control(CON)group.图11 已知差异表达miRNA的验证结果
讨 论
IAV 每年都会引发人类呼吸道疾病,对社会经济和人类健康造成了巨大的负担[12],且流感病毒传播速度快及病毒易于变异,使我们对流感病毒的预防和控制越来越困难[13]。有研究表明[14],IAV 可通过病毒复制或过度炎症免疫反应,对宿主机体造成直接或间接的伤害,同时,过度炎症反应可引起肺组织损伤,导致高死亡率。IAV 毒感染人体后,介导机体免疫系统产生大量的促炎性细胞因子,可诱发细胞因子风暴,导致全身炎症反应综合征(SIRS),造成靶器官广泛的病理损伤,出现ARDS、休克及多脏器功能衰竭[17],其中IL-6 和TNF-α 作为主要的炎症因子,能够直接参与到机体的炎症反应,在机体炎症反应中发挥了重要作用[18]。作为一种RNA 病毒,IAV的RNA 基因组中第5 节段编码其核衣壳蛋白(NP),参与了病毒复制周期的多个阶段,是病毒基因转录和基因组复制过程中是必不可少的成分[15-16]。本研究证实,IL-6和TNF-α等炎症因子在IAV诱导的肺泡上皮细胞损伤的发病机制中起着重要作用,其机制可能是增加流感病毒NP 的表达,促进病毒基因转录和基因组复制,从而抑制细胞活性,促进细胞凋亡,激活IL-6 和TNF-α 等促炎因子介导的机体抗病毒免疫反应,引起一系列炎症反应,这也提示,若能在早期进行药物干预,可有效的阻止IAV 诱导的细胞活性下降、细胞凋亡及炎症反应,从而避免或减轻肺泡上皮细胞损伤。
外泌体是由细胞分泌的介导细胞间交流的圆形纳米囊泡,在IAV 诱导的病毒性肺损伤的发病机制中起着重要作用[19-20]。外泌体可以通过携带病毒或宿主蛋白组分、核酸组分包括miRNA 等调节宿主免疫应答进而促进病毒复制,传递细胞间信号,激活和调节抗病毒反应,参与肺部炎症性疾病[21-22]。此外,外泌体所携带miRNA 可以通过向受体细胞传递遗传信息的方式,在肿瘤、肺系感染性疾病和神经变性疾病等诸多疾病的发生发展中起着关键作用[23-25]。有研究表明,miR-1249 在IAV 感染过程中能够抑制碱性聚合酶2 的功能,从而影响病毒的转录和复制[26-27]。miR-30b 和miR-103 在与炎症相关的疾病中发挥抑制疾病进展的作用[28-30],调控多种蛋白以及信号通路减少氧化应激损伤、促进细胞生长、抑制细胞凋亡和细胞中的炎症反应[31]。本实验表明,IAV 能引起肺泡上皮细胞释放的外泌体的粒径大小和浓度分布发生变化,改变外泌体所携带的miR-1249、miR-30b等miRNA特异性表达。
综上所述,本研究在成功构建A 型流感病毒感染诱导的病毒性肺损伤的模型的基础上,分别提取病毒干预组和空白对照组分泌的外泌体,通过高通量单细胞测序技术检测miRNA 的差异表达谱,为进一步研究外泌体在IAV 诱导的流感病毒性肺损伤的作用机制提供了实验依据。在未来的研究中,我们将针对miR-1249、miR-30b 等miRNA 在流感病毒诱导的病毒性肺损伤过程中的功能及作用机制开展深入研究。
