硫化氢通过NCOA4介导的铁自噬调控铁死亡而减轻CSE诱导的肺泡上皮细胞损伤*
2022-02-16潘子涵蒋思敏陈亚红
王 莹, 廖 莎, 潘子涵, 蒋思敏, 樊 静, 陈亚红, 张 静
(北京大学第三医院呼吸与危重症学科,北京 100191)
慢性阻塞性肺疾病(简称慢阻肺),是世界范围内导致人类死亡的主要原因之一,吸烟被认为是慢阻肺发生发展的主要因素。烟草烟雾含有颗粒、自由基和活性物质等约4 500种化学成分,提示可能有多种损伤及细胞死亡机制参与CSE 介导的细胞损伤[1]。气道上皮细胞是肺脏与外界进行气体交换的第一道屏障,近期研究表明,CSE 诱发的气道上皮细胞铁死亡参与了慢阻肺的进程[2]。铁死亡(ferropto‑sis)是Dixon等[3]在2012年发现的一种新型细胞死亡形式,其特征是铁介导的Fenton 反应产生活性氧(re‑active oxygen species,ROS)引起的脂质过氧化,活性铁是其基础。而细胞内不稳定的铁可通过铁自噬(ferritinophagy)途径产生。铁自噬是一种新型的自噬类型,此过程的发生依赖于特异性受体核受体辅激活因子4(nuclear receptor coactivator 4,NCOA4),它能将铁蛋白运输到自噬小体,而后与溶酶体融合,使铁蛋白降解为活性铁[4]。因此,抑制铁自噬-铁死亡可能会对保护气道上皮细胞进而阻断慢阻肺进展提供新的思路。
硫化氢(hydrogen sulfide,H2S)是继一氧化氮和一氧化碳之后发现的第3 种新型内源性气体信号分子。本课题组长期围绕H2S 在呼吸系统的作用进行研究,发现其具有抗氧化、抗炎和抗凋亡等多种功能[5]。然而,H2S 是否具有抗肺泡上皮细胞铁死亡的作用,尚属未知。因此,本项工作通过使用CSE 作为刺激物建立肺泡上皮损伤细胞模型,围绕铁自噬-铁死亡信号通路,探讨H2S 在肺泡上皮细胞中的作用,以期为慢阻肺的防治提供参考资料。
材料和方法
1 细胞株和主要试剂
人源肺泡上皮细胞BEAS-2B 购自ATCC 上海细胞库;RPMI-1640 培养液购自HyClone;澳洲胎牛血清购自Gibco;香烟(白沙牌,含焦油11 mg、烟碱0.9 mg 及烟气一氧化碳12 mg);硫氢化钠(sodium hydro‑sulfide,NaHS)购自Sigma-Aldrich;CCK-8 试剂盒购自日本同仁公司;ROS 检测试剂盒购自北京索莱宝公司;BODIPY 581/591 C11 脂质ROS(lipid ROS,Lip ROS)检测试剂盒购自Invitrogen;丙二醛(malondial‑dehyde,MDA)和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)检测试剂盒购自上海碧云天生物技术有限公司;铁离子检测试剂盒、抗NCOA4 抗体(1∶1 000)、抗铁蛋白重链1(ferritin heavy chain 1,FTH1)抗体(1∶1 000)、抗环加氧酶2(cyclooxygenase 2,COX2)抗体(1∶1 000)、抗谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)抗体(1∶1 000)和抗GAPDH 抗体(1∶5 000)均购自Abcam;HRP 标记的山羊抗兔IgG(1∶10 000)购自北京中杉金桥公司。
2 主要方法
2.1 药物准备NaHS 作为H2S 供体用PBS 溶解配成10 mmol/L储存液,−80 ℃冰箱冻存备用,在CSE加入前30 min 预处理。CSE 需现用现配,1 支香烟对应10 mL 无胎牛血清培养液,点燃香烟,包式吸收管内缓慢匀速抽吸,再经0.22 μm 滤器除菌,而后使用分光光度计在320 nm 处测定液体吸光度(absorbance,A),范围在4.00±0.05内可用,即为100%的CSE。
2.2 细胞培养BEAS-2B 细胞用含有10% 胎牛血清、1×105U/L 青霉 素和100 mg/L 链 霉素的RPMI-1640 培养液置于37 ℃、5% CO2的培养箱中培养,取对数生长期细胞进行实验。除特殊说明外,其他实验均将4×105个BEAS-2B 细胞接种于6 孔板中,细胞完全贴壁后,按照分组给予药物刺激处理24 h。
2.3 CCK-8 法检测BEAS-2B 细胞活力取对数期的BEAS-2B 细胞以每孔5×103个的密度接种于含100 μL 完全培养液的96 孔板中,细胞完全贴壁后用不同浓度的CSE或NaHS处理24 h。弃培养液后PBS洗3 次,每孔加入含10% CCK-8 检测液的培养液100 μL,37 ℃孵育2 h后490 nm处使用酶标仪测量A值。
2.4 Fe2+含量检测药物处理完成后收集细胞沉淀,加入100 μL裂解液,使用杜恩斯匀浆器冰上匀浆10 次,离心取上清。按照铁离子检测试剂盒说明书加入探针,于593 nm 处测得A值,绘制标准曲线并计算铁离子浓度。
2.5 脂质过氧化分析取对数期的BEAS-2B 细胞以每孔5×104个的密度接种于共聚焦皿中,细胞完全贴壁后用CSE 或NaHS 处理24 h。弃上清,加入含BODIPY™581/591 C11(7 μmol/L)的无血清培养液,37 ℃孵育30 min,PBS 洗3 次,最后活细胞状态下使用共聚焦显微镜采集荧光图片。
2.6 流式细胞术检测细胞内ROS和Lip ROS含量药物处理完成后收集细胞沉淀,用无血清培养液稀释DCFH-DA 荧光探针(终浓度为2μmol/L)或BODIPY™581/591 C11 荧光探针(终浓度为7 μmol/L),每孔0.5 mL/孔重悬细胞,37 ℃孵育30 min。吸弃含探针的培养液后用无血清培养液润洗细胞2次,每个样品加入无血清培养液150 μL重悬,流式细胞仪上机检测。
2.7 ELISA 法检测细胞内MDA 及GSH-Px含量药物处理完成后收集细胞沉淀,细胞裂解液裂解细胞,BCA 蛋白定量试剂盒测定裂解液上清中的蛋白浓度。按照厂家说明书测定检测裂解液上清中MDA和GSH-Px 的含量。最后绘制标准曲线,计算各自浓度。
2.8 Western blot 法检测相关蛋白的表达药物处理完成后收集细胞沉淀,细胞裂解液裂解细胞,使用BCA 蛋白定量试剂盒进行蛋白定量,蛋白变性后存于−20℃。按照40 μg 上样量上样,经SDS-PAGE 后电转,5% 脱脂奶粉室温封闭1 h,加入目的蛋白Ⅰ抗4℃摇床孵育过夜。回收Ⅰ抗,1× TBST 洗3 次每次5 min,再加入Ⅱ抗室温孵育1 h,TBST 洗3 次后ECL 显影,应用ImageJ软件进行灰度分析。
3 统计学处理
采用SPSS 26.0 统计软件进行数据分析。数据均采用均数±标准差(mean±SD)表示。多组间均数比较采用单因素方差分析(one-way ANOVA),两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
结 果
1 不同浓度CSE 刺激对铁死亡标志物GPX4 及COX2表达的影响
Western blot 检测结果显示,随着CSE 浓度的增加,BEAS-2B 细胞内COX2 表达水平呈上升趋势,且浓度大于3% 时,表达量加剧,增加至1.5 倍以上(P<0.01);而GPX4蛋白表达水平与CSE浓度呈反比,在5%浓度时开始显著降低(P<0.01),见图1。

Figure 1.Effects of treatment with different concentrations of CSE for 24 h on the protein expression of COX2 and GPX4 in BEAS-2B cells.The expression of target pro‑teins was measured by Western blot.Mean±SD. n=4.**P<0.01 vs control(0% CSE)group.图1 不同浓度CSE 处理24 h 对BEAS-2B 细胞中COX2 和GPX4蛋白表达的影响
2 NaHS及CSE处理对BEAS-2B细胞活力的影响
不同浓度的CSE 处理24 h 后BEAS-2B 细胞活力的变化如图2A 所示,CSE 对BEAS-2B 细胞活力的影响具有浓度依赖性,且当浓度在5% 时细胞活力显著下降至60% 左右(P<0.01)。结合文献报道[2],选择5%作为后续的CSE刺激浓度。
进一步检测NaHS对肺泡上皮细胞的保护作用,结果如图2B 所示。与CSE 刺激组相比,NaHS(200和400 μmol/L)预处理可明显增强CSE刺激后BEAS-2B 细胞的活力(P<0.01),并呈剂量依赖性。值得注意的是,单纯NaHS处理细胞也可增强BEAS-2B细胞活力(P<0.05)。
3 NaHS 及CSE 处理对BEAS-2B 细胞Fe2+含量的影响
接下来提取细胞内Fe2+评估CSE及NaHS预处理对细胞内活性铁的影响,结果如图3 所示。与空白对照组相比,CSE 处理可以使细胞内Fe2+含量呈现约2 倍的升高(P<0.01);而相比于CSE 单纯刺激组,NaHS 预处理组Fe2+含量有所下降,且高剂量组差异有统计学意义(P<0.05)。
4 NaHS 及CSE 处理对细胞内ROS 及Lip ROS 的产生和氧化-抗氧化系统的影响
通过对Lip ROS、ROS、MDA 及GSH-Px 含量进行检测评估氧化还原系统,结果如图4所示。单纯CSE处理能刺激绿光的大量产生,使细胞处于氧化状态,而NaHS预处理可减轻CSE介导的细胞氧化程度。
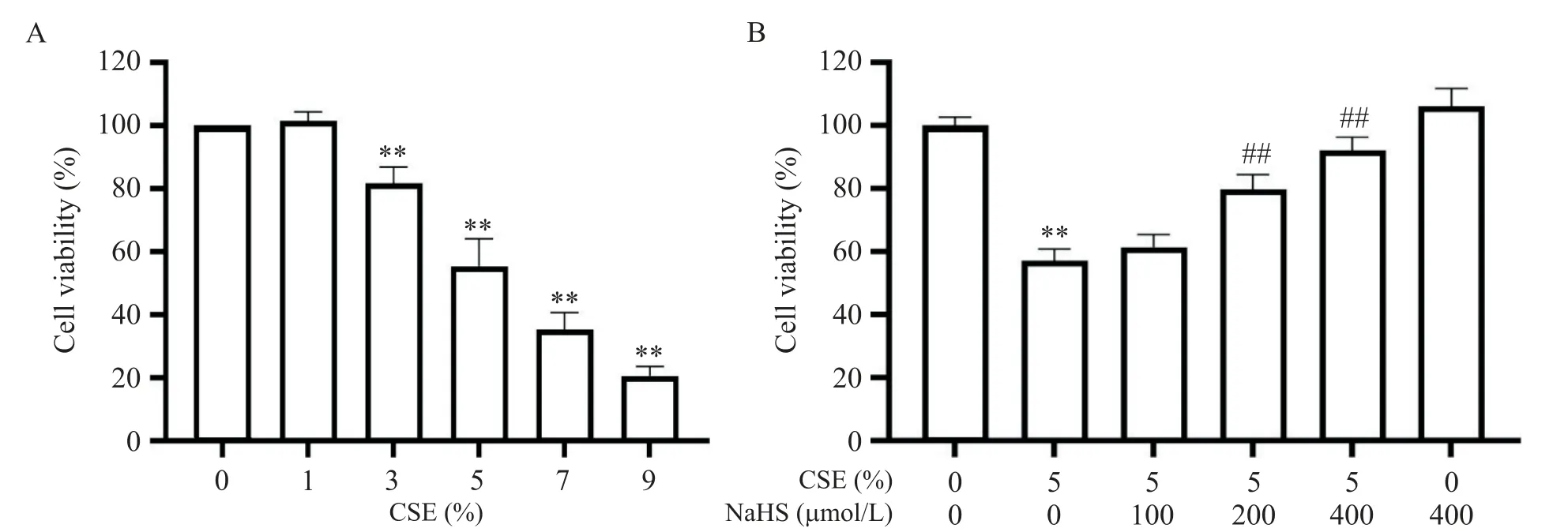
Figure 2.Effects of CSE and NaHS on the viability of BEAS-2B cells.A:effects of treatment with different concentrations of CSE for 24 h on BEAS-2B cell viability;B:effects of 30 min of NaHS pretreatment on the viability of BEAS-2B cells treated with 5% CSE for 24 h.Mean±SD. n=4.*P<0.01 vs control(0% CSE or 0% CSE+0 μmol/L NaHS)group;##P<0.01 vs 5%CSE group.图2 CSE和NaHS对BEAS-2B细胞活力的影响

Figure 3.Cellular iron content in BEAS-2B cells of each group.The cells were treated with 5% CSE for 24 h with or without 30 min of NaHS pretreatment.Mean±SD. n=4.**P<0.01 vs control(0% CSE+0 μmol/L NaHS)group;#P<0.05 vs 5% CSE group.图3 各组BEAS-2B细胞铁含量
除此之外我们还对细胞内的ROS 及Lip ROS 进行了流式细胞术检测,结果如图5A、B 所示。与空白对照组相比,CSE 处理使细胞内Lip ROS及总ROS的水平增加2 倍以上;而给予NaHS 预处理后Lip ROS及ROS 显著减少(P<0.05),且与NaHS 浓度呈正相关。此外,MDA 结果也与ROS 趋势相符,见图5C。GSH-Px是体内重要的抗氧化系统组分之一,如图5D所示,CSE 引起的GSH-Px 水平降低可被NaHS 拮抗,且在高浓度时具有统计学意义(P<0.05)。
5 NaHS 及CSE 处理对细胞内铁自噬-铁死亡相关蛋白表达情况的影响
为了探究NaHS 抵抗CSE 引起的细胞损伤的机制,我们对细胞内铁自噬-铁死亡相关蛋白进行了检测,结果如图6 所示。与对照组相比,单纯CSE 可导致铁自噬-铁死亡相关蛋白NCOA4、FTH1和COX2的水平显著升高(P<0.01),同时GPX4 表达水平显著降低(P<0.05);而不同浓度NaHS可显著逆转CSE单纯刺激的结果,使铁自噬-铁死亡相关蛋白NCOA4、FTH1 及COX2 的表达水平呈现不同程度的下降,GPX4蛋白有所上升(P<0.05),且这些蛋白的变化具有浓度依赖性。
讨 论
慢阻肺是危害我国民众健康的常见病,随着疾病的进展,可能会导致呼吸衰竭,并且造成严重的经济和社会负担,严重影响生命安全和生活质量[6]。慢阻肺的发病以活性氧为基础,活性氧通过激活促炎转录,诱导细胞死亡、细胞衰老和DNA 损伤,损害抗蛋白酶防御能力等途径,促进和增强氧化应激级联反应,进而导致气道炎症及肺气肿[7]。香烟烟雾、空气污染和生物学烟雾是肺部氧化应激的主要外源性来源,并且多种细胞损伤方式参与这些危险因素的致病过程[8],铁死亡是其中一种细胞死亡形式。铁死亡是一种由脂质过氧化以铁依赖的方式引发的细胞死亡形式。已有文献显示CSE 具有激活铁死亡的作用。例如,给予CSE 刺激后,血管平滑肌细胞出现铁死亡特异性标志物PTGS2 上调、脂质过氧化增加和谷胱甘肽消耗增加等铁死亡特征性变化[9]。而在肺部,Park 等[10]对支气管上皮细胞进行CSE 暴露研究,结果表明CSE 可能通过内质网应激和诱导缺氧引起线粒体动态稳态紊乱进而诱导支气管上皮细胞铁死亡。此外,目前最有说服力的一项研究来源于Yoshida 等[2],他们的实验结果显示CSE 可通过NCOA4 介导的铁自噬促进不稳定的铁积累,导致人肺上皮细胞脂质过氧化和铁死亡,参与了慢阻肺的发病。而我们的实验结果显示,随着CSE 浓度的增加,铁死亡标志蛋白COX2表达水平逐渐升高,GPX4逐渐降低,且单纯CSE 刺激可导致细胞内总ROS、Lip ROS、脂质过氧化产物MDA 及活性铁离子显著增加,抗氧化酶GSH-Px 的水平显著降低,以及铁自噬相关蛋白NCOA4 和FTH1 的大量增加,证实CSE介导的肺泡上皮细胞损伤机制中确实有铁死亡参与。

Figure 4.Effects of NaHS and CSE on membrane lipid peroxidation in BEAS-2B cells measured by confocal fluorescence microscopy,using C11-BODIPY as a probe(scale bar=50 μm).The cells were treated with 5% CSE for 24 h with or without 30 min of NaHS(400 μmol/L)pretreatment.BODIPY™581/591 C11 reagent is a sensitive fluorescent reporter for lipid peroxida‑tion,and the fluorescence shifts from red to green upon oxidation in live cells.Mean±SD. n=4.**P<0.01 vs control group;##P<0.05 vs CSE group.图4 共聚焦荧光显微镜检测NaHS及CSE处理对BEAS-2B细胞膜脂质过氧化的影响
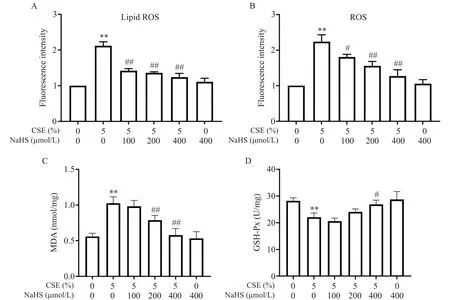
Figure 5.Effects of NaHS and CSE on the levels of lipid ROS(A),ROS(B),MDA(C)and GSH-Px(D)in BEAS-2B cells.The cells were treated with 5% CSE for 24 h with or without 30 min of NaHS pretreatment.Mean±SD. n=4.**P<0.01 vs control(0% CSE+0 μmol/L NaHS)group;#P<0.05,##P<0.01 vs 5% CSE group.图5 NaHS和CSE对BEAS-2B细胞中脂质ROS、ROS、MDA和GSH-Px水平的影响

Figure 6.Effects of NaHS and CSE on the expression levels of ferritinophagy-ferroptosis-related proteins in BEAS-2B cells detected by Western blot.The cells were treated with 5% CSE for 24 h with or without 30 min of NaHS pretreatment.A:the expres‑sion of GPX4 and COX2;B:the expression of NCOA4 and FTH1.Mean±SD. n=4.*P<0.05,**P<0.01 vs control(0%CSE+0 μmol/L NaHS)group;#P<0.05,##P<0.01 vs 5% CSE group.图6 Western blot检测NaHS和CSE对BEAS-2B细胞中铁自噬-铁死亡相关蛋白表达的影响
自噬是在应激、饥饿或缺氧期间维持细胞稳态的生理过程[11]。2014 年Mancias 等[12]通过定量蛋白质组学鉴定NCOA4 为介导铁自噬的特异性受体,提出铁自噬的概念,由此将自噬与铁死亡联系在一起。越来越多的研究也证实铁自噬具有调控铁死亡的作用。例如,Masaldan 等[13]的研究显示,衰老细胞中的铁积累与铁自噬能力受损和铁死亡受抑制有关。Latunde-Dada等[14]的研究显示,半胱氨酸缺失介导的铁蛋白降解通过NCOA4 介导的自噬途径释放铁。Gao 等[15]报道,通过抑制自噬或抑制NCOA4 的表达可抑制铁自噬的发生,从而导致铁蛋白酶相关的细胞不稳定铁和Lip ROS的积聚。基于此,在慢阻肺中抑制铁自噬进而抑制铁死亡的策略有待研究。
H2S 是一种有臭鸡蛋气味的内源性气体信号分子。在本研究中,H2S处理能明显提高CSE 暴露下肺泡上皮细胞的活力,对细胞具有明显的保护作用,这与先前对不同细胞进行H2S 预处理的研究结果一致[16-18]。且目前已有文献报道H2S 可通过抑制铁死亡发挥抗损伤作用,例如H2S 能通过调节Sirt6 而抑制炎症,降低PFC 和BV2 细胞的铁死亡,缓解1 型糖尿病小鼠焦虑样和抑郁样行为[19]。胱硫醚γ-裂解酶/H2S 系统可作为预防骨骼肌铁死亡的靶点[20]。氧化还原失衡是铁死亡的核心机制,脂质过氧化是铁死亡发生过程中最关键的一步,而抗氧化是H2S重要的防护机制[21]。基于这些理论,我们推测H2S抗CSE介导的细胞损伤的机制可能与调控铁自噬-铁死亡途径、抑制细胞内活性铁的产生及脂质过氧化过程有关。
为验证这一假设,接下来我们对H2S处理后的细胞内氧化还原标志物如Lip ROS、ROS、MDA 和GSHPx 水平,细胞内活性铁水平,铁自噬标志蛋白NCOA4 和FTH1,以及铁死亡标志蛋白COX2 和GPX4 进行了检测。与预期结果一致,H2S 处理能够显著增加抗氧化酶GSH-Px 及GPX4 的水平,同时抑制NCOA4、FTH1 和COX2 的表达及活性铁的释放,减少ROS、Lip ROS 和MDA 的产生,且NaHS 浓度越高效果越显著,证实H2S抗CSE诱导的损伤作用至少部分是通过抑制铁自噬、抵抗铁死亡信号通路来实现的。
综上所述,本研究说明H2S能通过减轻细胞内的脂质过氧化失衡和铁超载而减轻CSE 诱导的肺泡上皮细胞铁死亡,这可能是通过抑制NCOA4 介导的铁自噬调控途径来实现的。
