陆地棉一个低毒Bt基因的分子鉴定与染色体定位
2022-02-15陈旭升狄佳春
陈旭升,赵 亮,狄佳春
(江苏省农业科学院 经济作物研究所,农业农村部长江下游棉花与油菜重点实验室,江苏 南京 210014)
转Bt基因的研究最先为Schnepf等[1]的报道。1989年Monsanto公司基于不改变杀虫晶体蛋白氨基酸序列的前提下,采用人工合成与点突变的方法,对来自苏云金芽孢杆菌(Bacillusthuringiensis)的Bt基因进行改造,然后将改造的Bt基因导入棉花,使转基因抗虫棉的抗虫能力得以极大提升[2]。1996年Monsanto公司与棉花育种公司合作,育成商用转Bt基因抗虫棉即保铃棉33B,并开始在生产上大面积推广应用。我国紧跟国际转基因抗虫棉研究的前沿,郭三堆等[3-4]设计并自主合成了具有高活性表达的GFM Cry1A杀虫晶体蛋白结构基因,并将人工合成的Bt基因导入受体棉花,成功获得转基因植株;经与国内育种单位合作,选育出一系列国产转Bt基因抗虫棉。
随着分子标记技术[5-6]的发展,有关抗虫棉不同类型Bt基因的鉴定及其染色体定位的研究也取得很大进展[7-10]。业已研究表明:转基因抗虫棉的抗性维系,既取决于棉花群体的抗虫性纯度,也与棉花受体中毒蛋白表达剂量密切相关[11]。陈旭升等[12]报道,在陆地棉资源中筛选到一个Bt基因低毒蛋白表达的种质系WG-20,其叶样品的Bt毒蛋白含量为88.8 ng/g,对棉铃虫的生物学平均抗性值PK为1.67,表现为低抗;对杂交F1的抗性鉴定显示,该低毒Bt基因对高毒Bt基因呈显性表达。
本研究拟在分子水平上对该Bt基因类型进行鉴定,并构建定位遗传图谱,分析该遗传转化事件与高毒表达Bt基因转化事件的关系,旨在为转Bt基因抗虫棉育种提供多样化视角。
1 材料和方法
1.1 试验材料
采用的试验材料为:转Bt基因低毒蛋白表达种质系WG-20、国产抗虫棉GK-19,非转基因棉花海岛棉胜利1号与陆地棉泗棉3号。配置海陆杂交F1组合:WG-20×胜利1号,在江苏省农科院南京试验田种植杂交F1,开花期进行自交,获得F2分离群体作为Bt基因的定位群体。
1.2 试验方法
1.2.1 种子DNA的提取 取亲本WG-20与胜利1号以及(WG-20×胜利1号)F1、(WG-20×胜利1号)F2的种子。将每粒种子作为1个个体,剥离种壳得种仁。采用单粒棉花种子DNA 快速提取方法提取DNA[13]。
1.2.2 Bt基因类型鉴定 通过设计特异性引物做PCR检测,可以鉴定国产Bt基因与美国Bt基因。特异性引物序列如下[7]:F-1: 5′-CATCTTCACTCGG
TAACATCG-3′(456 bp);F-2: 5′-AGGGAACCTTCAT
CGTGG-3′(310 bp);R: 5′-ATACGTGCCAAGTGCCA
ACC-3′。利用以上引物进行混合PCR扩增,国产Bt基因可获得456 bp大小的特征片段,美国Bt基因将获得310 bp大小的特征片段。对WG-20、GK-19的DNA进行PCR扩增,以清水、非转基因棉花泗棉3号为对照。在恒压90 V条件下,使用1%的琼脂糖凝胶进行电泳,扩增产物的片段大小通过凝胶成像系统观察记录。
1.2.3 群体Bt基因检测与统计 取双亲、F1、F2分离群体的种子DNA进行PCR扩增。其反应程序为:94 ℃预变性4 min;94 ℃变性45 s,56 ℃退火45 s,72 ℃延伸1 min,35个循环;最后72 ℃延伸10 min。采用8.0%的非变性聚丙烯酰胺(PAGE)凝胶,电泳缓冲液为1×TBE,在200 V恒压条件下,对扩增产物进行电泳。电泳结束后,利用银染法进行染色,观察统计各群体具有Bt基因的个体、无Bt基因的个体数量;而后对分离群体进行χ2适合性测验。
1.2.4 Bt基因染色体定位 农业部长江下游棉花与油菜重点实验室前期利用来自Cotton Marker Database(https://www.cottongen.org)提供的SSR引物序列,获得分布于棉花26对染色体上的234对SSR核心引物[14]。在F2群体选取有Bt、无Bt个体各10个,将等量DNA混合。利用234对核心引物,先筛选F2近等基因混池的多态性标记,而后检测F2群体中各个体的基因型。以数字标注多态性条带:与无Bt基因亲本带型相同的标注为1,与有Bt基因亲本带型相同的标注为2,共显性杂合带型标注为3,缺失标注为0。而后采用Join Map 4.0软件进行连锁分析,以确定低毒Bt基因在染色体上的位置。
2 结果与分析
2.1 WG-20的Bt基因来源的分子鉴定
采用检测Bt基因的特异引物,对转Bt基因材料进行分子鉴定,以清水、泗棉3号为空白对照,PCR检测结果见图1。由图1可知,国产抗虫棉GK-19的PCR扩增条带,拟合国产Bt基因的特征引物设计长度456 bp,显示其为转国产Bt基因抗虫棉。种质系WG-20的Bt基因片段大小拟合美国 Bt 基因设计引物的特征片段长度 310 bp,显示WG-20所含的为美国Bt基因。泳道3,4均未见特征扩增条带。

M.DNA Marker;1.GK-19;2.WG-20;3.清水;4.泗棉3号。M.DNA Marker;1.GK-19;2.WG-20;3.Distilled water;4.Simian No.3.
2.2 低毒Bt基因的分离规律
利用PAGE凝胶电泳,对低毒Bt基因亲本WG-20、海岛棉亲本胜利1号以及杂交F1、F2进行Bt基因特征条带鉴定。图2为F2群体部分单株鉴定结果,从图2可以看出,有Bt基因的P1、F1以及F2的大部分个体在310 bp处均出现明显的特征条带;无Bt基因的P2以及编号5,6,20,27,28,35泳道的F2个体则没有出现特征条带。

M.Marker;P1.WG-20;P2.胜利1号;F1.WG-20×胜利1号;1—36.F2群体部分单株。M.Marker;P1.WG-20;P2.Shengli No.1;F1.WG-20×Shengli No.1;1—36.Partial plants of F2 population.
依据电泳的特征条带,统计各群体Bt基因的分离情况见表1。由表1可见,种质系WG-20的43个个体均含有Bt基因,而胜利1号的45个个体都没有Bt基因;杂交F1中均检测到Bt基因特征条带,显示该Bt基因呈显性表达。分离F2群体中有Bt基因的个体数为143、无Bt基因个体数为35,采用χ2检测符合3∶1的孟德尔理论分离比例,显示该Bt基因是受1对显性基因控制的质量性状,即该外源基因是以单个位点的方式插入陆地棉受体。因此,可采用SSR分子标记对其进行基因定位。

表1 WG-20与胜利1号杂交后代的Bt基因分离情况Tab.1 Isolation of Bt gene from the offspring of WG-20 crossing Shengli No.1
2.3 低毒Bt基因染色体定位
利用本实验室前期筛选获得的234对核心引物,通过对定位群体F2的有Bt和无Bt两近等基因混池进行差异标记筛选,有40对引物具有多态性。而后采用这40对多态性引物对F2作图群体中的每个个体的基因型进行检测,并采用Join Map 4.0软件进行关联分析,结果发现,其中的1对引物BNL1665与Bt基因紧密连锁,二者的初始遗传距离为7.8 cM。查阅Guo等[15]2007年发表的棉花分子标记遗传图谱,显示引物BNL1665位于棉花第10号染色体上。据此查找并合成在第10号染色体上距离该标记上下50 cM区间的所有SSR引物。利用亲本WG-20与胜利1号的DNA再筛选其中的多态性引物,并以多态性引物检测F2作图群体中的每个个体的基因型。试验结果采用Join Map 4.0软件进行连锁遗传分析,显示共有14对引物与目的基因Bt相连锁,分别是NAU5166、NAU3574、NAU456、BNL256、cgr6745、cgr5406、cgr6546、NAU7110、HAU3201、BNL1665、dPL0468、NAU5316、BNL2960、NAU3122。基因Bt位于SSR标记NAU7110和HAU3201之间,其遗传距离分别为0.9,4.4 cM(图3)。由此将该Bt基因定位在棉花第10号染色体上。
3 结论与讨论
20世纪80年代在美国出现植物转基因工程技术。然而,将外源基因导入植物受体只是遗传转化的第一步,只有外源基因在受体中稳定整合和有效表达,才能培育出具有新遗传性状的转基因品种,最终才可能在生产上推广应用。然而许多外源基因转化体,其目的基因在受体中的表达活性弱、产量低。产生这种现象的原因可能是由转基因沉默或位置效应所致。
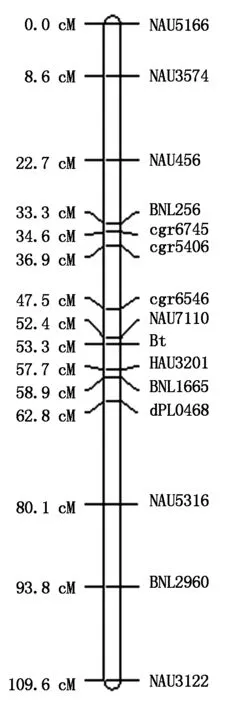
图3 低毒Bt基因位于Chr.10的连锁遗传图谱Fig.3 Genetic linkage map of low-toxic Bt gene in Chr.10
已有许多途径与方法可以诱导基因沉默[16-18];但关于基因表达的位置效应研究报道则较少[19]。所谓位置效应(Position effect)是指外源基因在受体中插入的位置不同所引起的基因表达程度的差异。外源基因整合到宿主染色体后会受到宿主染色质结构和表达调控元件的影响[20]。在不同染色体区域,转基因表达效率不同,有的强烈表达,有的则表现为基因沉默。一般来说,外源基因整合到甲基化程度高、转录活性低的异染色质区时,则趋向沉默;而外源基因整合到富含转录活性的常染色质区时,则趋向活跃表达[21]。
已知国产抗虫棉GK-19的Bt基因插入棉花第20染色体,美国抗虫棉33B中的外源Bt基因则插入棉花第26染色体[10]。曾检测GK-19、33B叶组织的Bt毒蛋白表达量分别高达1 032.7,1 123.9 ng/g,且对棉铃虫均表现为高抗;而种质系WG-20,其叶组织的Bt基因毒蛋白表达量仅88.8 ng/g,且对棉铃虫表现为低抗[10-12]。染色体定位结果显示:WG-20中的外源Bt基因插入到棉花第10号染色体上,与GK-19、33B中的外源Bt基因整合的染色体完全不同。由此推测:陆地棉种质系WG-20中的Bt毒蛋白量呈低水平表达,可能是该外源Bt基因整合到棉花Chr.10的异染色质区域,因位置效应导致外源基因趋向沉默。
