拟南芥液泡H+-ATP酶E1亚基基因AtTUF启动子的克隆及表达分析
2022-02-15孙海丽王文佳丁位华王妮娜柳凯恒李成伟
孙海丽,梁 静,王文佳,丁位华,王妮娜,柳凯恒,李成伟
(1.河南科技学院 生命科技学院,河南 新乡 453003;2.河南省粮食作物基因组编辑工程技术研究中心, 河南 新乡 453003;3.河南省现代生物育种协同创新中心,河南 新乡 453003)
液泡H+-ATP酶(Vacuolar-H+-ATPase,V-ATPase,VHA)是一种高度保守的多亚基旋转酶,广泛存在于所有真核细胞中,定位于液泡膜和细胞内膜系统的其他隔间(内质网、高尔基体、囊泡及内体等)中[1-2],具有ATP水解驱动的质子泵功能。VHA传统上被认为是一种“管家”酶,可以建立用于二次活性转运的电化学质子梯度,并维持pH值稳态[3],在植物的生长发育、形态建成、新陈代谢及应激反应等过程中起着关键作用[4-5]。该酶由亲水的V1和疏水的V0共2个区域构成,其中,V1位于膜外胞质区,呈球茎状,由A~H 共8个亚基组成,主要负责ATP的水解;V0整合于膜中,由a、c、c′、c″、d和e共6个亚基组成,主要负责将质子从细胞质转移至液泡,同时作为V1聚合和装配的基点[6-7]。
VHA酶E亚基在植物进化过程中较为保守[8],并在植物的生长发育过程及响应非生物胁迫中均发挥着重要的作用。Dabbous等[9]发现,盐生植物香雪球VHA酶E1亚基基因LmVHA-E1的过表达可以提高拟南芥对盐和渗透胁迫的耐受性。Zhu等[10]研究发现,水稻VHA酶E1亚基(OsVHA-E1)主要定位于反面高尔基体网状结构(Trans golgi network,TGN)和液泡中,参与了内膜腔内pH值稳态以及高尔基体形态和TGN的维持。Zhang等[11]发现,小麦VHA酶E亚基定位于细胞质中,该基因启动子区含有响应非生物胁迫的顺式作用元件,且该基因表达受干旱、脱落酸(Abscisic acid,ABA)、盐、冷害及H2O2的诱导,将该基因在拟南芥中过表达后能增强植物对盐类和甘露醇的耐受性。Zhang等[12]研究发现,在盐胁迫下,构树根中VHA酶活性的升高与VHA酶E亚基转录本和蛋白质水平的升高呈正相关,暗示E亚基在植物对盐胁迫响应中发挥着重要作用。Zhao等[13]的结果表明,在拟南芥中过表达小麦VHA酶E亚基基因能够在盐胁迫下促进种子萌发、根系生长和成年植株生长。冯露等[14]研究表明,谷子VHA酶E亚基SiVHA-E基因能不同程度响应盐和冷胁迫以及植物激素ABA、水杨酸(Salicylic acid,SA)、茉莉酸甲酯(Methyl jasmonate,MeJA)等,且过表达SiVHA-E基因可以显著提高植物的耐盐性。拟南芥中有3个VHA酶E亚基,其中,E2是花粉特异性表达基因;E3主要在外围组织中表达;E1是胚胎发育的主要亚型[15],对胚胎的生长发育必不可少,缺乏E1亚基的胚胎发育不会超过球形胚阶段且高尔基体异常堆叠[6,16],该亚基编码基因AtTUF(又被称为TUFF、EMB2448、VHA-E1、VHAE1,基因号AT4G11150)的突变会导致胚胎死亡[15],表明AtTUF基因在拟南芥种子发育过程中具有关键作用。Dettmer等[17]研究表明,拟南芥AtTUF蛋白定位于液泡膜上。虽然关于拟南芥AtTUF的功能及亚细胞定位都有了一定的研究,但是关于AtTUF基因启动子及组织表达特性的研究目前还未见详细报道。
为了研究AtTUF基因的组织表达模式及转录调控,克隆了拟南芥AtTUF基因的启动子序列并对其进行了顺式作用元件预测分析,构建了AtTUF启动子的GUS融合表达载体pBI121-pAtTUF,通过农杆菌介导的遗传转化筛选得到拟南芥转基因植株,对其进行了GUS染色,并对该基因的组织表达模式进行了分析,旨在为深入分析AtTUF基因的调控模式及功能提供依据。
1 材料和方法
1.1 试验材料
1.1.1 植物材料 哥伦比亚(Columbia)野生型拟南芥(Arabidopsisthaliana)种子,由河南科技学院植物激素与化控研究室保存。
1.1.2 主要试剂 限制性内切酶Hind Ⅲ和BamHⅠ、高保真酶PrimeSTAR®GXL DNA Polymerase、MiniBEST Plant RNA Extraction Kit、PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)及TB Green®Premix Ex TaqTMⅡ均购自TaKaRa公司;T4DNA连接酶购自NEB公司;ClonExpress Ⅱ One Step Cloning Kit 购自南京诺唯赞生物科技有限公司;琼脂糖凝胶回收试剂盒及质粒提取试剂盒购自天根生化科技有限公司;GUS染液购自北京华越洋生物科技有限公司;(±)ABA、IAA购自Sigma公司;MeJA购自索莱宝公司;聚乙二醇(PEG 8000)购自Amresco公司。
1.1.3 载体与菌株 大肠杆菌感受态细胞DH5α及农杆菌感受态细胞GV3101均购自北京庄盟国际生物基因科技有限公司;表达载体pBI121由周口师范学院徐克东老师馈赠。
1.2 试验方法
1.2.1 拟南芥的种植与培养 将种子用0.5% NaClO消毒10 min,无菌水漂洗5次,播种于MS培养基,4 ℃放置3 d,置于光照培养箱培养,培养条件:21 ℃,光照强度为80 μmol/(m2· s),昼夜光周期为16 h光照/8 h黑暗。培养10~14 d移入土中放于温室培养,温室培养条件:20~22 ℃,光照强度为120 μmol/(m2·s),昼夜光照周期为16 h光照/8 h黑暗,每周浇水1~2次。
1.2.2 拟南芥基因组DNA的提取 采用SDS法从拟南芥叶片中提取基因组DNA。
1.2.3AtTUF基因启动子的克隆 在TAIR网上下载AtTUF基因翻译起始密码子ATG上游2 000 bp的 5′端侧翼序列作为参考。根据启动子序列利用Primer Premier 5.0 设计特异性引物,在上下游引物的5′端分别加上Hind Ⅲ和BamHⅠ酶切位点及酶切位点前15个碱基的目的载体序列,以便于后续采用无缝克隆的方法将AtTUF启动子构建于表达载体pBI121上。上游引物AtTUFpro-F序列:5′-GAC
CATGATTACGCCAAGCTTGGTAATGATGAGCCTTC
TTC-3′,下游引物AtTUFpro-R序列:5′-GGACTGAC
CACCCGGGGATCCTTTTACCGGGAAAATCGGCGGT
C-3′(下划线标注的为载体序列和酶切位点,引物由武汉金开瑞生物公司合成)。PCR反应体系:5×GXL Buffer 5 μL,GXL酶 0.5 μL,上、下游引物(20 μmol/L)各0.5 μL,拟南芥DNA 2 μL,dNTP(2.5 mmol/L)2 μL,ddH2O 14.5 μL。PCR扩增程序:98 ℃ 10 s;60 ℃ 15 s,68 ℃ 2 min 10 s,30个循环。
1.2.4AtTUF基因启动子表达载体的构建 PCR产物经1.2%的琼脂糖凝胶电泳后,切胶回收与预期分子质量大小一致的目标条带,用限制性内切酶Hind Ⅲ和BamHⅠ酶切pBI121质粒并回收载体片段,然后用重组酶连接pBI121载体片段与AtTUF启动子片段,参照ClonExpress Ⅱ One Step Cloning Kit说明书配制反应体系,37 ℃孵育30 min后迅速置于冰上5 min;将重组产物通过热激法转化大肠杆菌感受态细胞DH5α,37 ℃培养过夜;通过菌落PCR和小量酶切鉴定出阳性克隆,并送至武汉金开瑞生物公司测序;将测序结果与AtTUF基因组序列比对,测序正确的重组质粒命名为pBI121-pAtTUF。
1.2.5AtTUF基因的启动子序列分析 利用PlantCARE数据库 (http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)和PLACE(http://www.dna.affrc.go.jp/htdocs/PLACE/)对克隆的AtTUF启动子序列的顺式作用元件进行在线预测分析。
1.2.6 表达载体的农杆菌转化 利用热激法将构建正确的重组质粒转化农杆菌感受态GV3101,将转化液涂布于含50 μg/mL卡那霉素和50 μg/mL利福平的YEB固体平板上,28 ℃培养2~3 d,通过农杆菌菌落PCR鉴定阳性菌落。
1.2.7 拟南芥植株的遗传转化与阳性苗筛选 采用花芽浸蘸法[18]转化哥伦比亚野生型拟南芥。将转基因的拟南芥植株培养至成熟,收取T0种子,将种子消毒后点播在含有50 μg/mL卡那霉素、40 μg/mL羧苄青霉素的MS平板上,春化3 d后放入培养箱培养10~14 d,挑选平皿上能长出真叶与根且生长状态良好的T1阳性幼苗移栽培养,提取叶片基因组DNA进行PCR鉴定。收取T1阳性株系种子播于含有卡那霉素的MS平板上,筛选单拷贝插入的T2幼苗,直至筛选出T3纯合株系,用于后续试验。
1.2.8AtTUF基因启动子的表达模式分析 取培养7~14 d的T3植株幼苗,成苗植株的莲座叶及侧枝、茎生叶、茎、花序,不同时期的果荚及T3纯合体种子萌发后的幼苗,浸入GUS染色液中,37 ℃避光染色;用70%乙醇脱色1 h,95%乙醇脱色(每隔2 h更换染液一次)至绿色褪去,用40%,20%,10%,5%乙醇各处理5 min,再用25%,50%甘油各处理15 min,用50%甘油压片,于T视显微镜(AXIO Zoom.V16,Zeiss)下拍照。
1.2.9 激素与胁迫处理下AtTUF基因启动子的表达分析 选取pBI121-pAtTUF转基因纯合株系种子,消毒后播种于含有卡那霉素的MS平板上,春化3 d、光照培养9 d后,取6株长势一致的幼苗分别转移至含有10 μmol/L(±)ABA、10 μmol/L IAA、50 μmol/L MeJA、200 mmol/L NaCl的MS平板上,光照或黑暗(用锡箔纸遮盖)培养3 d后进行GUS染色;参考Verslues等[19]的方法进行PEG模拟干旱胁迫处理,将20% PEG 8000倒于无菌凝固的MS平板上,覆盖平衡24 h后弃去PEG溶液,吹干后即为含有PEG的MS平板,取光照培养10 d的幼苗转移至含PEG的MS平板上,光照培养2 d后染色。37 ℃染色1 h后脱色,拍照。
1.2.10AtTUF基因在不同组织中的表达检测 取盛花期野生型植株的根、主茎、莲座叶、花,发育期角果及成熟期的干种子,提取RNA,反转录成cDNA后,进行实时荧光定量PCR扩增,检测AtTUF在不同组织中的表达水平。实时荧光定量PCR以ACTIN基因为内参,引物序列为ACTIN-F: 5-′GGTAACATTGTGCTCA
GTGGTGG-3′,ACTIN-R:5′-AACGACCTTAATCTTCATGC
TGC-3′;AtTUF-F:5′-GCTGGTAAAGCAAAGGT-3′,AtTUF-R:5′-AATGCCACATCAAGACG-3′。反应体系为20 μL,反应程序:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 34 s,40个循环。采用2-ΔΔCt法计算AtTUF基因的相对表达量。
2 结果与分析
2.1 AtTUF启动子的克隆
以野生型拟南芥基因组DNA为模板,利用引物对AtTUFpro-F/pro-R扩增AtTUF的启动子片段,结果如图1所示,条带大小与预期目的基因条带大小(2 000 bp)相符。将该条带回收并纯化,测序比对后发现,扩增片段与NCBI网站上提供的AtTUF基因ATG上游2 000 bp的启动子序列一致,表明已成功克隆AtTUF的启动子pAtTUF。

1.AtTUF启动子扩增结果;M.DNA 标准。1.PCR products of AtTUF promoter;M.Marker.
2.2 pBI121-pAtTUF表达载体的构建
用限制性内切酶BamH Ⅰ和Hind Ⅲ酶切pBI121质粒,结果如图2-A所示,将pBI121质粒上的启动子片段切下,回收大片段。用无缝连接酶连接载体与pAtTUF片段,转化DH5α,挑取单克隆进行菌落PCR鉴定,结果显示,1~5号均扩出了与预期大小相符的条带(图2-B)。挑取4号菌斑摇菌提取质粒,并用Hind Ⅲ和BamHⅠ进行酶切鉴定,结果切出了一条约为2 000 bp的片段(图2-C),与预期大小相符。将该重组质粒送公司测序,对测序结果进行比对,发现其与目的序列一致,表明表达载体pBI121-pAtTUF构建成功。将该质粒转化农杆菌感受态GV3101,并通过菌落PCR验证,挑取阳性菌斑摇菌备用。

A.pBI121的酶切结果:1.Hind Ⅲ和BamHⅠ酶切pBI121的结果;M.DNA 标准。B.pBI121-pAtTUF重组质粒的大肠杆菌菌落PCR鉴定:1—5.单菌落;M.DNA 标准;6.阳性对照(AtTUF启动子PCR回收产物);7.阴性对照。C.pBI121-pAtTUF重组质粒的酶切鉴定:1.Hind Ⅲ和BamHⅠ酶切pBI121-pAtTUF的结果;M.DNA 标准。
2.3 AtTUF启动子顺式作用元件分析
利用PlantCARE和PLACE网站对AtTUF基因翻译起始密码子ATG上游2 kb的侧翼序列进行顺式作用元件分析(图3和表1),结果表明,AtTUF启动子中除了含有真核生物启动子的基本元件CAAT-box和TATA-box外,还包含ABA响应元件ABRE、参与MeJA响应的顺式作用元件CGTCA-motif、生长素响应元件TGA-element和AuxRR-core、参与干旱诱导的MYB结合位点 MBS、厌氧诱导必需的顺式作用元件ARE、胚乳表达所需的顺式作用元件GCN4-motif、分生组织表达相关顺式作用调节元件CAT box及参与玉米醇溶蛋白代谢调节的顺式作用调节元件O2-site,同时,还包括光响应元件G-Box、G-box、Box Ⅱ、Ⅰ-box、TCT-motif、Box 4及AE-box。上述结果表明,AtTUF基因的表达可能受部分激素、逆境胁迫及光信号的调控。

图3 拟南芥AtTUF 启动子核心顺式作用元件位点分析Fig.3 The sites analysis of key cis-acting elements in AtTUF promoter in Arabidopsis

表1 拟南芥AtTUF启动子的主要顺式作用元件Tab.1 Key cis-acting elements in AtTUF promoter in Arabidopsis
2.4 拟南芥转基因阳性株系的筛选
采用农杆菌介导的花芽浸蘸法,用含pBI121-pAtTUF的农杆菌菌液对野生型拟南芥进行遗传转化,待转基因拟南芥植株种子成熟后,收获种子并将其播于含有卡那霉素的MS培养基上筛选T1阳性苗,结果如图4-A所示,转基因阳性植株在含有卡那霉素的MS培养基上可以长出真叶及较长根系,而非转基因幼苗只能长出子叶且叶片黄化、根系不能伸长。将阳性植株移栽,提取基因组DNA并进行PCR鉴定,由鉴定结果可知(图4-B),被检测的T1转基因拟南芥植株中均扩增出了801 bp的GUS标签,而野生型植株中扩增不到目的条带,表明所检测的植株均为阳性植株。成熟后收获T1植株种子,用卡那霉素筛选转pBI121-pAtTUF的T2株系,挑选单拷贝插入(抗与不抗比例为3∶1)的株系繁种,并用卡那抗性筛选T3纯合株系。
2.5 AtTUF基因启动子组织表达模式分析
为了观察AtTUF基因启动子在植物生长发育过程中的组织表达模式,分别选取培养基上萌发7~14 d 的T3转基因纯合幼苗整株及盆栽6周植株的叶、茎、花、果荚及种子等进行GUS组织化学染色,结果显示,在幼苗期,AtTUF基因启动子驱动的GUS主要在子叶、真叶及根(图5-A~D)中表达,在表皮毛(图5-D)中也有较高表达,在胚轴中不表达;在成苗期,AtTUF基因驱动的GUS在莲座叶(图5-E),表皮毛(图5-F~G),成熟的柱头、花丝、花药、花粉粒(图5-H、J),萼片(图5-I),幼嫩角果(图5-L)中表达量均较高,在主茎(图5-F)、花瓣(图5-H、J)、发育期角果和种子(图5-M~O)中有一定表达,在茎生叶及茎生叶侧枝中(主要集中在表皮毛中表达)表达较弱(图5-F、G),在莲座叶侧枝的茎(图5-K)、成熟期角果(图5-P)及种子(图5-P、Q)中未检测到表达;在刚萌发幼苗的叶和胚轴中强烈表达,在根毛中有一定表达,在根尖区域表达较弱(图5-R、S)。

1.表达载体pBI121-pAtTUF质粒(正对照);2—9.转基因拟南芥植株;10.野生型拟南芥(负对照);M.DNA标准。1.The plasmid of expression vector pBI121-pAtTUF (Positive control);2—9.Transgenic Arabidopsis;10.Wild type Arabidopsis(Negative control);M.Marker.

A~Q.T3纯合体幼苗及成苗植株组织;R~S.T3种子萌发后。A.子叶期;B.四叶期;C.六叶期;D.七叶期;E.莲座叶;F.主茎、茎生叶与茎生叶侧枝;G.茎生叶侧枝顶部叶片及花序(F红色方框中放大图);H.主茎花序;I.萼片;J.单朵花;K.莲座叶侧枝;L.幼嫩角果;M.不同发育时期的角果及种子;N.果皮、假隔膜及未成熟种子;O.发育期种子(N红色圆圈中放大图);P.成熟期角果;Q.成熟期种子;R.光照培养48 h的幼苗;S.光照培养60 h的幼苗。
2.6 AtTUF基因启动子在激素与逆境胁迫处理下的表达模式分析
为了验证AtTUF基因启动子是否能够响应植物激素及非生物胁迫信号,取pBI121-pAtTUF转基因T3纯合幼苗分别进行ABA、IAA、MeJA、NaCl、暗处理及PEG胁迫处理,并进行GUS化学染色,结果如图6所示。除MeJA处理组中幼苗染色与对照(T3纯合幼苗正常培养)相比变化不明显外,其他处理均使幼苗染色明显变淡,表明ABA、IAA、盐、暗处理及干旱胁迫均可抑制GUS基因的表达,暗示AtTUF基因启动子对植物激素ABA与IAA及盐、光、干旱等信号均有广泛的响应能力。Hanitzsch等[1]研究发现,AtTUF基因表达受干旱胁迫的显著抑制,这与本研究结果一致。
2.7 AtTUF基因表达特性分析
利用实时荧光定量PCR技术对盛花期(移苗后28 d左右)拟南芥的根、茎、莲座叶、盛开的花,发育期的角果及刚成熟的干种子中AtTUF基因的表达量进行了测定,结果如图7所示,该基因在发育期角果中的表达量最高,在花和干种子中次之,在叶中有一定表达,在根中的表达量最低。
3 结论与讨论
启动子是指基因编码区上游的非编码DNA区域,包含转录因子可以识别的特定序列,在植物基因表达和调控过程中起着重要作用[20-24]。对AtTUF启动子区域的顺式作用元件分析发现,其启动子区存在一些重要的转录调控元件,包含光反应元件MRE、G-box、Box Ⅱ、Ⅰ-box等,还包含与干旱诱导有关的MYB结合位点MBS,参与生长素反应的顺式作用元件TGA-element及AuxRR-core,ABA响应顺式作用元件ABRE和参与MeJA反应的顺式作用调控元件等。其中,Ⅰ-box 和G-box可能是光合组织表达所必需的[20],MBS和G-box是可将乙烯或脱落酸和胁迫整合到光周期反应的协调基序[25]。MYB元件和MYC元件对干旱和盐胁迫均具有响应作用。ABRE元件一般被认为是参与ABA信号相关的顺式作用元件,存在于许多抗逆基因的启动子区域[26],拟南芥中AtbZIP1基因可以与ABRE元件结合参与ABA依赖的信号传导通路[27]。本研究发现,AtTUF的启动子活性受ABA、IAA、暗处理、盐胁迫及PEG胁迫的抑制,这可能因为其启动子区含有多种响应光、激素及非生物胁迫的元件所致,但AtTUF的启动子活性不受MeJA的影响,这与Dettmer等[17]的研究结果相符。而Hanitzsch等[1]通过半定量试验发现,AtTUF基因表达受盐胁迫的轻微诱导,大约被上调10%,关于AtTUF基因表达是受盐胁迫诱导还是抑制,尚有待通过实时定量试验进一步验证。
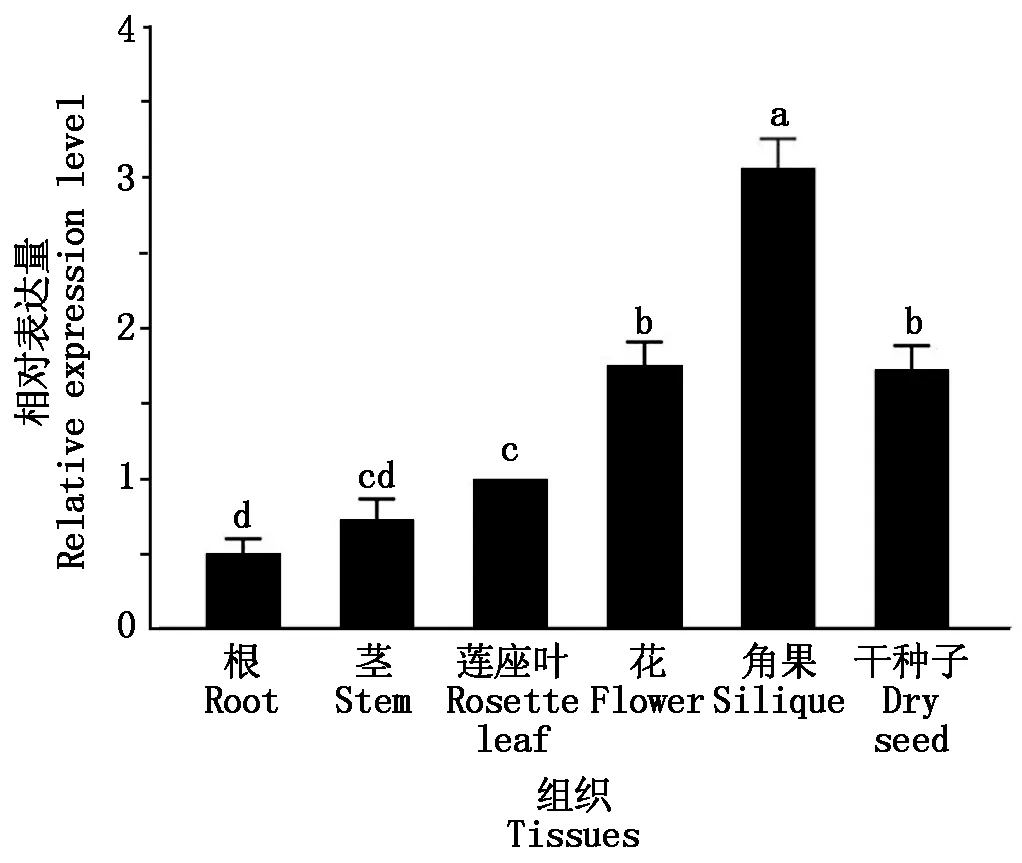
不同小写字母表示AtTUF基因在不同组织中的表达量差异显著(P<0.05)。The different lowercase letters indicate significant differences in the expression of AtTUF gene in different tissues at 0.05 level.
本研究构建了pBI121-pAtTUF的融合表达载体并转化了拟南芥,对转基因阳性植株的GUS染色表明,AtTUF启动子在叶片(叶肉细胞及表皮毛)与幼嫩果荚中的表达量较高,在生殖系统(萼片、成熟花药、花粉粒、柱头)及发育早期的种子中也有较高的表达,在根和叶柄中也有一定的表达,这与Hanitzsch等[1]的研究结果一致,与拟南芥eFP网上预测的AtTUF基因表达模式基本一致。但是成熟的角果及其种子并未被染色,而定量结果却显示,AtTUF基因在刚成熟的干种子中也有一定表达,这可能是由于成熟角果及种子被干燥的果皮及种皮包裹而导致不易被染色。
研究表明,AtTUF基因对于植物的胚胎发育至关重要[15,17],但目前关于AtTUF基因的抗逆性及其调控机制的研究并不多。由于AtTUF启动子区含有部分激素响应调控元件与胁迫相关反应元件,本研究对pBI121-pAtTUF转基因拟南芥T3纯合体幼苗进行ABA、IAA、MeJA、盐、暗处理及PEG胁迫处理后初步发现,AtTUF启动子活性受ABA、IAA、暗处理、盐及PEG的抑制,表明AtTUF可能参与了对ABA与IAA信号及盐、暗、干旱等非生物胁迫信号的响应,这仍需要进一步试验验证。在今后的研究中,还需对逆境胁迫处理后的AtTUF基因表达变化进行实时定量分析。
本研究克隆了拟南芥VHA酶E1亚基基因AtTUF的启动子序列,分析了其顺式作用元件,构建了由其驱动GUS的植物表达载体,进行了拟南芥的遗传转化,通过GUS染色及荧光定量PCR分析了该基因及其启动子的组织表达模式。结果表明,AtTUF基因启动子驱动的GUS在拟南芥幼苗期的叶片与根中、成苗期的叶片、萼片,成熟的柱头、花药、花粉粒及幼嫩角果中均有表达;且AtTUF启动子区含有ABA、IAA等激素响应调控元件及干旱、厌氧等逆境胁迫相关的响应元件,暗示该基因可能参与了逆境信号响应。本研究结果有助于深入研究AtTUF基因在逆境胁迫中的功能及其表达调控规律。
