禽白血病病毒p27蛋白多克隆抗体的制备及POCT检测方法的建立
2022-02-15龚柳菲宋祥军祁克宗
邵 颖,黄 燕,杨 艳,龚柳菲,宋祥军,涂 健,祁克宗
(安徽农业大学 动物科技学院,安徽 合肥 230036)
禽白血病病毒(Avianleukosisvirus,ALV)是可引起家禽的淋巴性白血病和髓样性白血病等肿瘤疾病的致癌逆转录病毒,是给全球范围内家禽产业造成严重经济损失的病原体之一[1-4]。ALV天然条件下仅传染鸡,以垂直传播为主要的传播形式,会导致病鸡的免疫防控能力降低,进一步造成患病鸡多重传染[5]。依据病毒包膜糖蛋白的抗原构造、宿主范畴以及不同毒株之间的彼此干扰等,可将ALV划分为A~K 11个亚群[6],其中J亚群(ALV-J)危害最大,给全球范围内家禽产业带来了不可估计的损失[7-9]。ALV的编码区含编码基因gag、pol和env共 3个,ALV-p27存在于gag基因上并在ALV各亚群中有高度的同源性和保守性,其翻译的p27蛋白是病毒的核心蛋白,是免疫学方法检测ALV选择的主要抗原成分[10-11]。
ALV实验室常用的检测方法有病毒分离、酶联免疫吸附(ELISA)、间接免疫荧光测定(IFA)、聚合酶链式反应(PCR),一般都对专业操作要求高、操作复杂且仪器昂贵,不适用于大规模的临床检测[12-14]。此外,由于某些内源性逆转录病毒(例如EAV-HP家族)可能表达p27蛋白,因此它会导致检测的假阳性高[15],所以,迫切需要一种用于诊断ALV的快速和准确的方法。
即时检验(Point-of-care testing,POCT)是在现场使用便携式分析仪和快速诊断套件进行的实时检查,相比实验室检查的繁琐,其操作简便、耗时短、不需要专业技术人员操作,可实现样本的快速检测[16-18]。目前,POCT技术已研发出一系列产品在多个领域得到初步推广,未来发展前景良好[19]。荧光免疫层析技术(Lateral flow immunoassay,LFIA)是基于抗原抗体特异性免疫反应的新型膜检测技术。其基本原理是将特异性识别待检物质的抗原(或抗体)和二抗分别固定在硝酸纤维素膜(NC膜)上,形成检测线(T线)和质控线(C线),以ALV的p27蛋白制备多克隆抗体,从而建立荧光微球免疫层析试纸条检测,检测过程操作简单,灵敏度高[20]。
因此,本研究通过制备禽白血病病毒p27多克隆抗体为基础,初步建立了POCT荧光微球免疫层析定性检测ALV的方法,旨在为禽白血病的检测提供一种更为简便的方法,为基层兽医临床检测提供便利。
1 材料和方法
1.1 材料和试剂
pGEX-6P-1质粒、pET-32a(+)质粒、大肠杆菌、大肠杆菌DH5α感受态细胞、大肠杆菌BL21感受态细胞、禽白血组织样品均由兽医病理生物学与疫病防控安徽省重点实验室保存,山羊抗兔IgG、山羊抗鼠IgG均购于上海碧云天生物科技有限公司。
试验动物,1只2 kg左右的新西兰白兔,6只BALB/c小鼠饲养在动物科技学院动物房。
硝酸纤维素膜(NC膜)、PVC底板、吸水纸、样品垫均为必欧瀚生物技术(合肥)有限公司提供。
主要试剂:2×Taq Master Mix、Phanta Super-Fidelity DNA Polymerase、SYBR Green Ⅰ荧光染料,购自南京诺唯赞生物科技有限公司;弗氏完全佐剂、弗氏不完全佐剂、HRP标记的山羊抗兔IgG、HRP标记的山羊抗鼠IgG、Protein A+G Agarose购自上海碧云天生物科技有限公司;未标记羊抗小鼠IgG购自博士德生物有限公司。
1.2 p27基因的扩增和重组质粒的构建
参考本实验室保存的pGEX-6p-1、pET-32a线性化质粒,利用Oligo软件设计带同源臂的p27的特异性引物,送到上海生工生物工程技术服务有限公司合成,以本实验室保存的ALV-p27基因为模板,PCR扩增目的片段。引物序列如下(划线部分为同源臂序列):
32a-p27-F:CAAGGCCATGGCTGATATCATGCCTGT
AGTGATTAAGACAG;32a-p27-R:CGGAGCTCGAATTCG
GATCTTAGGCCGCGGCTATGCCT。
6P-1-p27-F:TCCCGGGTCGACTCGAGATGCCTG
TAGTGATTAAGACAG;6P-1-p27-R:TCCCGGGTCGA
CTCGAGTTAGGCCGCGGCTATGCCT。
反应完成后,回收带同源臂的目的片段,与本实验室保存的线性化pGEX-6P-1、pET-32a质粒载体分别进行连接,配成10 μL体系。再将PCR管置于冰上冷却5 min后,加入大肠杆菌DH5α感受态细胞中,混匀加入700 LB培养基,5 000 r/min离心3 min。取沉淀涂布在含有Amp抗性的LB平板上。PCR筛选出的阳性质粒,抽提质粒,将提取质粒的DNA转化到大肠杆菌BL21感受态细胞,用含Amp的平板进行过夜培养,挑取单菌落扩增培养后,PCR鉴定后由公司测序,验证序列的正确性。
1.3 诱导表达重组蛋白
分别取1 mL经鉴定过的含阳性重组质粒pET-32a-p27和pGEX-6P-1-p27的BL21菌液转接到含Amp(1 μg/mL)LB液体培养基,于37 ℃、200 r/min的摇床振荡培养3~4 h,至OD值达到0.4~0.6即可;加入诱导剂(IPTG)至终浓度为0.5 mmol/L,放入16 ℃、120 r/min的摇床培养16 h。空质粒菌液作为对照菌。离心收集菌体,PBS重悬菌体后超声破碎至澄清,分别收集全菌液、沉淀、上清进行SDS-PAGE电泳,对其表达情况与可溶性进行分析。
16 ℃下IPTG诱导16 h的空载质粒溶液、未诱导阳性重组菌溶液、诱导后阳性重组菌溶液、诱导后的上清和沉淀进行SDS-PAGE凝胶电泳后,进行考马斯亮蓝染色。
1.4 重组蛋白的纯化
分别将带有His标签的p27蛋白和带有GST标签的重组蛋白,按照His柱标签蛋白纯化试剂盒和GST柱标签蛋白纯化试剂盒说明书进行纯化操作,用洗脱缓冲液洗脱目的蛋白。
1.5 多克隆抗体的制备与鉴定
免疫之前分别对小鼠、白兔进行采血,分离出阴性血清-80 ℃保存备用。然后按照BCA试剂盒测定His-p27蛋白与GST-p27蛋白的浓度,用PBS进行稀释处理。首次免疫,His-p27融合蛋白与弗氏完全佐剂等量混合,振荡仪振荡乳化,不会分层即可,免疫BALB/c小鼠7只,每只小鼠100 μg,背部多点皮下注射;14 d后第2次免疫,融合蛋白与弗氏不完全佐剂等容量混合,同样处理后,每只小鼠50 μg,背部注射;每隔14 d免疫1次,一共免疫5次。最后一次向腹腔注射融合蛋白。结束后分离阳性血清,-80 ℃保存备用。GST-p27蛋白与等体积的弗氏完全佐剂混匀后,注射新西兰大白兔1只,7 d 1次,共5次。心脏采血,分离阳性血清,-80 ℃保存备用。
1.6 血清型效价的测定
首先确定GST-p27蛋白与His-p27蛋白最佳包被浓度,根据最佳稀释比例分别测定鼠源多克隆抗体和兔源多克隆抗体的血清效价。分别将纯化后的GST-p27蛋白与His-p27蛋白用包被液进行梯度稀释,置于37 ℃恒温箱2 h。每孔加入 PBST、封闭液,置于37 ℃恒温培养箱 2 h。弃去封闭液,洗涤3次。分别向酶标板中加入100 μL按梯度稀释的鼠血清和兔血清作为待测样品,以鼠阴性血清、兔阴性血清作为阴性对照,37 ℃恒温箱放置1 h。鼠血清中加入100 μL按1∶5 000稀释的HRP标记山羊抗鼠IgG,兔血清中加入100 μL按1∶5 000稀释的HRP标记山羊抗兔IgG,37 ℃恒温箱放置1 h。避光加入100 μL TMB显色液,避光反应30 min。每孔加入100 μL反应终止液终止反应。使用酶标仪在450 nm波长下读数。计算分析 P/N值确定融合蛋白最佳包被浓度。根据最佳包被浓度测定抗体效价。阳性血清与阴性血清按照 1∶100、1∶200、1∶400、1∶800、1∶1 600、1∶3 200、1∶6 400、1∶12 800、1∶25 600、1∶51 200、1∶102 400、1∶204 800梯度稀释。按照上述试验步骤,最后得到数值计算分析P/N值,确定多克隆抗体效价。
1.7 多克隆抗体的Western Blot鉴定
用pGEX-6p-1空载质粒菌液作为对照,对鼠源多克隆抗体GST-p27蛋白进行SDS-PAGE凝胶电泳。转印到PVDF膜,加入封闭液37 ℃ 2 h,用一抗稀释液1∶500稀释鼠血清,以1∶5 000稀释HRP标记的山羊抗鼠IgG 为二抗,充分洗涤后,ECL避光显色。用pET-32a空质粒菌液作为对照,对兔源多克隆抗体His-p27蛋白进行SDS-PAGE凝胶电泳。转印到 PVDF 膜,加入封闭液37 ℃ 2 h,以1∶500稀释的兔血清为一抗,以加入1∶5 000稀释HRP 标记的山羊抗兔IgG 为二抗。充分洗涤后,用ECL避光显色。
1.8 POCT试纸条的制备
按照 Protein A/G说明书对兔源多克隆抗体与鼠源进行纯化,确定用鼠源多克隆抗体偶联荧光微球,取500 μL的初洗缓冲液对荧光微球进行初洗、活化后,取沉淀加入含鼠源多克隆抗体偶联缓冲液混匀,进行偶联,超声重悬2 min,恒温摇床2 h,1 h超声重悬1次。偶联结束后取沉淀依次加入微球封闭液和微球稀释液超声重悬2 min,即为荧光微球包被的鼠源多克隆抗体,4 ℃避光保存。利用三维喷点平台将稀释好的鼠源多克隆抗体标记微球溶液喷涂到5 mm的玻璃纤维膜上,37 ℃烘箱过夜。将纯化后的兔源多克隆抗体IgG、山羊抗兔用抗体稀释液分别稀释,用划膜仪将稀释好的兔源多克隆抗体和的山羊抗兔划到NC膜上,作为T线和C线,再进行试纸条的组装。
1.9 POCT试纸的初步应用
用待测样品滴加至不同pH值的试纸上,确定多克隆抗体包被的最适pH值。收集的不同禽白血病的阳性样本、禽腺病毒的血清、组织稀释液PBS,分4组检测。向样品孔加入80 μL待检样品,每隔30 s加另一个样本,15 min后,将试纸条插入荧光读数仪,在电脑上观察结果,对NC膜上T峰和C峰的面积进行汇总,计算T/C值。
2 结果与分析
2.1 重组质粒的构建与鉴定
2.1.1 32a-p27同源臂和6P-1-p27同源臂的扩增 带pET-32a同源臂特异性引物,扩增出pET-32a-p27基因片段,琼脂糖凝胶电泳鉴定,在730 bp附近出现明显条带,与预期目的条带大小一致(图1)。

M.DL2000 plus Marker;1,2.pET-32a-p27目的片段。M.DL2000 plus Marker;1,2.pET-32a-p27 target fragment.
带pGEX-6P-1同源臂特异性引物,扩增出pGEX-6P-1-p27基因片段PCR产物经琼脂糖凝胶电泳鉴定,在730 bp左右出现目的片段,与预期目的条带大小一致(图2)。
2.1.2 pET-32a-p27和pGEX-6P-1-p27重组质粒pGEX-6P-1-p27的筛选 重组质粒菌液经琼脂糖凝胶电泳鉴定,在720 bp附近出现明显条带,与预期目的条带大小一致,符合预期结果(图3)。
重组质粒pET-32-p27的菌液经琼脂糖凝胶电泳鉴定,在720 bp附近出现明显条带,与预期目的条带大小一致(图4)。
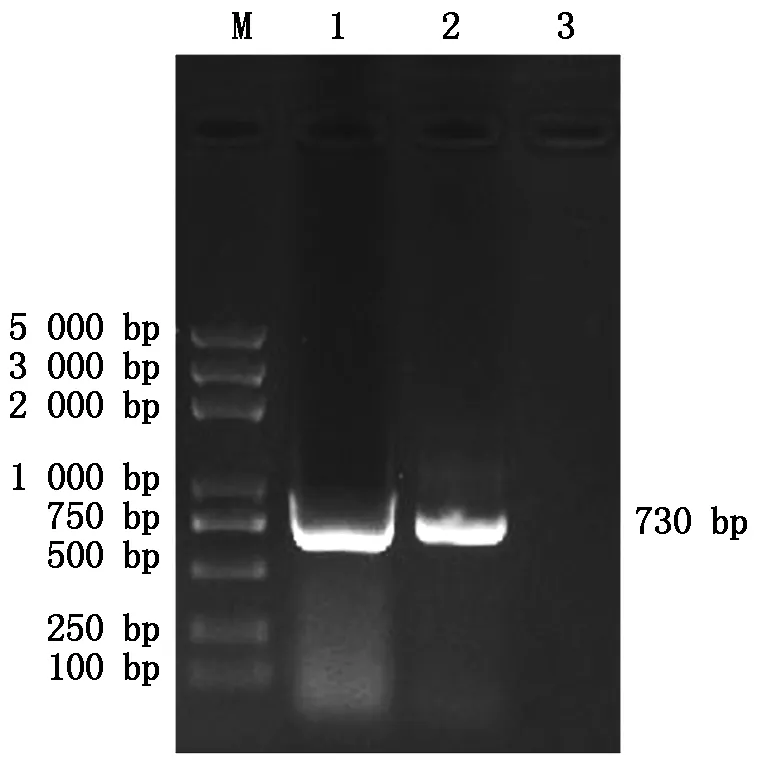
M.DL2000 plus Marker;1,2.pGEX-6P-1-p27目的片段。M.DL2000 plus Marker;1,2.pGEX-6P-1-p27 target fragment.

M.DL2000 plus Marker;1—3.pGEX-6P-1-p27重组质粒。M.DL2000 plus Marker;1—3.pGEX-6P-1-p27 DNA recombinant plasmid.

M.DL2000 plus Marker;1—3.pET-32a-p27重组质粒。M.DL2000 plus Marker;1—3.pET-32a-p27 DNA recombinant plasmid.
2.2 重组质粒原核表达产物分析
2.2.1 His-p27和GST-p27融合蛋白的诱导表达 如图5所示,当诱导温度16 ℃,IPTG 0.5 mmol/L,经10%的SDS-PAGE电泳显示,His-p27融合蛋白表达产物主要以可溶性上清的形式存在。
10%的SDS-PAGE电泳表明,诱导温度在28 ℃,IPTG为0.5 mmol/L时,可溶性目的蛋白的表达含量较高(图6)。
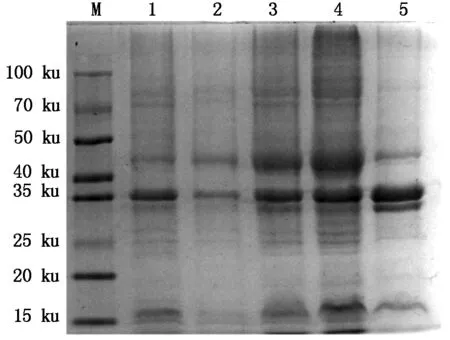
M.蛋白分子量标准;1.pET-32a空质粒;2.His-p27未诱导;3—5.His-p27全菌蛋白、上清和沉淀。
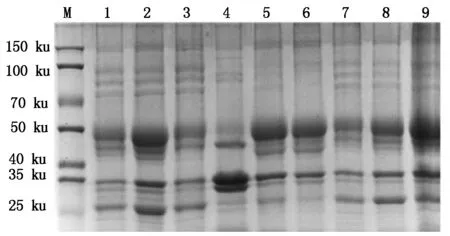
M.蛋白分子量标准;1—3.0.5 mmol/L IPTG,诱导温度分别为16,28,37 ℃的上清蛋白;4—6.0.5 mmol/L IPTG,诱导温度分别为16,28,37 ℃的包涵体;7—9.0.5 mmol/L IPTG,诱导温度分别为16,28,37 ℃的全菌蛋白。
2.2.2 His-p27和GST-p27融合蛋白的纯化 当温度
为16 ℃,IPTG 浓度为0.5 mmol/L,His-p27融合蛋白纯化的条带清晰且无杂带,达到预期效果(图7)。

M.蛋白分子量标准;1.上清;2—3.流穿液;4—9.洗脱蛋白。图8同。M.Protein Marker weight standard;1.Supernatant;2—3.Protein flow-through fluid;4—9.Eluted protein.The same as Fig.8.
对GST-p27融合蛋白进行纯化,12.5%的SDS-PAGE电泳分析纯化效果,如图8所示,在28 ℃,IPTG 0.5 mmol/L,目的条带明显且无杂带,洗脱结果良好。

4—8.洗脱蛋白。4—8.Eluted protein.
2.3 多克隆抗体的鉴定
2.3.1 鼠源多克隆抗体血清效价的测定 用间接ELISA方法检测最后一次免疫后小鼠的血清,结果显示(表1),抗原最佳稀释度为1∶1 600;在该抗原稀释浓度下测定鼠源多克隆抗体血清效价,结果(表2)显示,当血清稀释比例为1∶819 200时P/N为5.81>2,1∶1 638 400时P/N为1.10<2,所以鼠源多克隆抗体血清效价为1∶819 200。试验证明,制备鼠源多克隆抗体的免疫原活性良好,可刺激小鼠产生免疫反应,可用于后续试验。

表1 鼠源抗原稀释度Tab.1 Mouse-derived antigen dilution
2.3.2 兔源多克隆抗体血清效价的测定 兔血清进行间接ELISA试验,结果显示(表3),抗原最佳稀释度为1∶1 600;在该抗原稀释浓度下测定兔源多克隆抗体血清效价,结果显示(表4),当血清稀释比例为1:409 600时P/N为4.33>2,1∶819 200时P/N为1.95<2,所以兔源多克隆抗体血清效价为1∶409 600。试验证明,制备兔源多克隆抗体的免疫原活性良好,可刺激兔产生免疫反应,从兔血清分离出良好的多抗用于后续试验。

表2 鼠源多克隆抗体血清效价Tab.2 Mouse-derived polyclonal antibody serum titer

表3 兔源抗原稀释度Tab.3 Rabbit-derived antigen dilution

表4 兔源多克隆抗体血清效价Tab.4 Rabbit-derived polyclonal antibody serum titer
2.3.3 鼠源多克隆抗体Western Blot鉴定 如图9所示,鼠源多克隆抗体与GST-p27融合蛋白在52 ku结合良好,表明鼠源多克隆抗体的反应性和特异性良好。

1.pGEX-6P-1;2.GST-p27蛋白。1.pGEX-6P-1;2.GST-p27 protein.
2.3.4 兔源多克隆抗体Western Blot鉴定 如图10所示,兔源多克隆抗体与His-p27融合蛋白在44 ku结合良好,表明兔源多克隆抗体的反应性和特异性良好。

1.pET-32a;2.His-p27蛋白。1.pET-32a;2.His-p27 protein.
2.4 禽白血病病毒POCT检测方法的建立
2.4.1 鼠源多克隆抗体-微球包被条件的确定 荧光免疫分析仪测定仪测定结果读数如表5所示,微球偶联鼠源多克隆抗体的最适pH值为6.2。
2.4.2 POCT试纸条的临床检验及其图谱分析 将收集来的不同样本用试纸条进行检测,荧光免疫分析仪分析结果,将电脑显示的T、C面积数据进行整理。图11中T峰为直线,该检测样本与T线上的兔源多克隆抗体无免疫反应,该样本为阴性;图12中T峰有明显的起峰,证明样本中与T线上兔源多克隆抗体反应,该样本为阳性;图13中 T峰有微弱的起峰,证明样本中与T线上兔源多克隆抗体反应,但是样本中抗原含量不高。
2.4.3 POCT试纸条临床检测数据分析 表6显示,该POCT试纸条的特异性良好,禽白血的阳性样品与荧光微球包被的鼠源多克隆抗体结合良好,其T/C数据比其他样本高,而其他样本与微球上的鼠源多克隆抗体不结合,无T峰,T/C趋近于0。稳定性良好,重复4组,每组数据差异不大。

表5 POCT试纸条读数结果Tab.5 POCT test paper reading results
2.4.4 POCT试纸条临床检验 图14-A是试纸条的内部结构;图14-B是组装完毕的试纸条。取病禽组织样本滴入样品孔中,静置 15 min后,用紫外聚光灯照射试纸条,可见荧光条带,图14-C表明,无论滴入的样本是否和荧光微球包被的鼠源多克隆抗体结合,C线(质控线)在紫外灯的照射下均有荧光条带;仅有阳性样本和荧光微球包被的鼠源多克隆抗体结合后,在紫外灯的照射下,C线(质控线)和T线(检测线)才均会有荧光条带。
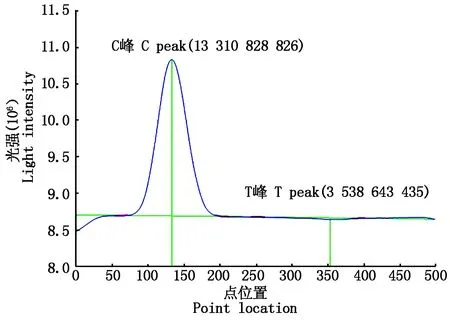
图11 阴性结果Fig.11 Negative result

图12 阳性结果Fig.12 Positive result

图13 弱阳性结果Fig.13 Weak positive
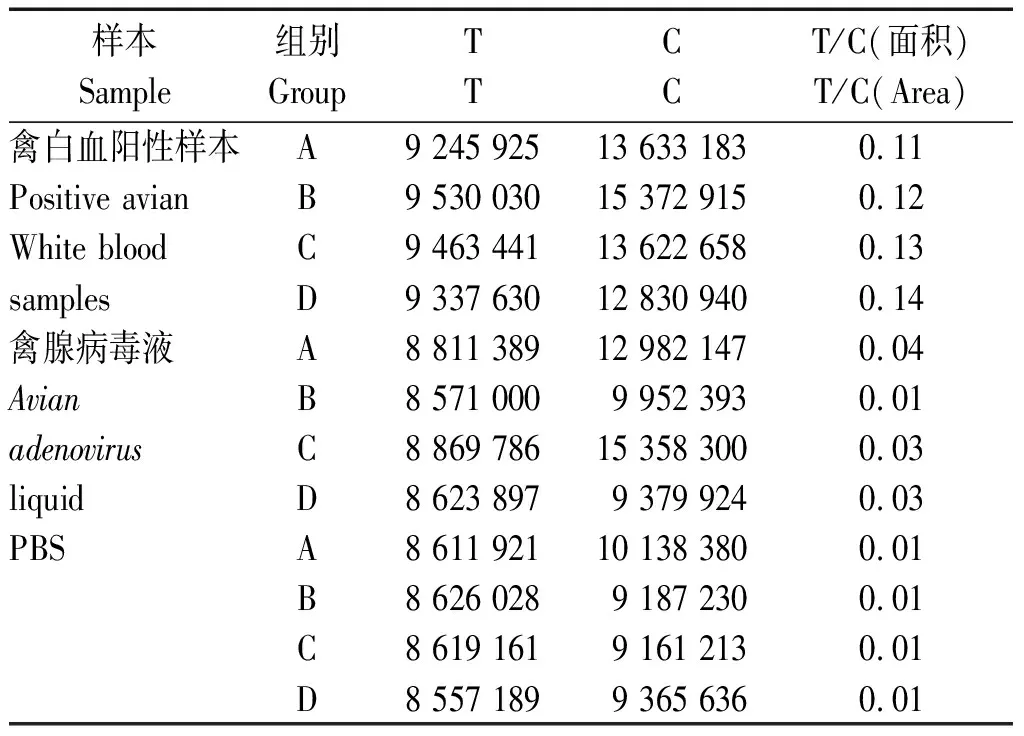
表6 POCT试纸条读数结果Tab.6 POCT test paper reading results
3 结论与讨论
禽白血病是肿瘤性疾病,其主要导致髓细胞瘤病和生理血管瘤。自1988年,ALV-J首次从患有髓样白血病的肉型鸡中分离出来,这种新型的ALV迅速在世界各地传播。因为尚无针对ALV的有效药物和疫苗,因此,目前的预防主要取决于检测和淘汰,建立无外源ALV的家禽群。目前,针对ALV-p27抗原建立的ELISA试剂盒价格昂贵,不适合大规模检验,所以建立一种新型快速便捷的检测方法至关重要。POCT是在医学实践中使用便携式分析仪和快速诊断工具进行的实时检查,是当前在临床实验室检验市场中发展最快的新型检测方法。

A.试纸条组装;B.试纸条成品;C.加入样本后紫外灯照射下试纸条结果。A.Test strip assembly;B.Test strip finished product;C.Add sample after ultraviolet lamp irradiation test strip result.
本研究成功扩增出ALV-p27的目的片段,克隆至pET-32a和pGEX-6P-1质粒,构建2个重组质粒,转化到大肠杆菌BL21感受态细胞中表达目的蛋白。重组蛋白的表达量与温度、时间、IPTG的浓度以及转速都有关,本试验通过摸索不同的表达条件,最终使得2种融合蛋白均在上清中得到了良好的表达。将纯化后的His-p27融合蛋白与佐剂等容量混合后作为免疫原免疫BALB/c小鼠,制备鼠源多克隆抗体,并用GST-p27蛋白交叉检测小鼠的血清效价以及进行Western Blot检测。同理,将纯化后的GST-p27蛋白作为免疫原免疫新西兰白兔,制备兔源多克隆抗体,并用His-p27蛋白交叉检测新西兰白兔的血清效价以及进行Western Blot检测,以此避免标签蛋白的表达造成的假阳性结果。选择制备2个不同的多抗来代替单克隆抗体进行POCT试纸条的组装,是由于与制备单克隆抗体相比,制备多克隆抗体所花的时间和成本更少,且多克隆抗体的“多”克隆性允许结合靶标的多个抗原决定簇,这使得多克隆抗体在某些测定中对多种靶蛋白、细胞或生物体更加敏感[21]。
本试验选择鼠源多克隆抗体和荧光微球偶联喷涂到结合垫,兔源多克隆抗体IgG作为检测线包被到NC膜上;其次,要选择合适pH值的包被稀释液包被鼠源多克隆抗体,使荧光微球更容易和鼠源多克隆抗体结合,提高包被的成功率;兔源多克隆抗体作为检测线(T线),要摸索最佳的划线浓度,浓度太低,导致荧光微球-鼠源多克隆抗体-抗原无法与兔源多克隆抗体结合,紫外灯下产生假阴性效果;最后,羊抗鼠IgG作为测试线(C线),是评判试纸条质量的好坏重要标准,所以确定最佳划线浓度尤为重要。浓度太低,无法显色,直接判断试纸条无法使用;浓度太高,导致大部分荧光微球-鼠源多克隆抗体和羊抗鼠IgG结合,只有小部分荧光微球-鼠源多克隆抗体和兔源多克隆抗体结合,在紫外灯下,T线亮度很低,C线过亮,电脑结果显示,与T/C面积比值小,造成弱阳性甚至假阴性结果。肉眼观察,无论滴入的样本是否和荧光微球包被的鼠源多克隆抗体结合,C线在紫外灯的照射下均发出荧光;仅有阳性样本和荧光微球包被的鼠源多克隆抗体结合后,在紫外灯的照射下,C线和T线才均会发出荧光;若C线未发出荧光,而T线发出荧光,表明试纸条损坏,检测结果不具有说服力。
本研究基于多抗包被在试纸条,组织研磨液作为待检样本,灵敏度和特异性有待提高,而且作为现场检测的便携式仪器,可以将多抗转换成单抗或者提高包被浓度和划线浓度以提高检测的灵敏度和特异性。
