脑卒中后肢体痉挛的识别与评估:Scoping综述
2022-02-15陈莉琳黄牡丹郑海清
陈莉琳,黄牡丹,郑海清
中山大学附属第三医院康复医学科,广东广州市 510630
0 引言
《中国脑卒中防治报告2019》显示,我国脑卒中现患人数约有1 318 万人,每年新发脑卒中发病率约345/10 万[1],脑卒中后肢体痉挛的发生率约为40%[2]。痉挛是一种上运动神经元损伤综合征,以速度依赖的牵张反射增强及腱反射亢进为特征。痉挛表现为外加牵伸引起的肌肉阻力升高,具有牵伸速度和肌肉长度依赖性[3]。严重的肢体痉挛阻碍患者肢体功能恢复,影响患者日常生活活动能力以及社会参与能力,降低患者生活质量,增加照护者负担。对脑卒中后肢体痉挛的精准评估,对痉挛的早期干预及临床管理具有重要意义。研究者对痉挛发生的病理生理机制的认识不断深化,但临床上仍缺乏对脑卒中后肢体痉挛客观、有效的评价指标。本研究对脑卒中后肢体痉挛的识别与评估方法和指标进行综述。
1 资料与方法
1.1 一般资料
在中国知网、万方数据库、Web of Science 和PubMed 进行文献检索。检索时间自建库至2021 年5月15日。
中文检索式:痉挛AND 卒中AND(评估OR 识别)AND(F 波OR H 反射OR 交互抑制OR 运动诱发电位OR 前庭诱发肌源性电位OR 肌电图OR 牵张反射阈值)。
英文检索式:(spasticity OR spastic)AND stroke AND(assessment OR identification)AND(F wave OR H reflex OR reciprocal inhibition OR motor evoked potentials OR vestibular evoked myogenic potentials OR electromyography OR stretch reflex threshold)。
1.2 纳入和排除标准
纳入标准:①涉及脑卒中后肢体痉挛;②讨论脑卒中后肢体痉挛的评估手段;③涵盖与脑卒中后肢体痉挛相关的电生理指标。
排除标准:无摘要或不能获取原文。
1.3 文献筛选
由熟悉脑卒中后肢体痉挛康复及相关的评估手段的研究人员进行文献筛选与分析,流程见图1。
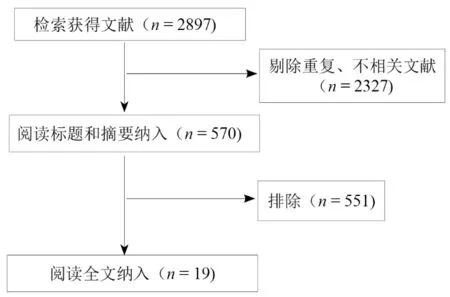
图1 文献筛选流程
2 结果
共纳入文献19篇,主要来自美国和加拿大,涉及指标包括改良Ashworth 量表(modified Ashworth Scale,MAS)、综合痉 挛量表(Composite Spasticity Scale,CSS)、改 良Tardieu 量 表(modified Tardieu Scale,MTS)、F 波、H 反射、运动诱发电位(motion-evoked potential,MEP)、惊跳反射响应时间、前庭诱发肌源性电位(vestibular-evoked myogenic potentials,VEMP)、张力性牵张反射阈值(tonic stretch reflex threshold,TSRT)和肌电信号相关指标等。
2.1 量表
2.1.1 MAS
MAS 易于操作,是临床最常用的痉挛评定量表,着重描述肢体关节被动活动时测试者所感受到的阻力。痉挛为速度依赖的腱反射亢进,临床医师对患者肢体进行牵拉评估的速度没有统一标准,且患者间肌肉特性、关节活动度存在差异。MAS不能有效区分肌张力中的神经成分和非神经成分,且不能体现“速度依赖性腱反射亢进”这一痉挛特征。
2.1.2 CSS
CSS 可用于对患者肢体腱反射、肌张力和阵挛的评估,在评价下肢痉挛中信度较高[4]。CSS 主要用于脑损伤患者,评价过程繁琐,同样无法控制测试者的主观影响。
2.1.3 MTS
MTS 在Ⅴ1(尽可能慢)、Ⅴ2(肢体抗重力下落的速度)、Ⅴ3(尽可能快,快于肢体自由落体的速度)3种速度条件下测量痉挛,考虑了痉挛中速度依赖成分,可能较MAS 更具有优势[5],但是也有文献报道MTS 的信度低[6],与无法将评估速度归一化处理有关;且患者肌肉挛缩程度不同,衡量痉挛程度的关节角度存在较大的个体异质性。病例对照研究结果显示,基于惯性传感器的MTS能显著提高MTS的信度和准确率[7]。
2.2 电生理技术
电生理技术通过识别肌肉表面的电信号,采集电位振幅、兴奋传导速度和运动单位募集数量等肌电信号,获取肌肉的激活水平、激活模式、疲劳程度和协同模式等信息,具有可重复性强、相对稳定等特点,是识别和评估痉挛的客观手段。此外,电生理技术还可用于对鉴别挛缩和神经源性肌张力增高,如当被动运动患侧肢体时,患肢关节阻力增高而肌电图电位与静息电位相似,表明处于挛缩状态[8]。
2.2.1 F波、H反射
运动神经元兴奋性的改变是痉挛的重要成因,F波和H反射都是反映运动神经兴奋性的肌电指标[9]。
F 波是运动神经纤维逆行冲动,使对应的前角运动神经元兴奋,直接或间接兴奋其他运动神经元,冲动沿传出纤维下行,到达相应肌肉所产生的回返放电。F波指标Fmax/Mmax与痉挛程度相关[10],常用于反映痉挛患者脊髓运动神经元的兴奋性[11]。但Udby Blicher 等[12]发现,非痉挛的脑卒中患者相较于健康对照组同样表现为F 波出现率增高,非痉挛患者与痉挛患者的F 波出现率无显著性差异。Leng 等[13]发现,痉挛患者MAS 评分降低,并不伴随脊髓兴奋性的变化。F波作为反映脊髓节段兴奋性的指标,有助于明确肌肉张力变化的病理生理机制,鉴别非神经成分在痉挛中的作用。
H 反射是脊髓水平最简单的单突触反射之一,是牵张反射的电模拟,由电刺激传入神经纤维引出。H反射潜伏期、H 反射阈值、H 反射阈值/M 波阈值、H反射募集曲线斜率(Hslp)、H 反射斜率/M 波斜率(Hslp/Mslp)、H反射振幅最大值/M 波振幅最大值(Hmax/Mmax)已被证实与痉挛的发生有一定相关性,其中Hmax/Mmax和Hslp/Mslp与MAS 评分和Brunnstrom 分期线性相关。Hmax/Mmax和Hslp/Mslp均表示激活的运动神经元占脊髓神经元池的百分比,是兴奋的α 运动神经元频率和数量的指标[14]。一项前瞻性队列研究报道[15],患者MAS 评分改善,H反射指标不表现任何改变。
Day 等[16]首次提出使用交互抑制(reciprocal inhibition,RI)评价肌张力。RI反映在不同的条件刺激下,非条件刺激下H 反射振幅和条件刺激下H 反射振幅的差异。RI由Ia类神经纤维、闰绍细胞、突触前抑制中间神经元等所介导,皮质脊髓通路对Ia 类抑制中间神经元有优先传导输入,网状脊髓束(reticulospinal tract,RST)则对功能为突触前抑制的中间神经元有优先传导输入;RI的异常反映上述传导通路对脊髓兴奋性的异常调节程度[17]。RI降低引起牵张反射增强[18],是痉挛发生的机制之一[19]。Fujiwara 等[20]发现,条件刺激后100 ms的RI,即RI-3与腕痉挛程度相关,与运动前区通过RST对脊髓节段的长环路抑制有关。
F 波和H 反射可作为反映牵张反射亢进和脊髓兴奋性增高等痉挛特征的肌电指标,用于识别脑卒中后肢体痉挛神经成分的识别。若脊髓兴奋性改变不伴随临床痉挛评估量表的改变,则可以使用改善肌肉黏性和弹性成分的干预手段;反之,则使用调节神经兴奋性的手段干预。
2.2.2 MEP和VEMP
神经系统下行通路中,RST、前庭脊髓束和皮质脊髓束调节脊髓节段兴奋性,下行纤维束的调节失衡与脑卒中后肢体痉挛密切相关[21]。经颅磁刺激(transcranial magnetic stimulation,TMS)刺激皮 质诱发MEP,代表皮质脊髓束的功能状态。Sangari 等[22]发现,MEP的振幅与痉挛程度相关。Piscitelli等[23]发现,皮质脊髓束对TSRT 的调节障碍导致脑卒中患者主动肌与拮抗肌异常共激活,可能是痉挛的起因;痉挛患者和健康对照者在屈肘和伸肘姿势下,肱二头肌MEPs振幅的增量与痉挛程度呈负相关,与TSRT增量强相关。提示皮质脊髓束对脑卒中后肢体痉挛的作用与TSRT的调节有关。
脑卒中后,病灶侧脑桥RST 和前庭脊髓束失抑制,可易化脊髓前角运动神经元;非病灶侧的前运动皮质通过代偿性激活病灶侧RST 参与痉挛发生[24]。声刺激相关的脑干反射通过RST影响肌肉的反应时间和MEP 振幅,如听觉惊跳刺激试验[25]。Choudhury 等[26]发现,痉挛程度高的脑卒中患者惊跳反射效应强。研究者认为,皮质脊髓束损伤严重的患者功能恢复依赖RST,RST 兴奋性增高加强惊跳反射效应;惊跳反射效应与痉挛程度呈正相关,可能成为量化痉挛的一种有效指标。
Miller 等[27]利用VEMPs 不对称比、抗重力痉挛指数以及健侧与患侧的VEMP 峰间振幅比判断前庭脊髓束与痉挛程度的关系,结果表明VEMP 不对称程度与痉挛严重程度强相关。推测前庭对运动神经元池的驱动不平衡与皮质延髓束投射至前庭神经核的抑制性纤维束单侧破坏相关,导致痉挛发生。
Chen 等[28]联合听觉惊跳刺激试验和TMS 诱发MEP探究脑干RST与皮质脊髓束之间的关系,发现惊跳反射抑制脑卒中患者健侧MEP。明确RST在痉挛中的作用以及RST与皮质脊髓束之间的相互作用,对于识别痉挛、阐明痉挛机制和促进患者功能的恢复具有重要的意义。
2.2.3 表面肌电图
Rasool 等[29]通过多通道表面肌电图采集多位点肱二头肌肌电均方根值,获取区域激活变异度、激活肌图弥散度和不协调激活特征,描述肌纤维类型的不均衡分布、胶原纤维的沿伸以及神经支配区的改变,表明异常的肌肉激活模式与痉挛相关。Misgeld等[30]则通过采集平地步行时胫骨前肌和腓肠肌的肌电信号,计算指数ⅠCA描述拮抗肌和主动肌的协同运动模式,评价痉挛程度,证实ⅠCA与MAS 评分线性相关。Ellis 等[31]捕捉动作启动过程3个时间窗(抬手阶段、动作始发阶段、H反射时间窗)的肌电指标分别代表协同运动的激活、持续过程和痉挛的激活,发现协同运动是影响痉挛患者伸手够物功能的主要原因,非病灶侧运动皮质代偿性激活患侧RST 可能是屈肌协同运动导致痉挛的机制[24]。Yu 等[32]采用表面肌电指标构建神经网络模型sEMG-ANFIS 评估痉挛,与TSRT 相比,sEMG-ANFIS和MAS拟合度更高,决定系数高达0.97。
2.2.4 TSRT
牵张反射阈值(stretch reflex threshold,SRT)是指肢体以不同速度移动时,肌肉开始响应时的关节角度。动态牵张反射阈值(dynamic stretch reflex threshold,DSRT)是以角度为横轴、速度为竖轴、呈回归线分布的散点图,测量不同速度下牵张反射的阈值;其中零速度下的角度值即为TSRT[33]。TSRT 与痉挛和随意运动障碍均相关[34],且具有评估者间信度高的特点[35]。
Turpin等[36]发现,主动和被动运动下TSRT的变化与CSS 负相关,临床损伤越重,SRT 调节能力越差,痉挛程度越大,这为痉挛肢体运动控制紊乱的机制提供了依据。Levin 等[37]探究痉挛肢体肘关节被动伸展时,伸肌TSRT 与运动障碍之间的关系,结果表明脑卒中后拮抗肌和主动肌的过度共同激活及交互抑制障碍可能与两组肌肉TSRT 调节障碍有关。Afzal 等[34]证实,TSRT 调节紊乱同时出现在脑卒中患者的痉挛侧和非痉挛侧,其中痉挛侧TSRT 调节紊乱最明显,可能与患侧RST和前庭脊髓束对脊髓运动神经元调节障碍有关。
综上所述,TSRT 不仅可以反映痉挛肢体被动活动时牵张反射的兴奋性、主动活动时拮抗肌与协同肌共激活对自主运动造成的影响,还可以识别痉挛,并对痉挛与强直进行鉴别诊断,是测量痉挛状态敏感性和特异性较高的指标。
纳入文献见表1。
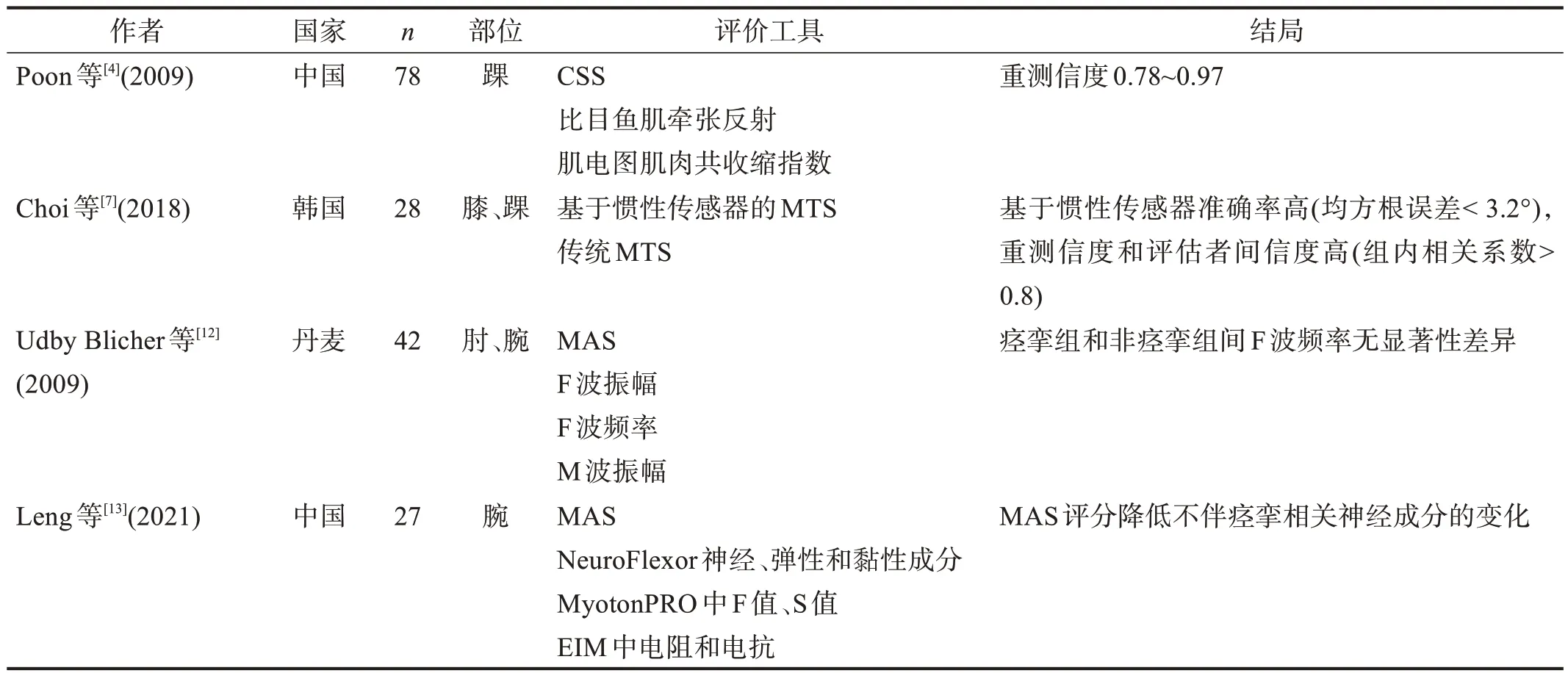
表1 纳入文献的一般资料
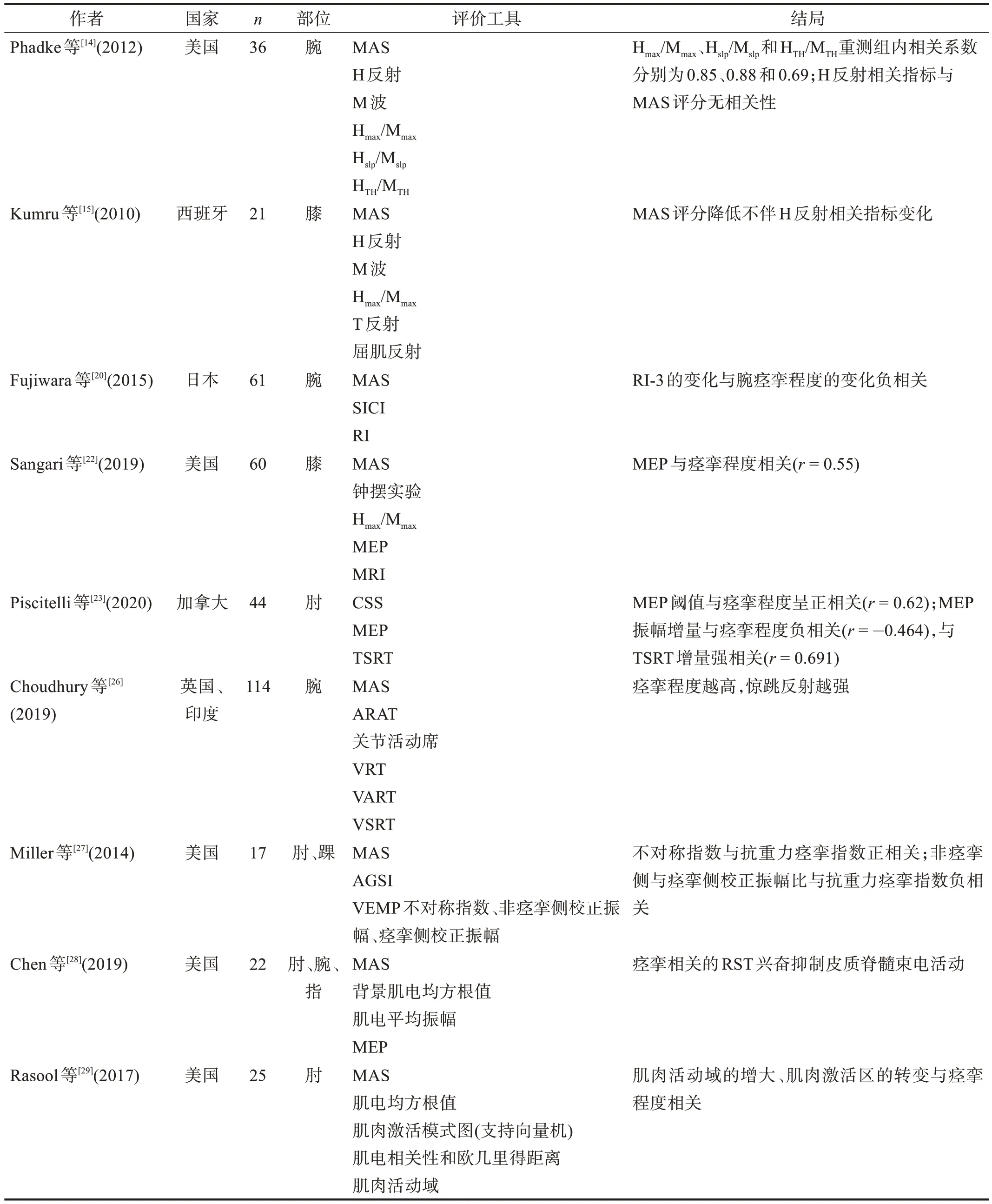
续表
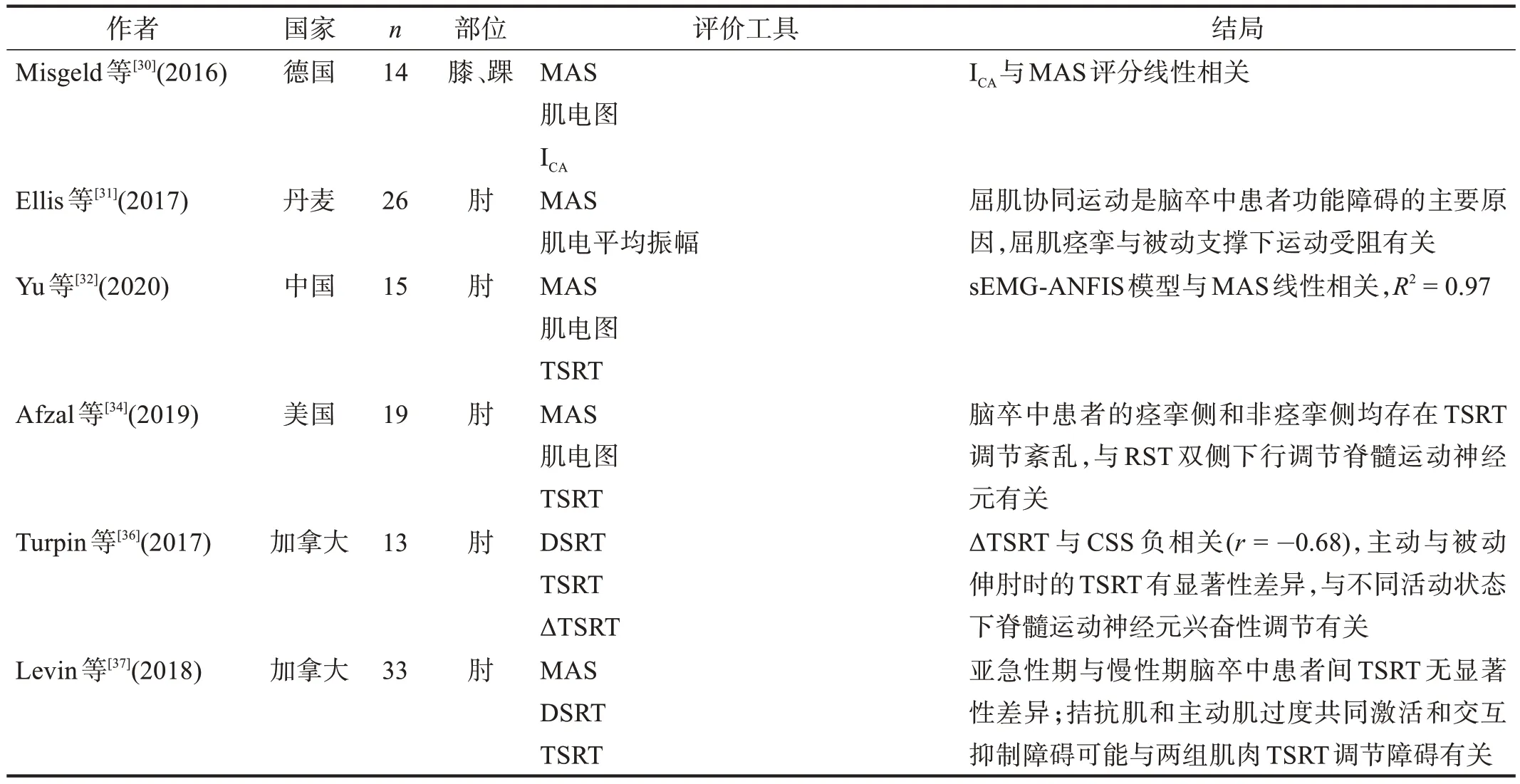
续表
3 小结
痉挛是影响脑卒中患者生活质量的重要影响因素。目前对脑卒中后肢体痉挛的研究存在以下问题:①如何利用电生理指标阐明痉挛发生发展的病理生理机制;②如何利用电生理指标和量表早期预测痉挛的发生和痉挛程度;③如何联合利用多种检测手段对痉挛进行更加全面、客观的评估等。
利益冲突声明:所有作者声明不存在利益冲突。
