转化生长因子β对肝纤维化大鼠肝部分切除术后肝功能及肝脏再生的作用及机制
2022-02-15凌林胡明华陈圣林王静董娟
凌林,胡明华,陈圣林,王静,董娟
(1.华东师范大学附属芜湖医院/安徽省芜湖市第二人民医院肝胆外科,安徽芜湖241000;2.皖南医学院生理学教研室,安徽芜湖241000;3.皖南医学院机能学实验实训中心,安徽芜湖241000)
肝是人体物质代谢的中心器官,既往研究表明,具有强大的再生能力,增强肝的再生能力对肝疾病患者具有重要意义。在多达70%的肝组织切除后,肝残余组织会迅速再生至其原始大小[1]。肝再生对肝功能的维持功能至关重要,然而目前对肝再生机制的了解不足,在一些肝纤维化患者中,在肝切除后会出现肝脏再生不足或未再生[2]。Ki-67 是细胞增殖过程中必不可少的蛋白,其水平升高提示肝细胞增殖能力的升高,可反映肝再生水平[3]。最新研究[4]显示干细胞具有更强的增殖和分化潜能,并且能够分化成肝细胞或者胆管上皮细胞。LGR5 基因是干细胞标志蛋白,也是干细胞分化成肝细胞的重要调控蛋白[5]。转化生长因子β(transforming growth factor-β,TGF-β) 会激活Smad蛋白,从而调控细胞增殖和分化,并促进纤维化和伤口愈合[6]。有研究发现在肝再生过程中,TGFβ 通路的激活会促进肝组织的再生[7],但是也有研究显示TGF-β 通路不利于肝再生[8]。因此,本研究主要分析肝纤维化动物肝部分切除术后TGF-β 通路对肝功能及肝脏再生的作用和机制。
1 材料与方法
1.1 主要实验材料
SD 大鼠(SPF 级,雄性,6 周龄,210~230 g,北京维通利华动物公司,中国)。四氯化碳(CCl4)(Sigma 公司,美国)。TGF-β抑制剂GW788388(Selleck 公司,中国)。ELISA 试剂盒、HE 染色、Masson 染色试剂盒(碧云天公司,中国)。酶标仪(Model 680,Bio-Rad,美国)。RNAspin Mini (GE Healthcare,美国)。Bestar qPCR RT 和Bestar™qPCR试剂盒(DBI Bioscience 公司,德国)。一抗和山羊抗免疫球蛋白G 二抗(Abcam 公司,美国)。PDVF膜(EMD Millipore, 美 国)。 ECL 显色试剂盒(Thermo Fisher 公司,美国)。显微镜(Carl Zeiss 公司,德国)。
1.2 肝纤维化建模方法
根据参考文献[9]的方法构建大鼠肝纤维化模型。将CCl4溶解于橄榄油中,浓度为10%,腹腔注射,每次1 mL/kg,每周2 次,连续8 周。在行肝部分切除术时采集肝标本通过HE 染色和Masson 染色验证建模结果。
1.3 肝切除术与分组
将32 只肝纤维化模型大鼠进行肝切除手术。根据参考文献[8],大鼠麻醉后(戊巴比妥、腹膜内注射)剃毛消毒,打开腹腔结扎脾动脉,然后切去肝脏的70%,保留30%左右的右侧肝叶。常规缝合、抗感染处理。分别在行肝切除术后第1、3、5、7 天各取8 只大鼠进行观察指标的检测。另8 只大鼠仅打开腹腔暴露肝脏行假手术作为对照。
1.4 检测指标和方法
1.4.1 HE 染色检测肝组织损伤 大鼠经过断头处死,收集肝组织并放置进入多聚甲醛固定48 h。将固定好的组织样本利用不同浓度的乙醇进行脱水,然后加入二甲苯进行透明处理并包埋至石蜡中,使用切片机切成4 μm 厚的切片。切片水化后制成玻片标本,加入苏木精孵育5 min,然后加入0.5%的伊红染色5 min,洗涤后透化。固定,在显微镜下观察。
1.4.2 Masson 染色检测纤维化 将1.4.1 中的玻片标本加入Masson 三色染料进行染色,根据试剂盒说明书的方法操作,最后在显微镜下观察并拍照,利用图IPP 6.0 像分析系统计算胶原蛋白的体积分数。
1.4.3 ELISA 取大鼠尾静脉血,在300 r/min 的转速下离心15 min 收集上清液,分别加入抗体和显色剂,终止显色反应后15 min内检测吸光度(450 nm),然后根据标准曲线计算AST 和ALT 的浓度。
1.4.4 qRT-PCR 使用RNeasy Mini 试剂盒取肝组织中的总RNA,然后使用Bestar qPCR RT 试剂盒将其逆转转录为cDNA,条件如下:37 ℃/15 min;98 ℃/5 min。然后使用Bestar ™qPCR 预混液进行qPCR 实验,条件如下:95 ℃/2 min,94 ℃/20 s,58 ℃20 s,72 ℃/20 s,40 个循环,最后在72 ℃下延伸4 min。使用Agilent Stratagene Mx3000P 序列检测系统进行qRT-PCR 分析。通过比较循环阈值并以GAPDH 作为内参计算mRNA 相对表达水平。
1.4.5 Western blot 将肝组织裂解后收集总蛋白。通过8%的SDS-PAGE 分离每个样品中等量(50 μg)的蛋白质,并将其转移到硝酸纤维素膜上。然后将5%脱脂牛奶完全浸没硝酸纤维素膜来封闭非特异性抗原(室温下2 h)随后,将膜与分别与一抗(1∶800 稀释)在4 ℃下孵育过夜,然后将山羊抗兔IgG 二抗按照1∶2 000 的比例稀释并在室温下孵育1 h 来进行反应。使用化学发光试剂显示,使用Quantum One 软件分析灰度计算蛋白相对于GAPDH的表达量。
1.5 动物实验分析TGF-β在肝再生中作用
将20 只大鼠根据1.2 的方法构建肝纤维化模型。建模后随机分为2 组:肝部分切除组和肝部分切除+TGF-β 抑制剂组。根据1.3 的方法,每只大鼠均切除肝脏的70%。肝部分切除+TGF-β 抑制剂组,在术前2 h 一次性腹膜内注射TGF-β 抑制剂GW788388来抑制TGF-β相关通路,剂量为10 mg/kg[10]。切除后根据HE 和Masson 染色分析肝纤维化建模结果,发现分别有9 只和8 只建模成功,因此分别选择8 只纳入后续检测。此外,选择8 只假手术大鼠作为对照组。在建模后第5 天,根据1.4 的方法检测各组大鼠肝功能指标、肝再生情况以及TGF-β/Smad 通路水平。
1.6 免疫组化染色
通过免疫组化染色检测新生肝组织中Ki-67 蛋白水平评估肝再生能力,检测LGR5 蛋白评估肝组织中干细胞水平。多聚甲醛(4%)固定后脱水、包埋、切片(4 μm)。加入3%过氧化氢溶液,室温静置20 min,然后加入1∶400 稀释的Ki-67 抗体在37 ℃孵育60 min;洗涤后加入100 μL 的山羊抗兔IgG 聚合物室温下孵育50 min;洗涤后加入DAB显色,然后加入苏木素染色液孵育20 s,冲洗后显微镜观察,利用Image-Pro Plus 6.0 软件随机选择5个视野中Ki-67 或者LGR5 阳性细胞数目。
1.7 统计学处理
统计分析使用SPSS 19.0 软件。数据以平均值±标准差(±s)表示。多组间比较进行单因素方差分析,两两比较使用SNK-q检验。P<0.05 为差异有统计学意义。
2 结 果
2.1 肝纤维化建模情况
正常大鼠组肝组织染色均匀,细胞核呈圆形,细胞排列有序,肝小叶结构清晰,胶原蛋白的体积分数为(0.92±0.08)%。纤维化模型成功后见后,可观察到肝细胞膨大,肝小叶结构遭到破坏,并出现严重的出血和炎性浸润。胶原蛋白的体积分数为(13.52±1.68)%(图1)。
2.2 肝纤维化大鼠肝部分切除后肝功能指标变化
术后第1 天,大鼠血清中丙氨酸氨基转移酶(ALT) 和天门冬氨酸氨基转移酶(AST) 水平明显高于假手术组(均P<0.05)。随着时间的推移,大鼠ALT 和AST 水平均随之降低(F=145.742,P=0.000;F=119.434,P=0.000)(表1)。
表1 肝纤维化模型大鼠肝部分切除后ALT和AST变化情况(n=8,± s)Table 1 Changes of ALT and AST in rats with liver fibrosis after partial hepatectomy(n=8,± s)

表1 肝纤维化模型大鼠肝部分切除后ALT和AST变化情况(n=8,± s)Table 1 Changes of ALT and AST in rats with liver fibrosis after partial hepatectomy(n=8,± s)
注:1)与假手术组比较,P<0.05;2)肝部分切除术后1 d 组比较,P<0.05Note:1)P<0.05 vs.sham operation group;2)P<0.05 vs.post-hepatectomy 1 d group
组别假手术组ALT(U/L)32.85±4.19 AST(U/L)97.53±8.26部分肝切除组术后1 d术后3 d术后5 d术后7 d 149.64±16.341)128.87±13.551),2)93.21±9.211),2)71.37±8.061),2)271.34±24.681)234.19±20.511),2)190.31±20.571),2)172.75±18.291),2)
2.3 肝纤维化大鼠肝部分切除后肝组织中TGF-β和Smad mRNA变化
在行肝部分切除后,TGF-β 和Smad mRNA 的水平显著升高,在第3 天达到峰值(P<0.05),而后降低,在第7 天降低至对照组水平(均P>0.05)(表2)。
表2 肝纤维化模型大鼠肝部分切除后肝组织中TGF-β 和Smad mRNA变化(n=8,± s)Table 2 Changes inTGF-β and Smad mRNA in liver tissues of rats with liver fibrosis after partial hepatectomy(n=8,± s)
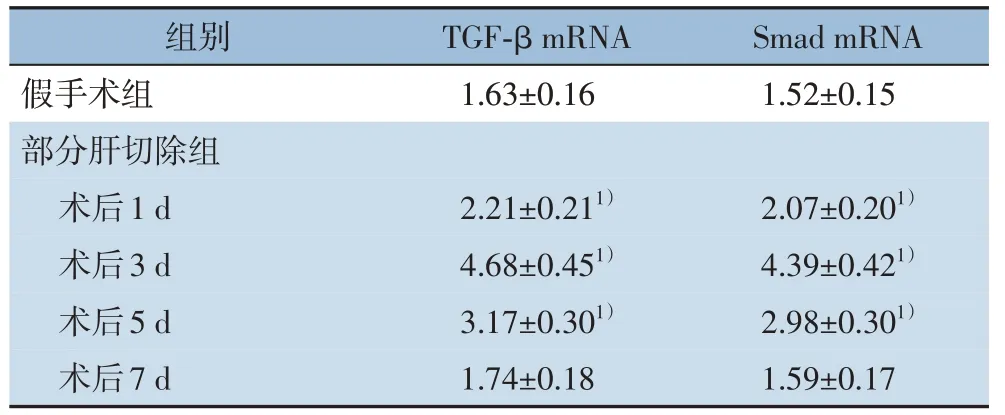
表2 肝纤维化模型大鼠肝部分切除后肝组织中TGF-β 和Smad mRNA变化(n=8,± s)Table 2 Changes inTGF-β and Smad mRNA in liver tissues of rats with liver fibrosis after partial hepatectomy(n=8,± s)
注:1)与假手术组比较,P<0.05Note:1)P<0.05 vs.sham operation group
?
2.4 肝纤维化模型大鼠肝部分切除后肝组织中TGF-β/Smad通路中蛋白表达的变化
在行肝部分切除后,TGF-β 和Smad 蛋白的水均明显升高,在第3 天达到峰值(P<0.05),而后降低,在第7 天降低至对照组水平(均P>0.05)(图2)(表3)。
表3 肝纤维化模型大鼠肝部分切除后肝组织中TGF-β 和Smad蛋白的变化(n=8,± s)Table 3 Changes in TGF-β and Smad proteins in liver tissues of rats with liver fibrosis after partial hepatectomy(n=8,± s)
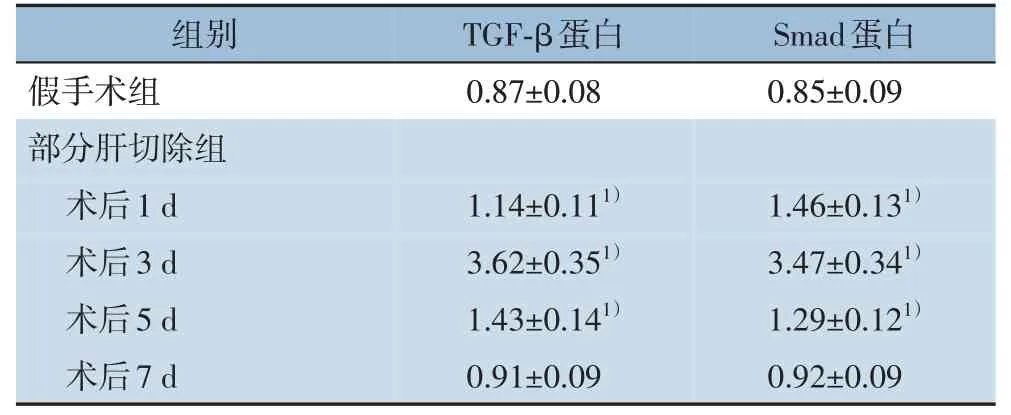
表3 肝纤维化模型大鼠肝部分切除后肝组织中TGF-β 和Smad蛋白的变化(n=8,± s)Table 3 Changes in TGF-β and Smad proteins in liver tissues of rats with liver fibrosis after partial hepatectomy(n=8,± s)
注:1)与假手术组比较,P<0.05Note:1)P<0.05 vs.sham operation group
组别假手术组TGF-β蛋白0.87±0.08 Smad蛋白0.85±0.09部分肝切除组术后1 d术后3 d术后5 d术后7 d 1.14±0.111)3.62±0.351)1.43±0.141)0.91±0.09 1.46±0.131)3.47±0.341)1.29±0.121)0.92±0.09
2.5 肝部分切除术通过TGF-β/Smad通路对肝纤维化大鼠肝功能的影响
3 组大鼠间的肝功能指标差异有统计学意义(P<0.05)。肝部分切除组的ALT 和AST 水平明显高于假手术组,肝部分切除+TGF-β 抑制剂组的ALT和AST 水平明显高于假手术和肝部分切除组(均P<0.05)(表4)。
表4 肝纤维化大鼠肝部分切除术后肝功能与TGF-β/Smad通路的关系(n=8,± s)Table 4 The relationship between liver function and TGF-β/Smad pathway in rats with liver fibrosis partial hepatectomy(n=8,± s)

表4 肝纤维化大鼠肝部分切除术后肝功能与TGF-β/Smad通路的关系(n=8,± s)Table 4 The relationship between liver function and TGF-β/Smad pathway in rats with liver fibrosis partial hepatectomy(n=8,± s)
注:1)与假手术组比较,P<0.05;2)与肝部分切除组比较,P<0.05Note:1)P<0.05 vs.sham operation group;2)P<0.05 vs.partial hepatectomy group
AST(U/L)95.04±9.24 187.61±17.381)254.83±25.721),2)组别假手术组肝部分切除组肝部分切除+TGF-β抑制剂组ALT(U/L)32.19±3.95 91.35±9.381)130.64±12.581),2)
2.6 肝部分切除术通过TGF-β/Smad通路对肝纤维化大鼠肝再生能力及干细胞水平的影响
3 组大鼠新生肝组织中Ki-67 蛋白表达水平比较差异有统计学意义(P<0.05)。肝部分切除组 Ki-67 阳性细胞数目明显高于对照组[ (121.57±8.32) 个vs.(24.63±2.75) 个,P<0.05],肝部分切除+TGF-β 抑制剂组的Ki-67 阳性细胞数目显著低于肝部分切除组[(40.72±3.44)个vs.(121.57±8.32)个,P<0.05](图3A)。3 组大鼠新生肝组织中LGR5 蛋白表达水平比较差异有统计学意义(P<0.05)。肝部分切除组LGR5 阳性细胞数目明显高于对照组[(92.43±98.25)个vs.(16.94±1.69)个,P<0.05],肝部分切除+TGF-β 抑制剂组的LGR5 阳性细胞数目显著低于肝部分切除组[(35.87±3.60) 个vs.(92.43±98.25) 个,P<0.05](图3B)。
3 讨 论
肝脏疾病发病率正在逐年上升。病毒性感染,自身免疫性因素,以及多种的药物等都可引起肝脏不同程度的损伤。与其他器官不同,肝脏是机体唯一一个具有强大再生能力的器官[11-15]。有研究在80 多年前首次证实肝脏在行2/3 切除后可以增生至原体积大小,研究者在不同的啮齿类动物身上也发现了同样的现象[16-17]。肝纤维化是持续性和慢性肝损伤的结果,在肝纤维化过程中,肝细胞凋亡,内皮屏障受损,炎症细胞被募集,肝星状细胞被激活,从而导致细胞外基质的合成和降解失调,最终可能导致肝功能衰竭和肝癌[18-20]。肝切除是治疗肝癌的重要方法,但是对于合并肝纤维化的患者,会影响肝脏愈合和再生,研究肝组织再生的机制具有重要的临床意义。
肝部分切除后会激活肝组织的再生能力,在此过程中,TGF-β/Smad 通路起到重要作用[21]。TGF-β 家族信号通路在细胞不同的阶段起着重要的调节作用[22]。包括细胞的增殖、分化、迁移和凋亡过程并且从而达到人体组织器官的稳态。由于TGF-β 功能多样性和多效性,其通路的放松管制有助于人类疾病的发生[23-24]。在肝脏中,TGF-β 信号参与疾病进展的所有阶段,从最初的肝损伤到炎症和纤维化,到肝硬化和癌症。TGF-β 对肝细胞具有细胞抑制和凋亡作用,在胚胎发生和生理性肝再生过程中促进肝分化[25]。TGF-β 过表达后或激活Smad 蛋白进入细胞核,从而促进细胞增殖相关基因的转录促进肝细胞增殖[26]。本研究通过腹腔内注射CCl4构建肝纤维化模型,并切除70%的肝组织,分别在术后第1、3、5、7 天检测肝功能,结果显示随着时间的延长,肝功能指标AST 和ALT 随之降低,提示肝功能逐渐恢复。但是在此过程中,TGF-β 和Smad mRNA 和蛋白水平先升高后降低,并且在建模第3 天达到峰值。TGF-β/Smad 通路不但具有促进细胞增殖的功能,还具有促进伤口愈合和调控纤维化的作用。研究显示机体的各种损伤均会激活TGF-β/Smad 通路,从而调控胶原蛋白、细胞外基质的生成,促进伤口愈合[27]。但是胶原蛋白的过度累积会影响细胞活力,影响细胞增殖甚至导致细胞凋亡[18]。本研究结果提示在肝部分切除术初期,TGF-β/Smad 的水平升高并参与肝组织愈合,从而促进肝功能的恢复。但是TGF-β/Smad 通路对肝再生的长期影响还需要进一步研究。
为进一步验证肝部分切除术初期TGF-β/Smad通路参与肝组织的早期修复保护肝功能,本研究利用GW788388 来抑制TGF-β 通路。结果显示肝部分切除术后,肝功能指标AST 和ALT 升高,肝组织中增殖蛋白Ki-67 和干细胞指标LGR5 均显著升高。而当使用GW788388 抑制TGF-β 通路后,肝功能指标AST 和ALT 升高进一步升高,而Ki-67 和LGR5 阳性的细胞数目被显著抑制。TGF-β/Smad 是促进细胞增殖的重要通路,Smad 可提高Ki-67 基因的转录水平,进而提高Ki-67 蛋白的表达促进细胞增殖[28]。并且Ki-67 的水平也是评估肝再生的关键蛋白[15]。LGR5 是一种孤儿受体蛋白,是消化系统组织中的干细胞的标志物,研究显示肝组织中LGR5 阳性的细胞会提高肝细胞的自我更新能力[16]。并且LGR5阳性肝细胞也可以缓解肝纤维化减少肝细胞损伤[17]。而LGR5 的 表达 受 到TGF-β/Smad 通路 的 调控,研究显示TGF-β/Smad 能够通过促进LGR5 的表达提高胃癌细胞增殖能力[18]。也有研究发现TGFβ/Smad 通路的激活能够提高LGR5 蛋白的表达诱导结直肠癌细胞的干细胞特性[29]。有研究[30]显示肝部分切除后TGF-β/Smad 通路赋予肝星状细胞干细胞特征,这提示肝纤维化大鼠在进行肝部分切除术后,TGF-β/Smad 通路相关蛋白表达会上调,进而促进Ki-67 和LGR5 蛋白的表达,从而诱导肝细胞增殖,并提高干细胞水平,进一步增殖和分化为肝细胞,促进肝脏再生和肝组织修复。
综上所述,本研究结果初步揭示了肝部分切除术能够通过调控TGF-β/Smad 信号通路促进肝纤维化大鼠模型术后7 d 内的肝再生,可能为肝脏纤维化治疗提供一个新的治疗思路。
利益冲突:所有作者均声明不存在利益冲突。
