新型炎性指标AAR-GPR对肝细胞癌患者术后预后的预测价值
2022-02-15吴文龙贾玉松张文杰聂耶李建辉杨龙
吴文龙,贾玉松,张文杰,聂耶,李建辉,杨龙
(1.中国人民解放军空军军医大学西京医院肝胆外科,陕西西安710032;2.河南省鹤壁市人民医院普通外科,河南鹤壁458031;3.西北大学生命科学学院,陕西西安710069)
原发性肝癌是全球第六大最常见的癌症,也是癌症死亡的第三大原因, 其中肝细胞癌(hepatocellular carcinoma, HCC) 的比例在75%~85%[1]。原发性肝癌在我国常见恶性肿瘤中排名第四,肿瘤致死病因中排名第二,对我国人民的生命和健康造成了严重威胁[2-3]。HCC 的治疗方式有手术切除、肝移植术、局部消融治疗、经动脉化疗栓塞(TACE)、系统治疗等。目前,手术切除依然是早期HCC 的主要治疗方式[4-6]。尽管近年来在诊断和手术技术方面取得了进展,HCC 的临床预后仍然很差[7]。探寻新的肝癌预后指标,越来越受到科研工作者的重视。研究报道白蛋白-碱性磷酸酶比值(albumin to alkaline phosphatase ratio,AAPR)对肺癌、肾细胞癌、鼻咽癌、乳腺癌等多种癌症的预后有影响[8-11],包括经TACE 治疗的肝癌患者以及肝癌肝移植患者[12-13]。谷氨酰转肽酶-血小板比值(gamma-glutamyl transpeptidase to platelet ratio,GPR)可以预测慢性乙肝患者的肝纤维化、肝硬化以及HCC 的进展,并且是乙肝相关性肝癌的有效预后指标[14-16]。而术前碱性磷酸酶-白蛋白比值(alkaline phosphatase to albumin ratio,AAR) 和GPR对HCC 切除术预后的影响研究较少,联合使用AAR 和GPR 对HCC 切除术预后的研究尚未报道。本文主要研究术前AAR 和GPR 对HCC 切除术患者生存期的影响,探讨AAR、GPR 单独及合并使用的预后价值。
1 资料与方法
1.1 研究对象
研究对象 为2014年1月1日—2017年12月31日在中国人民解放军空军军医大学西京医院肝胆外科行HCC 切除术患者394 例。纳入标准为:⑴经病理学诊断的HCC;⑵外科切除作为首次治疗;⑶切除边缘为阴性;⑷>18 周岁;⑸完整的术前检查。排除标准:⑴本次肝切除术前已有肝切除、局部消融、经动脉化疗栓塞(TACE)、化疗等治疗;⑵伴有其他恶性肿瘤;⑶HCC破裂;⑷临床资料不完整。根据纳入和排除标准,最终347 例患者纳入了研究。所有患者已签署知情同意书,本研究得到了中国人民解放军空军军医大学西京医院医学伦理委员会的批准(批件号KY20202115-C-1)。
1.2 观察指标
收集患者性别、年龄、乙肝病史等基本资料;术前治疗史,肝功能,甲胎蛋白(alpha fetoprotein,AFP),血常规,其中AAR、GPR 计算方法为:AAR=碱性磷酸酶(IU/L)/白蛋白(g/L),GPR=谷氨酰转肽酶(IU/L)/血小板(109/L);肿瘤的直径、数目、分化程度、包膜、门脉侵犯和微血管侵犯等病理指标;术后局部消融或TACE 治疗史,有无使用靶向药;计算对应的肝癌分期:巴塞罗那(Barcelona Clinic Liver Cancer,BCLC)分期、美国癌症联合委员会(American Joint Committee on Cancer, AJCC) 分 期、中国肝癌(China Liver Cancer,CNLC)分期。
1.3 随访
所有患者均通过门诊病历系统和电话进行随访,从手术日开始,每3 个月随访1 次。随访终点为患者死亡或失访。总生存期定义为手术日至患者死亡或失访的时间。
1.4 统计学处理
使用SPSS 22 软件进行数据分析。使用SPSS 22软件的随机数生成器,对347 例患者生成随机数(随机数种子20220102),将347 例患者按照7∶3 随机分为两组,70.0%(243 例)的病例作为训练集,30.0%(104 例)的病例作为验证集。应用χ2检验比较各变量的分布在训练集和验证集之间有无差异,P<0.05 为差异有统计学意义。在训练集中,通过X-tile 软件(Version 3.6.1),依据生存资料取AAR 和GPR 的最佳截断值,根据AAR 和GPR 的最佳截断值将人群分为两组。应用GraphPad Prism(Version 8.0.2)绘制AAR 和GPR 的不同分组在训练集和验证集中的Kaplan-Meier 生存曲线,Log-rank 检验组间差异,P<0.05 为差异有统计学意义。通过Cox 单因素(P<0.1 纳入多因素) 和Cox 多因素分析,在训练集和验证集中研究影响术后生存期的独立危险因素,计算危险因素的风险比(hazard ratio,HR) 及95% 可信区间(confidence interval,CI),P<0.05 为差异有统计学意义。构建炎性指标模型AAR-GPR,并分别在训练集和验证集中确认其是否为影响预后的独立危险因素。通过R3.2 软件计算炎性指标模型AAR、GPR、AAR-GPR 的C 指数及似然比。根据C 指数及似然比,比较模型的预测精度和一致性。通过Kaplan-Meier 生存曲线,在训练集和验证集中研究AAR-GPR 的组间差异。
2 结 果
2.1 AAR和GPR的最佳截断值
根据X-tile 软件的结果,AAR 的最佳截断值为2.61(图1A),AAR≥2.61 组(灰色曲线)与AAR<2.61 组(蓝色曲线)的差异有统计学意义(P<0.001)(图1B);GPR 的最佳截断值为0.39 (图1C),GPR≥0.39 组 与GPR<0.39组的差异有统计学意义(P<0.001)(图1D)。将AAR≥2.61定义为1 分,AAR<2.61 定义为0 分;GPR≥0.39 定义为1 分,GPR<0.39 定义为0 分; 在AAR 与GPR 联合模型中(AAR-GPR),AAR≥2.61 且GPR≥0.39 定 义为2 分,其余情况定义为≤1 分。
2.2 患者基线特征
本研究共纳入347 例HCC 切除术患者,290 例(83.6%)男性;300 例(86.5%)有乙肝病史;222 例(64%)有肝硬化;21 例(6.1%)有门脉侵犯;11 例(3.2%) 有腹水;172 例(49.6%)存在微血管侵犯。为了便于计算分析,9例BCLC-0期的患者归入BCLC-A 期,5 例AJCC-IV 期患者归入AJCC-III 期。各变量在训练集和验证集的分布情况见下表。统计检验结果提示,除了AJCC 分期的分布在训练集和验证集之间有差异(χ2=6.21,P=0.045),其他变量差异均无统计学意义(均P>0.05),提示训练集和验证集在总体分布上无差异(表1)。

表1 两组临床基线特征表[n(%)]Table 1 Clinical baseline characteristics of the two groups of patients[n(%)]
2.3 随访结果
截至随访终止时间2020年6月30日,347 例患者的中位随访时间为45 个月,共有147 例死亡,1、3、5年的累积生存率分别为84.6%、59.4%、52.2%。
2.4 Cox单因素及多因素分析
在训练集中,单因素分析表明,AFP (P<0.001),腹水(P<0.001),肿瘤数目(P=0.036),肿瘤直径(P<0.001),细胞分化(P=0.099),肿瘤包膜(P<0.001),门脉侵犯(P<0.001),Child 分级(P=0.040),微血管侵犯(P=0.001),AAR (P<0.001),GPR(P<0.001)符合纳入多因素分析的标准(P<0.1),将以上变量纳入Cox 多因素分析后,提示AFP (HR=1.689,P=0.012),肿瘤直径(HR=1.904,P=0.003), 肿瘤包膜 (HR=2.933,P<0.001),门脉侵犯(HR=2.033,P=0.047),AAR(HR=1.904,P=0.003),GPR (HR=2.159,P=0.002)是影响术后生存期的独立危险因素(表2)。由于炎性指标AAR-GPR 是由AAR 和GPR 构成的,为了避免与AAR 及GPR 同时纳入Cox 多因素分析造成的相互影响,将炎性指标AAR-GPR 同除AAR 和GPR 之外的其他P<0.1 的单因素一起纳入多因素分析(表格未展示)。结果显示,单因素分析与多因素分析结果均有统计学意义(HR=3.278,95%CI=2.200~4.886,P<0.001;HR=2.872, 95%CI=1.901~4.340,P<0.001)。
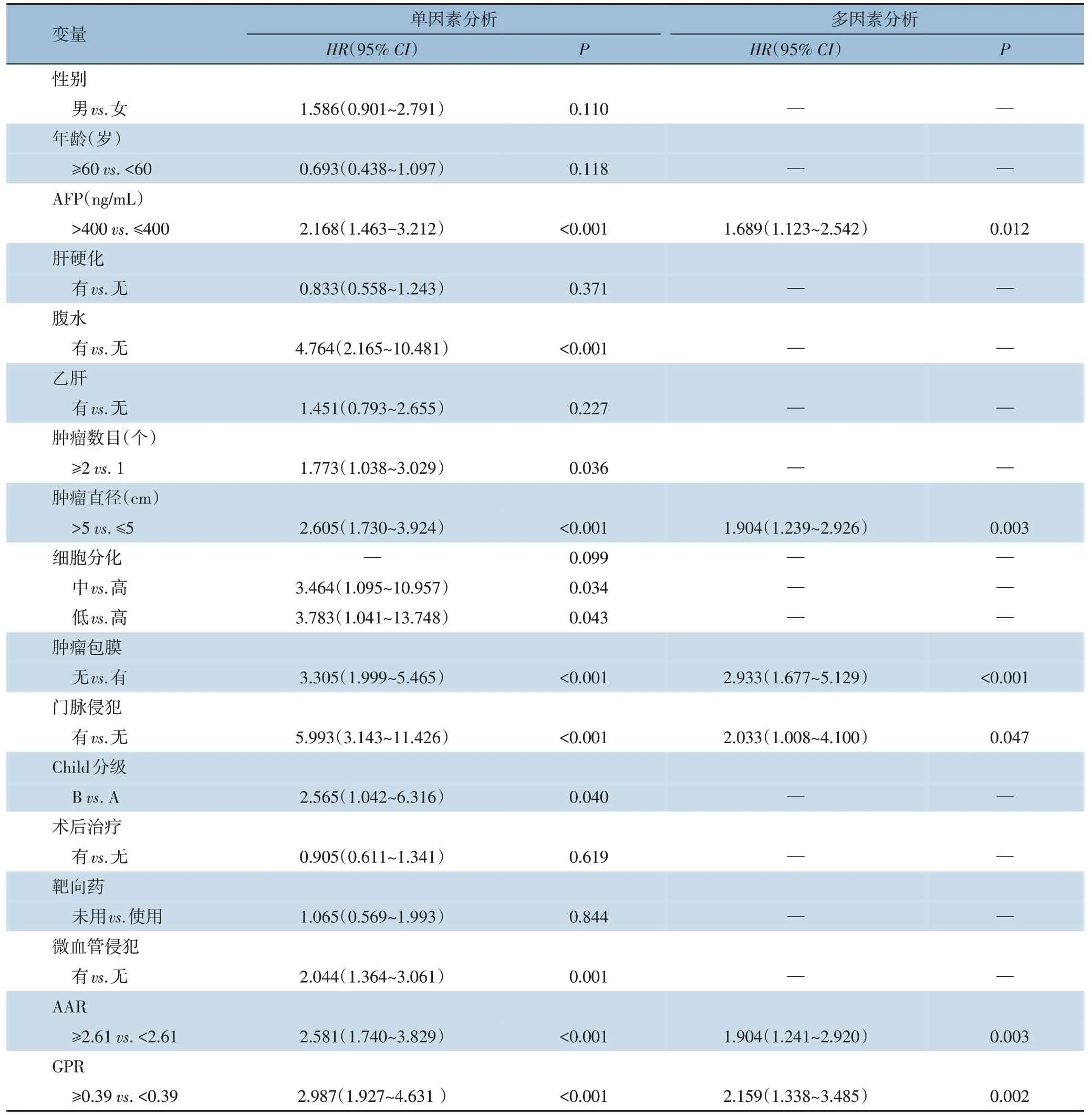
表2 训练集的Cox单因素及多因素生存分析Table 2 Cox univariate and multivariate analysis of survival in training set
在验证集中,单因素分析表明,肝硬化(P=0.091),肿瘤数目(P=0.045),肿瘤包膜(P=0.065),门脉侵犯(P=0.088),微血管侵犯(P=0.010),AAR(P=0.001),GPR(P=0.001)符合纳入多因素分析的标准(P<0.1),将以上变量纳入多因素分析后,提示AAR (HR=2.245,P=0.008),GPR(HR=2.646,P=0.006)是影响术后生存期的独立危险因素(表3)。进一步单独对AAR-GPR 进行单因素及多因素分析,结果显示,单因素分析与多因素分析结果均有统计学意义(HR=4.420,95%CI=2.473~7.899,P<0.001;HR=4.643, 95%CI=2.584~8.346,P<0.001)。

表3 验证集的Cox单因素及多因素生存分析Table 3 Cox univariate and multivariate analysis of survival in validation set
2.5 AAR、GPR以及AAR-GPR对患者生存率的影响
在训练集中,AAR≥2.61 组 与AAR<2.61 组、GPR≥0.39 组与GPR<0.39 组、AAR-GPR=2 分与AARGPR≤1 分组间的生存率差异均有统计学意义(均P<0.001)(图2A)。在 验 证集中,AAR≥2.61 组 与AAR<2.61 组、GPR≥0.39 组 与GPR<0.39 组、AARGPR=2 分与AAR-GPR≤1 分组间的生存率差异均有统计学意义(均P<0.001)(图2B)。
2.6 AAR、GPR和AAR-GPR的预测价值比较
R软件计算得出,AAR、GPR和AAR-GPR的C指数分别为0.765、0.772、0.831;似然比分别为12.11、13.43、24.36 (表4)。AAR-GPR 有更大的C 指数(0.831)和似然比(24.36),提示与单独使用AAR 或GPR 相比,AAR-GPR 有更好的预测精度和一致性。

表4 验证集AAR、GPR、AAR-GPR的C指数和似然比Table 4 The C-index and likelihood ratio of AAR,GPR and AAR-GPR in validation set
3 讨 论
HCC 严重威胁我国人民健康和生命,根治性切除手术或肝移植是HCC 患者获得长期生存的最有效方法。由于供肝严重短缺,手术切除成为HCC 的主要治疗方式[17]。有研究[18]报道,经皮射频消融术与腹腔镜肝切除术对原发性小肝癌的疗效及预后差异无统计学意义,而且射频消融术后并发症较少;但最新研究显示手术切除后局部复发率显著低于射频消融,两种治疗后长期生存无差异的原因可能在于复发后患者接受了更多的挽救性治疗[19]。因此手术切除依然在HCC 的治疗方式中占据着主导地位。
促肿瘤炎症作为恶性肿瘤的重要标志之一,促进了恶性肿瘤的发生和进展[20]。HCC 是典型的炎症相关性恶性肿瘤,肿瘤相关巨噬细胞、中性粒细胞和肿瘤浸润性淋巴细胞等细胞组分是肝癌微环境的主要成分[21]。近年来一些典型的炎性指标如中性粒细胞- 淋巴细胞比值(neutrophil to lymphocyte ratio,NLR)、血小板-淋巴细胞比值(platelet to lymphocyte ratio,PLR)被证实与HCC 的预后相关[22-23]。研究[24-25]指出术前NLR 是影响小肝癌患者并发微血管侵犯的独立危险因素之一,可作为一种临床上简便易行的预测指标[24],术前PLR可作为预测肝癌切除术患者预后不良的生物指标,其有效预测临界值取值应>100。也有研究[26-27]发现,PLR 值升高与血管侵犯、肿瘤数量、AFP 水平或肿瘤分级并不显著相关,NLR 水平在肿瘤最大直径、AFP、多病灶或门静脉癌栓方面没有显著差异。因此这些炎性指标与HCC 预后的关系及其内在联系需要进一步研究。
当患者肝功能良好时,临床医生可以采用更灵活的治疗方法,良好的肝功能储备有利于HCC患者的预后[28]。因此,本研究将重点放在了与肝功能相关的炎性指标AAR 和GPR。Zhang 等[29]发现在接受射频消融作为初始治疗的早期肝癌患者中,AAPR 可以作为肿瘤复发和预后的预测因子。Chan等[30]报道无论治疗方案如何,AAPR 都是HCC 患者的独立预后指标。而AAR 与HCC 切除术预后的研究较少。既往文献多用AAPR,其比值<1,比值越小,预后越好。为了方便计算和更易理解,本研究使用AAR 来研究HCC 切除术的预后。碱性磷酸酶和白蛋白均是临床上常用的肝功能指标。碱性磷酸酶是一种水解酶,存在于人体所有的组织和器官,特别是在肝脏、骨骼、肾脏和胎盘中。多项证据表明,碱性磷酸酶在促进癌细胞增殖、血管浸润和远处转移中发挥重要作用[31],通过调节嘌呤能信号在炎症反应中发挥作用,从而阻断炎症信号,引起抑制性免疫反应[32]。因此,碱性磷酸酶升高预示着不良的预后。而白蛋白水平可反映肝脏的蛋白质合成功能,是一种重要的营养指标,被纳入到Child-Pugh 分级中。低白蛋白血症反映了肝功能障碍和营养不良,损害患者的免疫功能,导致不良预后。白蛋白还能调节全身和器官的炎症反应,在肿瘤发展中发挥抗氧化作用[33]。本研究结果表明,无论在训练集还是验证集中,AAR 升高(≥2.61)都是HCC 切除术后影响生存期的独立危险因素。
谷氨酰转肽酶是反映肝功能的另一个重要指标。HCC 发生模型显示谷氨酰转肽酶表达与肿瘤的形成和进展有关[34]。报道[35]指出,血清谷氨酰转肽酶是射频消融治疗的HCC 患者的预后标志物。血小板作为一种与癌症相关的指标,可以被癌细胞激活,血小板的激活会导致癌症相关的炎症、转移和进展[36]。Lemoine 等[14]最早报道在西非国家中,GPR 可以预测慢性乙肝患者的肝纤维化和肝硬化,GPR 与癌症的关系由此受到越来越多的关注。术前GPR 可作为乙肝相关性肝癌患者预后的一种有效预测指标,并且在AFP 阴性HCC 的发展中起着重要的作用,尤其是在早期AFP 阴性HCC患者[37-38]。
作为HCC 常见的肿瘤标志物,血浆AFP 水平在15%~30% 的晚期HCC 患者中保持在正常范围内[39]。在本研究中,AFP 在训练集中为影响预后的独立危险因素,但在验证集中经过Cox 多因素分析被排除。进一步在总体数据347 例HCC 患者中对AFP 进行了研究,发现AFP 仍然不是影响HCC 切除术预后的独立危险因素。因此,可以说明,就本次纳入的HCC 患者的生存资料而言,本研究所提出的炎性指标模型AAR-GPR 在预后判断方面优于AFP。但受限于单中心样本量,仍需要进一步的验证。近年来新提出的肿瘤标志物脱-γ-羧基凝血酶原(DCP)在临床也得到了极大关注,但由于部分患者无此项检查资料,本研究未能将该指标纳入研究。
本研究发现,无论在训练集还是验证集,AAR 和GPR 均是影响HCC 切除术后生存期的独立危险因素。因此,笔者猜想AAR 与GPR 的联合使用即AAR-GPR 可能会成为HCC 切除术后更优化的预后指标。为了避免与AAR 及GPR 同时纳入多因素分析的相互影响,本研究又单独对炎性指标模型AAR-GPR 在训练集和验证集中进行了单因素及多因素分析,发现在训练集和验证集,AAR-GPR均是影响HCC 切除术后生存期的独立危险因素。研究表明,和单独使用AAR 或GPR 相比,联合指标AAR-GPR 有更大的C 指数和似然比,提示AARGPR 有更好的预测精度和一致性。在训练集及验证集中,AAR-GPR=2 分与AAR-GPR≤1 分的组间差异有统计学意义(P<0.001),AAR-GPR=2 分的患者的生存率显著低于AAR-GPR≤1 分的患者。
炎性指标模型AAR-GPR 作为HCC 切除术的预后指标,其构成要素来源于常规检查肝功能和血常规,具有经济性,易获得性及可重复性的优点,将为HCC 切除术的预后判断及随访提供理论指导。本研究虽将人群分为了训练集和验证集用来提高研究结果的科学性,但毕竟只是单中心的小样本量研究,其结果的稳定性仍然需要多中心、大样本量的人群来做进一步研究。
利益冲突:所有作者均声明不存在利益冲突。
