催化性抗氧化剂AEOL-10150对氮芥诱导小鼠急性肝损伤的保护作用
2022-02-15徐安琦孔德钦于卫华张晓迪海春旭李文丽刘江正
艾 多,徐安琦,孔德钦,刘 颖,于卫华,王 钊,彭 洁,刘 瑞,张晓迪,海春旭,李文丽,王 欣,刘江正,*
(1.空军军医大学军事预防医学系军事毒理学与防化医学教研室,陕西省自由基生物学与医学重点实验室,教育部特殊作业环境危害评估与防治重点实验室,陕西 西安 710032;2.空军军医大学基础医学院学员二大队,陕西 西安 710032;3.陆军防化学院,北京 102205)
糜烂性毒剂是大规模杀伤性武器——“化学武器”的主要毒剂类型,目前中毒机制不清,同时缺乏有效的救治药物[1]。现阶段,我国仍将长期面临一定程度的化学威胁,提高化学战剂医学防护能力具有重要的现实意义。氮芥(nitrogen mustard,HN2)是糜烂性毒剂的典型代表之一,与硫芥(俗称“芥子气”)化学性质类似,常用于构建糜烂性化学毒剂损伤模型。氮芥能够直接损伤组织细胞并导致接触部位的炎症和坏死,同时还能吸收中毒导致肝脏、肺脏和神经系统等远端脏器的结构和功能障碍[2]。氮芥和硫芥等糜烂性毒剂通常属于脂溶性极好的有机化学战剂,较易通过生物膜。富含脂肪组织的肝组织是糜烂性毒剂的重要贮存器官和毒作用器官。氮芥在防化医学领域中常作为硫芥的模拟剂,同时和其他临床抗肿瘤烷化剂的化学结构及毒作用机制类似,针对氮芥开展的医学防治对于指导硫芥染毒和临床常用抗肿瘤烷化剂副作用的诊治具有重要的指导和借鉴意义[3]。虽然皮肤、肺和眼被认为是氮芥毒性的主要靶器官,但临床研究发现,糜烂性毒剂暴露者往往伴有急性肝损伤,一定程度上影响了中毒伤员的预后和转归[4-5]。由于肝脏在机体营养维持、能量代谢和外源性化学物解毒过程中具有核心作用,早期针对肝损伤的救治在糜烂性毒剂中毒伤员的综合救治中可能占有重要地位。目前,针对氮芥诱导急性肝损伤还缺乏特效的救治药物。
氮芥诱导肝损伤的中毒机制十分复杂,自诞生至今尚未完全研究透彻。目前认为有氧化应激、DNA烷化损伤、多聚腺苷二磷酸核糖聚合酶(poly ADPribose polymerase,PARP)激活、炎症反应、蛋白水解酶激活、细胞凋亡和钙稳态失衡等多种假说[6],但氧化应激损伤被普遍认为是氮芥诱导器官损伤的核心毒作用机制。氮芥可以直接损伤线粒体,导致线粒体功能障碍,诱导活性氧(reactive oxygen specis,ROS)大量生成。氮芥暴露还能激活体内各种炎症细胞和先天免疫细胞等,释放大量促炎因子,介导过度炎症反应。过量的炎症因子还能刺激组织细胞ROS生成,形成恶性循环[7],参与了肝损伤的发生和发展。针对氮芥诱导急性肝损伤的氧化应激与炎症机制,我们认为使用安全高效的催化性抗氧化剂可能具有较好的保护作用。
AEOL-10150,化学名称为Mn(III)四(N,N′-二乙基咪唑鎓-2-基)卟啉,结构式如图1所示。AEOL-10150由美国Aeolus药物公司开发,属于金属卟啉催化抗氧化剂,具有高效的超氧化物歧化酶(superoxide dismutase,SOD)和过氧化氢酶(catalase,CAT)活性[8]。AEOL-10150被证明在辐射损伤[9]、硫芥诱导肺损伤[10]中具有十分优异的抗氧化保护作用,但AEOL-10150对氮芥诱导肝损伤是否具有保护作用还未见文献报道。本研究旨在阐明染毒后给予AEOL-10150干预对氮芥诱导肝损伤的保护作用,并初步明确其作用机制,为临床上糜烂性毒剂导致急性肝损伤的科学防治提供新方法和新思路。

图1 AEOL-10150的化学结构式
1 材料与方法
1.1 实验动物
雄性清洁级C57BL/6小鼠40只,体质量(22.0±1.5)g,购于空军军医大学动物实验中心,饲养于本教研室动物房内,自由摄入自来水和普通饲料,染毒实验前适应性喂养1周。饲养环境相对湿度(50±10)%,空调系统维持温度约(25±2)℃,12 h/12 h明暗交替循环,每日定时观察动物一般状况并记录。
1.2 试剂与仪器
1.2.1 主要试剂 AEOL-10150(CAS号286475-30-7)购自中国MedChemExpress(MCE)生物试剂有限公司,盐酸氮芥(CAS号55-86-7)购自美国Sigma公司。丙二醛(malondialdehyde,MDA)含量检测试剂盒、还原型谷胱甘肽(reduced glutathione,GSH)含量测定试剂盒、蛋白提取试剂盒购自北京索莱宝科技有限公司。髓过氧化物酶(myeloperoxidase,MPO)活性检测试剂盒购自武汉华美生物工程有限公司。活性氧荧光探针DHE购自中国碧云天生物技术研究所。RNA提取试剂盒、RNA反转录试剂盒、SYBR Green一步法RT-PCR试剂盒购自中国康为世纪生物科技有限公司。BCA蛋白定量试剂盒购自美国Thermo Scientific公司。Lamin B一抗购自美国Cell signaling technology公司,核因子红系2相关因子(nuclear factor-erythroid 2 related factor,Nrf-2)一抗和羊抗兔二抗体购自武汉博士德生物技术有限公司。其他所用化学品均为化学纯以上级别。
1.2.2 主要仪器 TE2000正置显微镜和激光共聚焦显微镜购于日本OLYMPUS公司;SCIENTZ-48高通量组织研磨器购于宁波新芝公司;全自动高速冷冻离心机购于美国Sigma公司;Infinite M200 Pro全波段酶标仪购于瑞士Tecan公司;NanoDrop 2000分光光度计购于美国Thermo公司,Mini-PROTEAN电泳系统、蛋白半干转装置及凝胶成像分析系统购自美国Bio-Rad公司。
1.3方法
1.3.1 动物分组和处理 所有实验设计及操作均按照空军军医大学实验动物福利与伦理委员会批准的方案(FMMU-IACUC-2020YF08)进行。随机数表法将40只C57BL/6雄性小鼠分为4组:对照组、AEOL-10150对照组、氮芥染毒组、AEOL-10150治疗组,每组10只。HN2染毒剂量由预实验结果确定,约为腹腔暴露途径下对小鼠的半数致死量的1/2,AEOL-10150剂量参考相关文献及预实验结果。氮芥染毒组腹腔注射HN2(2 mg/kg),0.5和6 h后分别腹腔注射生理盐水(10 mL/kg),AEOL-10150治疗组染毒0.5和6 h后分别腹腔注射AEOL-10150(5 mg/kg),对照组和AEOL-10150对照组腹腔注射生理盐水,其余处理分别与氮芥染毒组和AEOL-10150治疗组相同。氮芥和AEOL-10150均溶解于生理盐水中,配制浓度分别为0.2和0.5 mg/mL,按照10 mL/kg腹腔注射染毒或给药。HN2染毒后3 d,禁食8 h后检测体质量。处死前使用异氟烷吸入麻醉,进而眼球取血,然后解剖小鼠,收集肝脏并称取质量。部分肝组织液氮冻存制备冰冻切
片,部分用4%多聚甲醛溶液固定,剩余肝组织于-80℃条件下保存。
1.3.2 苏木素-伊红(HE)染色进行组织病理学检测取部分右侧肝组织用4%多聚甲醛固定,经过蒸馏水清洗-乙醇梯度脱水-二甲苯透明-石蜡包埋-切片-苏木素-伊红(HE)染色等步骤,其中切片采用Leica RM2135型轮转式切片机,切片厚度为4μm,染色后树胶封片。使用正置光学显微镜(Nikon,Japan)观察图像并拍照。
1.3.3 血清谷丙转氨酶和谷草转氨酶活性检测 眼球取血后置于2 mL的EP管中,室温静置2 h,然后1 500 g离心10 min,小心分离上清。使用商品化血清谷丙转氨酶(alanine aminotransferase,ALT)和谷草转氨酶(aspartate aminotransferase,AST)活性检测试剂盒,严格按照说明书实验步骤检测ALT和AST活性,单位为U/mL。
1.3.4 肝组织MDA、GSH及MPO活性检测 使用眼科剪将50 mg肝组织剪碎,置于4 mL的EP管中,加入1.95 mL预冷的生理盐水,SCIENTZ-48高通量组织研磨器冰浴条件下钢珠振荡匀浆(50 Hz频率,运行10 s,停止30 s,重复5次),制备成2.5%肝组织匀浆,用以测定MDA、GSH及MPO活性指标。采用商品化组织MDA、GSH含量及MPO活性测定试剂盒测定上述指标,严格按照试剂盒说明书操作。BCA法测定匀浆液蛋白浓度,MDA、GSH含量单位为μmol/mg。
1.3.5 DHE探针检测肝组织活性氧水平 实验结束后,使用小动物麻醉机吸入异氟烷麻醉,眼球取血后立即打开腹腔,取部分肝组织置于干冰中,立即切成8μm厚的冰冻切片,并用核荧光染料Hoechst(10 μmol/L)和活性氧荧光探针DHE(10μg/mL)于37℃避光孵育15 min,然后PBS漂洗3次,每次30 s,甘油封片后在激光共聚焦显微镜下观察拍照,最后计算荧光强度。
1.3.6 ELISA法检测血清TNF-α和IL-1β浓度 采用TNF-α和IL-1β小鼠ELISA测定试剂盒测定血清相关炎症因子浓度,严格按照试剂盒说明书操作,血清TNF-α和IL-1β浓度的单位为pg/mL。
1.3.7 qPCR检测Nrf-2 mRNA水平 使用商品化通用型RNA提取试剂盒(康为世纪)从小鼠肝组织中提取总RNA并使用NanoDrop 2000分光光度计(Thermo Fisher Scientific,美国)分析RNA的浓度和纯度。鉴定纯度及浓度合格后,使用cDNA合成超级混合试剂盒(康为世纪)对提取的总RNA(2μg)进行逆转录。反应条件如下:42℃、60 min,70℃、5 min。使用QuantStudio 7 Flex实时PCR系统(Thermo Fisher Scientific,美国)和SYBR Green PCR master Mix快速扩增试剂盒(康为世纪)进行基因扩增,循环条件为95℃、15 s,60℃、20 s,72℃、20 s。mRNA的相对定量值使用2-ΔΔCT方法,β-肌动蛋白(β-actin)基因作为内参基因。
实验中所使用引物的详细信息见表1。

表1 qPCR实验所用基因引物序列
1.3.8 Western blot法检测Nrf-2蛋白表达水平 准确称取100 mg肝组织,使用商品化核蛋白提取试剂盒提取胞浆蛋白和核蛋白。使用BCA蛋白定量试剂盒检测样品蛋白浓度,制备SDS蛋白样本,取50μg蛋白样本使用SDS-PAGE垂直电泳仪分别以90和120 V电压完成浓缩胶和分离胶电泳,然后使用Trans-Blot蛋白半干式转膜仪将蛋白转移至预先浸泡甲醇的PVDF膜上。将膜置于5%脱脂牛奶中室温封闭约1 h,TBS清洗后,4℃振荡条件下孵育Lamin B和Nrf-2一抗过夜,次日使用TBST洗涤3次,每次10~15 min,然后加入羊抗兔二抗(1∶5 000稀释),室温孵育1 h后,使用TBST洗涤3次,每次10~15 min,最后使用ECL化学发光试剂,采用全自动化学发光仪显影。使用ImageJ软件分析条带的灰度值,计算Nrf-2核蛋白的相对表达水平,Lamin B为内参蛋白。
1.3.9 统计学方法 实验数据采用±s表示,使用Graphpad Prism 8.0软件统计和分析数据,Tukey's multiple comparison test检验用于比较组间差异的显著性,以α=0.05为检验水准。
2 结果
2.1 AEOL-10150处理对氮芥诱导肝损伤的保护作用
小鼠肝损伤相关指标的检测结果见图2,与对照组相比,氮芥染毒后小鼠空腹体质量显著降低(P<0.05),AEOL-10150对照组小鼠体质量差异无统计学意义(P>0.05),同时各组之间肝体比也无显著差异(P>0.05)。AEOL-10150单独处理对血清ALT和AST活性无显著影响(P>0.05),提示AEOL-10150在该剂量条件下无显著肝脏毒性。与对照组相比,氮芥染毒导致血清ALT和AST活性明显升高(P<0.05),而AEOL-10150治疗组能够显著抑制氮芥导致的血清ALT和AST活性增加(P<0.05)。以上结果表明,AEOL-10150干预治疗对氮芥诱导肝功能损伤具有显著的保护作用。

图2 AEOL-10150对氮芥诱导肝损伤的影响(n=10)
HE染色结果见图3,与对照组相比,AEOL-10150对照组小鼠肝组织结构无明显变化,而氮芥染毒导致肝组织发生显著的肿胀性改变,肝细胞胞质呈现颗粒空泡样变,特征性的肝小叶结构受到一定程度破坏,同时还伴有少量炎症细胞浸润,而AEOL-10150治疗后能够有效减轻氮芥导致的肝脏病理结构异常,进一步证实AEOL-10150干预对氮芥诱导肝损伤具有保护作用。

图3 AEOL-10150对氮芥诱导肝组织病理学改变的影响(HE染色,×40倍)
2.2 AEOL-10150处理显著抑制氮芥诱导的小鼠肝组织氧化应激损伤
为了明确AEOL-10150的肝保护作用机制,我们采用基于DHE探针的ROS检测试剂盒和MDA含量检测试剂盒检测了小鼠肝组织ROS水平及MDA含量,结果见图4。与对照组相比,AEOL-10150对照组小鼠肝组织ROS水平和MDA含量均无显著变化(P>0.05),但氮芥染毒能够导致上述指标的显著上升(P<0.05);与氮芥染毒组比较,AEOL-10150治疗后可显著抑制小鼠肝组织ROS水平和MDA含量的升高(P<0.05)。以上结果表明,AEOL-10150治疗能够通过抑制ROS过量生成,减轻氮芥染毒导致的小鼠肝组织氧化应激损伤。
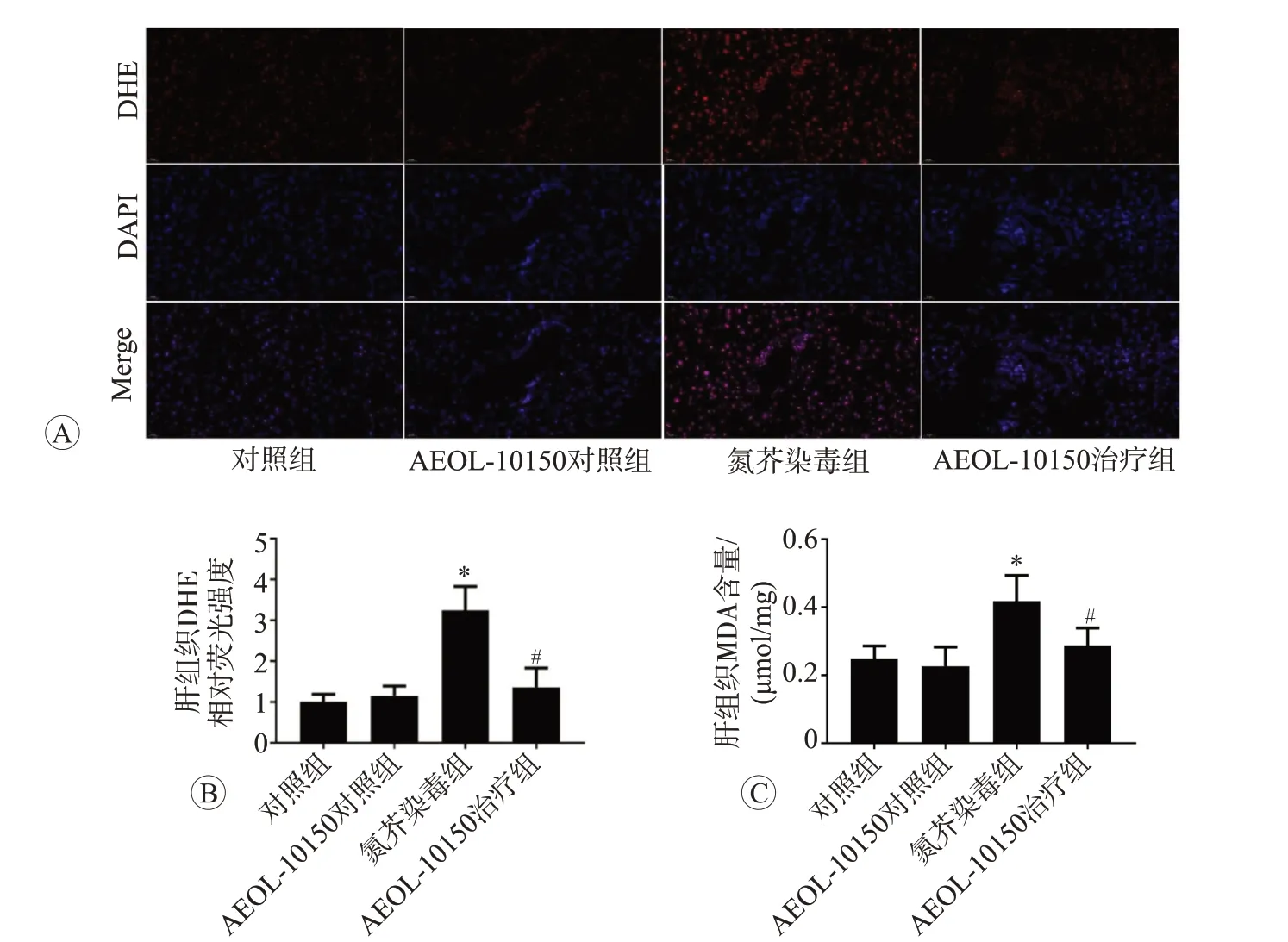
图4 AEOL-10150对氮芥诱导的小鼠肝组织氧化应激损伤的影响
2.3 AEOL-10150干预对氮芥暴露小鼠肝组织抗氧化功能的影响
为了明确AEOL-10150发挥抗氧化保护作用的确切机制,我们检测了肝组织抗氧化防御体系功能相关指标,结果见图5。GSH是体内最重要的非酶性抗氧化剂,与对照组相比,AEOL-10150对照组对肝组织GSH含量无显著影响(P>0.05),而氮芥染毒导致肝组织上述指标显著降低(P<0.05);与氮芥染毒组比较,AEOL-10150治疗组逆转了氮芥诱导的肝组织GSH水平的降低(P<0.05)。为了进一步明确AEOL-10150是否能发挥对抗氧化酶的调控作用,我们检测了Nrf-2 mRNA表达及蛋白核转位情况。qPCR检测结果表明,AEOL-10150对照组对Nrf-2的mRNA表达无显著影响,而氮芥暴露导致Nrf-2的mRNA表达显著增加(P<0.05)。与氮芥染毒组相比,AEOL-10150治疗组降低了Nrf-2 mRNA的表达(P<0.05)。如图5C、D所示,氮芥染毒导致Nrf-2蛋白在细胞核内表达显著升高,而AEOL-10150干预显著抑制了氮芥导致的Nrf-2核转位。由于Nrf2被认为是体内抗氧化酶的正向调控分子,上述结果提示AEOL-10150的抗氧化作用可能不依赖于Nrf-2介导的抗氧化酶活化。
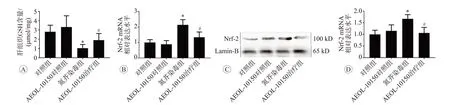
图5 AEOL-10150对氮芥诱导小鼠肝组织抗氧化功能的影响
2.4 AEOL-10150干预减轻了氮芥诱导小鼠肝组织的炎症反应
炎症反应和氧化应激密切相关[11],为了明确AEOL-10150在炎症反应中发挥的保护作用,我们检测了肝组织MPO活性及血清中炎症因子TNF-α和IL-1β的浓度,结果见图6。与对照组相比,AEOL-10150对照组对上述指标无显著影响(P>0.05),但氮芥暴露显著升高了小鼠肝组织的肝组织MPO活性及血清中炎症因子TNF-α和IL-1β的浓度(均为P<0.05)。AEOL-10150治疗组肝组织MPO活性及血清中炎症因子TNFα和IL-1β的浓度较氮芥染毒组均显著降低(均为P<0.05)。这些结果提示AEOL-10150可能通过抗炎作用,发挥了对氮芥诱导肝损伤的保护作用。

图6 AEOL-10150对氮芥诱导小鼠肝组织炎症反应的影响
3 讨论
针对糜烂性毒剂的生物学效应及防治研究一直是防化医学研究的热点和难点。糜烂性毒剂中毒伤员往往伴有肝功能异常。氮芥是一种经典的糜烂性毒剂,针对氮芥开展的防治研究对于糜烂性毒剂医学防护具有重要的指导意义。AEOL-10150是一种金属卟啉催化抗氧剂,兼具有超氧化物歧化酶和过氧化氢酶功能,拥有强大的抗氧化活性,可减轻辐射导致的肺损伤,也能减轻硫芥暴露导致的呼吸道损伤[8]。硫芥类似物2-氯乙基乙基硫化物(CEES)暴露1 h后,AEOL-10150干预可有效降低细胞毒性和线粒体功能障碍[10]。但AEOL-10150对糜烂性毒剂导致的急性肝损伤是否具有保护作用尚不清楚。本文通过给予小鼠腹腔注射氮芥,成功构建了糜烂性毒剂诱导急性肝损伤模型,在此基础上研究了AEOL-10150的保护作用及机制。
AEOL-10150作为一种新型催化性抗氧化剂,其水溶性好、生物利用度高,本实验所使用的AEOL-10150剂量为5 mg/kg,重复两次给药,间隔5.5 h。该给药方案主要参考和借鉴了相关文献[12]报道及预实验结果,该方案能够保证体内药物较长时间维持在有效浓度,进而更好的发挥抗氧化作用。氮芥染毒显著减轻了动物体质量,提示氮芥中毒可能是一种消耗性疾病。虽然AEOL-10150干预对染毒小鼠体质量和肝体比均无显著影响,但HE染色病理结果显示,AEOL-10150干预有效减轻了氮芥导致的小鼠肝细胞肿胀和结构紊乱,提示其具有较好的保护作用。肝脏是ALT和AST主要分布和合成器官,正常生理条件下,ALT和AST主要分布于肝细胞胞浆和线粒体中,血清含量很少[13]。当肝实质细胞受到外源性化学物损伤时,上述酶的大量外漏导致ALT和AST水平显著升高,提示肝损伤的发生和发展,是临床常用和较为敏感的监测指标[14]。与正常组比较,氮芥染毒组小鼠血清中ALT和AST含量显著升高(P<0.05),说明肝功能受损,与病理结构损伤结果相一致。与染毒模型组比较,AEOL-10150干预能够显著抑制血清ALT和AST的升高,证实AEOL-10150具有明确的肝损伤保护作用。
通常认为,氧化应激是糜烂性毒剂发挥毒作用效应的关键机制之一。氮芥等在体内通过烷化作用攻击生物大分子的过程中,会诱导超氧阴离子自由基、羟基阴离子和过氧化氢等ROS的大量生成,进而引起脂质、蛋白质和糖类发生过氧化反应,损伤肝细胞的结构和功能[15]。肝组织ROS检测结果表明,AEOL-10150处理能够显著抑制氮芥导致的ROS水平升高,提示其具有良好的抗氧化能力。同时,生理水平的ROS发挥了重要的信号传导功能。我们发现,AEOL-10150对照组对肝组织ROS水平并无显著影响,提示其不影响ROS的正常生理功能,是一种安全可靠、性能优良的抗氧化剂。MDA是细胞内不饱和脂肪酸氧化产物,具有显著的细胞毒性,组织MDA的含量往往被用作氧化应激的生化标志物。本研究结果表明,AEOL-10150处理能够显著抑制肝组织MDA含量的升高,进一步证实AEOL-10150干预主要是通过抗氧化作用发挥保护作用。
AEOL-10150作为催化性抗氧化剂,主要通过酶作用催化ROS的清除,发挥直接抗氧化作用,为了明确其能够通过诱导抗氧化酶表达显现间接抗氧化作用,我们检测了肝组织抗氧化剂GSH含量和Nrf-2表达。GSH通过提供还原型巯基,表现为非酶性小分子抗氧化剂的作用,在维持氧化还原平衡过程中发挥了重要的生理作用[16]。我们发现,AEOL-10150单独处理并没有提高肝组织GSH水平,提示AEOL-10150不能促进GSH的合成。而氮芥暴露后导致的大量ROS生成,消耗了肝组织GSH含量,导致其水平显著降低。AEOL-10150通过减少ROS大量累积,减少了氮芥对GSH的消耗和抑制,表现为AEOL-10150治疗组小鼠肝组织GSH水平显著升高。Nrf-2是人体内调节抗氧化酶表达的重要转录因子,激活后可以诱导大量抗氧化酶和II相解毒酶下游基因的表达,发挥显著的抗氧化作用,是多种肝损伤保护药物的作用靶点,多种抗氧化剂可以通过激活Nrf2信号通路减轻肝损伤的发生和发展[17]。但在本研究中,AEOL-10150单独处理对Nrf-2的mRNA和核蛋白表达并无显著影响,提示AEOL-10150不能诱导抗氧化酶表达。而氮芥暴露后导致Nrf-2的mRNA和核蛋白表达水平显著升高,我们认为其原因可能是氮芥诱导了氧化应激,进而激活Nrf-2及下游抗氧化酶,属于应激性抗氧化保护反应。本研究中,AEOL-10150治疗组逆转了氮芥染毒导致的肝组织Nrf-2活化,其可能的原因是AEOL-10150通过直接催化过量的ROS的清除,有效减轻了氧化应激,因此氮芥诱导的Nrf-2反馈性激活减弱。以上结果提示,AEOL-10150对氧化应激的拮抗作用可能并不依赖于Nrf-2,主要依靠其自身抗氧化酶特性发挥ROS清除作用。
大量文献表明,糜烂性毒剂诱导的组织损伤与炎症反应关系密切。MPO活性主要反映了中性粒细胞浸润及激活情况,是炎症反应的重要标志物之一。TNFα和IL-1β等炎症因子对外源性化学物诱导肝损伤中发挥了关键的促损伤作用,可以诱导中性粒细胞向肝组织浸润,激活NF-κB信号通路导致炎症瀑布效应[18]。有研究表明,自由基介导的TNF-α级联激活可能是硫芥诱导肺部炎症反应的关键通路[19]。人角蛋白细胞经50~300μmol/L硫芥处理后,TNF-α和IL-1β表达升高[20]。本实验表明,AEOL-10150处理可有效逆转氮芥诱导的小鼠肝组织MPO活性升高及血清TNF-α和IL-1β浓度增加,提示氮芥能够导致显著诱导肝脏和全身炎症反应,而AEOL-10150具有较为优异的抗炎作用,参与了对氮芥诱导肝损伤的保护作用。
综上所述,AEOL-10150对氮芥诱导的小鼠肝损伤具有明显的保护作用,其保护机制可能与AEOL-10150直接清除过量的ROS,发挥抗氧化和抗炎作用有关(图7)。AEOL-10150可能是一种治疗糜烂性毒剂诱导急性肝损伤的有效候选药物,具体机制仍需要进一步研究。

图7 AEOL-10150保护氮芥诱导的急性肝损伤及机制示意图
